鴨疫里默氏桿菌recA基因突變對其生長及DNA損傷反應的影響
吉 果,陳啟偉,宮曉煒,劉永生,鄭福英
(中國農業科學院蘭州獸醫研究所,家畜疫病病原生物學國家重點實驗室,蘭州 730046)
細菌SOS反應又稱為細菌DNA損傷誘導反應,是普遍存在的細菌應對DNA損傷的重要保護機制[1-2]。SOS反應的誘導途徑主要有兩種,即依賴RecA輔蛋白酶活性的途徑和不依賴RecA的通用應激反應途徑。依賴于RecA的SOS反應途徑主要是利用其輔蛋白酶活性,催化包括LexA、噬菌體CI以及UmuC的自裂解,啟動誘導SOS反應;在大多數細菌中,LexA蛋白是RecA表達的重要調節蛋白,是細菌SOS反應的主要抑制因子[3-5]。RecA存在于所有自然狀態下存活的細菌中,在整個細菌領域中的平均序列保守性為60%~70%[3]。RecA是參與基因重組和DNA修復的多功能蛋白,調節SOS誘導的DNA修復蛋白的合成與活性,參與突變形成,在基因重組、DNA修復以及DNA配對和鏈交換中發揮關鍵作用[3-5]。
細菌的SOS反應首先是在對紫外線的響應中被發現[6],但它也與許多物理的(電離輻射,抗生素,酸堿刺激,重金屬破壞)和化學的(烷基化,交聯,氧化劑等)損害DNA的因素有關[7]。環境因素如UV,包括抗生素在內的藥物和熱應激都可以引發和增加活性氧ROS水平,隨之對DNA、蛋白質和脂質造成損傷,從而誘導SOS應答[8]。SOS反應還可以通過誘導基因重組和促進抗性基因的水平轉移使細菌產生抗性[9]。亞抑菌濃度的抗生素誘導的SOS應答和突變已在包括大腸桿菌、霍亂弧菌和鏈球菌上得到證實[7, 10-11]。
鴨疫里默氏桿菌感染鴨、鵝、雞、火雞等家禽和野禽,主要感染1~5周齡的雛鴨,發病鴨的主要剖檢病變為纖維素性漿膜炎。鴨疫里默氏桿菌病在世界各地廣泛分布,具有較高的發病率和死亡率,是造成養鴨業重大損失的主要細菌病之一。鴨疫里默氏桿菌的recA基因為1 032 bp,編碼大小約37.7 ku的蛋白,但目前尚未報道該蛋白的生物學功能。這項工作首次研究了當鴨疫里默氏桿菌受到紫外線輻照損傷時,RecA蛋白調控菌株的SOS反應,獲得的信息有助于增進對鴨疫里默氏桿菌RecA蛋白生物學功能的了解。
1 材料與方法
1.1 試驗材料和菌株(及其培養)
研究中使用的所有細菌菌株、質粒的相關特性和來源見表1。胰蛋白酶大豆肉湯(TSB)、胰蛋白酶大豆瓊脂(TSA)購自美國 BD difcoTM公司,LB肉湯和LB瓊脂購自北京Solarbio公司,2,6-二氨基庚二酸(DPA)購自東京化成工業株式會社;抗生素購自北京Solarbio公司,限制性內切酶SacⅠ、SphⅠ、PstⅠ及質粒提取試劑盒、膠回收試劑盒等均購自TaKaRa公司;多片段一步法快速克隆試劑盒和一步法快速克隆試劑盒購自天津諾禾致源生物信息科技有限公司;0.22 μm 無菌硝酸纖維素膜和過濾器購自美國 Millipore 公司。鴨疫里默氏桿菌RA-GD株和LJW-2株在37 ℃、5%CO2和在含5%小牛血清的TSB或TSA中培養。大腸桿菌X7213株在含有50 μg·mL-1DPA的LB肉湯或LB瓊脂上生長。

表1 本研究所用的菌株與質粒
從四川綿櫻鴨業有限公司(中國成都)購得1日齡櫻桃谷鴨,將動物飼養于清潔環境,室溫保持在28~30 ℃,每天通風兩次。
1.2 方法
1.2.1 ΔrecA缺失株的構建 本研究中所用的引物見表2。ΔrecA缺失株的構建如文獻[13]所述,將突變株中recA基因的位點替換為紅霉素(ermF)抗性基因。以鴨疫里默氏桿菌LJW-2株的DNA為模板,引物ErmF-F/ErmF-R進行擴增,獲得紅霉素(ermF)抗性基因。以RA-GD菌株的DNA作模板,用引物Up-F/Up-R和Dp-F/Dp-R分別擴增recA基因的上游和下游(各600 bp)同源臂序列。最后用SacⅠ和SphⅠ酶切pRE112質粒以獲得載體片段。

表2 PCR與qRT-PCR引物序列
將上游同源臂、ErmF基因、下游同源臂和酶切后的pRE112質粒用多片段一步法快速克隆試劑盒(Novogene,天津)連接,生成重組質粒pRE112::ErmF-600H,并轉化進大腸桿菌X7213。將攜帶pRE112::ErmF-600H重組質粒的大腸桿菌X7213和鴨疫里默氏桿菌RA-GD株共培養,用2 mg·L-1的紅霉素篩選陽性菌株,并用保守引物OmpA-F/OmpA-R和鑒定引物RecA-F/RecA-R和ErmF-F/ErmF進行擴增,并將得到的PCR產物進行測序驗證。得到的缺失株命名為ΔrecA。
1.2.2 c△recA回復株的構建E.coli-R.anatipestifer穿梭質粒pCPRA在前期工作中構建完成[12]。以親本株RA-GD為模板,以引物pCP-RecA-F/pCP-RecA-R擴增攜帶recA基因的片段,并回收。將pCRRA質粒用PstⅠ和SphⅠ雙酶切,回收線性載體片段,用一步法快速克隆試劑盒(Novogene,天津)將recA基因目的片段和載體片段連接,轉化X7213大腸桿菌細胞,以100 μg·mL-1的Amp抗性進行篩選,得到供體菌X7213-pCPRA::RecA。與缺失株ΔrecA共培養,以2 mg·L-1的Cfx進行篩選,得到回復株c△recA。
1.2.3 生長曲線的測定 根據不同時間點的OD600 nm值,在非競爭條件下監測RA-GD、△recA和c△recA菌株的生長曲線。分別將菌株接種至5 mL 含5%小牛血清的TSB中,37 ℃ 200 r·min-1培養至OD600 nm約1.0,并測定每個菌株的菌落形成單位(colony-forming unit,CFU),調整每個菌株的起始濃度均為109CFU·mL-1。以1∶100的比例分別接種至10 mL含血清的TSB中,37 ℃ 200 r·min-1培養。每隔1 h取130 μL菌液用紫外分光光度計測量其OD600 nm值,共測定12 h,每個菌株做3組平行試驗。根據OD600 nm值繪制每個菌株的生長曲線。
1.2.4recA基因的轉錄 將親本株RA-GD培養至 OD600 nm值達到1.0,用60 μW·cm-2的紫外劑量輻照菌株,輻照時間為0、15、30和45 min,提取的樣品mRNA,反轉錄成cDNA,作為模板備用。以RecA-qRT-F/RecA-qRT-R為引物,用qRT-PCR檢測recA基因的轉錄水平;同時用16S-F/16S-R引物擴增rrsA3基因(產物為16S核糖體RNA),作為內參。利用2-△△Ct方法計算recA基因的相對轉錄水平[14]。
1.2.5 DNA損傷試驗 根據細菌基因組的完整性判定雙鏈DNA(dsDNA)的損傷程度,試驗方法參照文獻[15],該方法的原理:對細菌細胞施加損傷后,將細胞裂解,提取細胞基因組DNA,此時DNA上會出現斷裂點。在控制合適的堿性和溫度條件下,dsDNA會從斷裂點位置解鏈,而完整的dsDNA不會解鏈。加入中和液后,再加入熒光染料,而染料只和未解鏈的dsDNA結合,不會和斷裂點解鏈的單鏈DNA結合。因此,檢測到的熒光信號越強,說明基因組DNA越完整;檢測到的熒光信號越弱,說明dsDNA上的斷裂點越多,損傷越嚴重。
把RA-GD、△recA和c△recA分別培養至OD600 nm為1.0,調整每個菌株的起始濃度均為105CFU·mL-1。將細菌懸液放入24孔細胞培養板中,每孔加入500 μL懸液(5×104CFU),用60 μW·cm-2的紫外劑量輻照菌株,輻照時間為45 min,提取細菌基因組DNA。取50 μL DNA溶液加入96孔細胞培養板中,然后加入55 μL 0.2 mol·L-1的NaOH溶液,30 ℃保持60 min,使dsDNA解鏈。然后加入70 μL中和液(14 mmol·L-1β-巰基乙醇,1 mol·L-1葡萄糖),同時將溫度降至22 ℃。最后加入78 μL SybrGreen溶液(1∶8333),混勻后立即以492 nm激發/520 nm發射波長測定熒光信號。
未經過紫外線處理的菌株作為陽性對照,處理時先把70 μL中和液加入細菌DNA溶液中,再加入55 μL 0.2 mol·L-1的NaOH溶液,以保證細菌dsDNA的完整性。不含有任何細菌DNA的樣本(50 μL DNA洗脫液)作為陰性對照。每個樣本的相對熒光信號依據以下公式計算:熒光信號(%)=(樣本-陰性對照)/(樣本-陽性對照)×100%。本研究中采用了依據檢測到的熒光信號的強弱從而判定基因組DNA完整性的FADU方法[15-17]。
另外,為了檢測RA-GD、△recA和c△recA在紫外線輻照下的存活能力,作者測定了經紫外線輻照不同時間后上述菌株的CFU。
1.2.6 統計分析 使用GraphPad Prism 6.0版Windows軟件進行統計分析。t檢驗用于確定組間差異的重要性。*.P<0.05表示差異顯著,而**.P< 0.01和***.P<0.001均表示差異極顯著。
2 結 果
2.1 ΔrecA基因缺失株的構建
經PCR擴增驗證,ΔrecA中recA基因無法擴增,ermF基因可以擴增出來,說明RA-GD中recA基因已被ermF基因置換(圖1);經對PCR產物測序驗證,與目標序列的相似性為100%,說明ΔrecA基因缺失株構建成功。
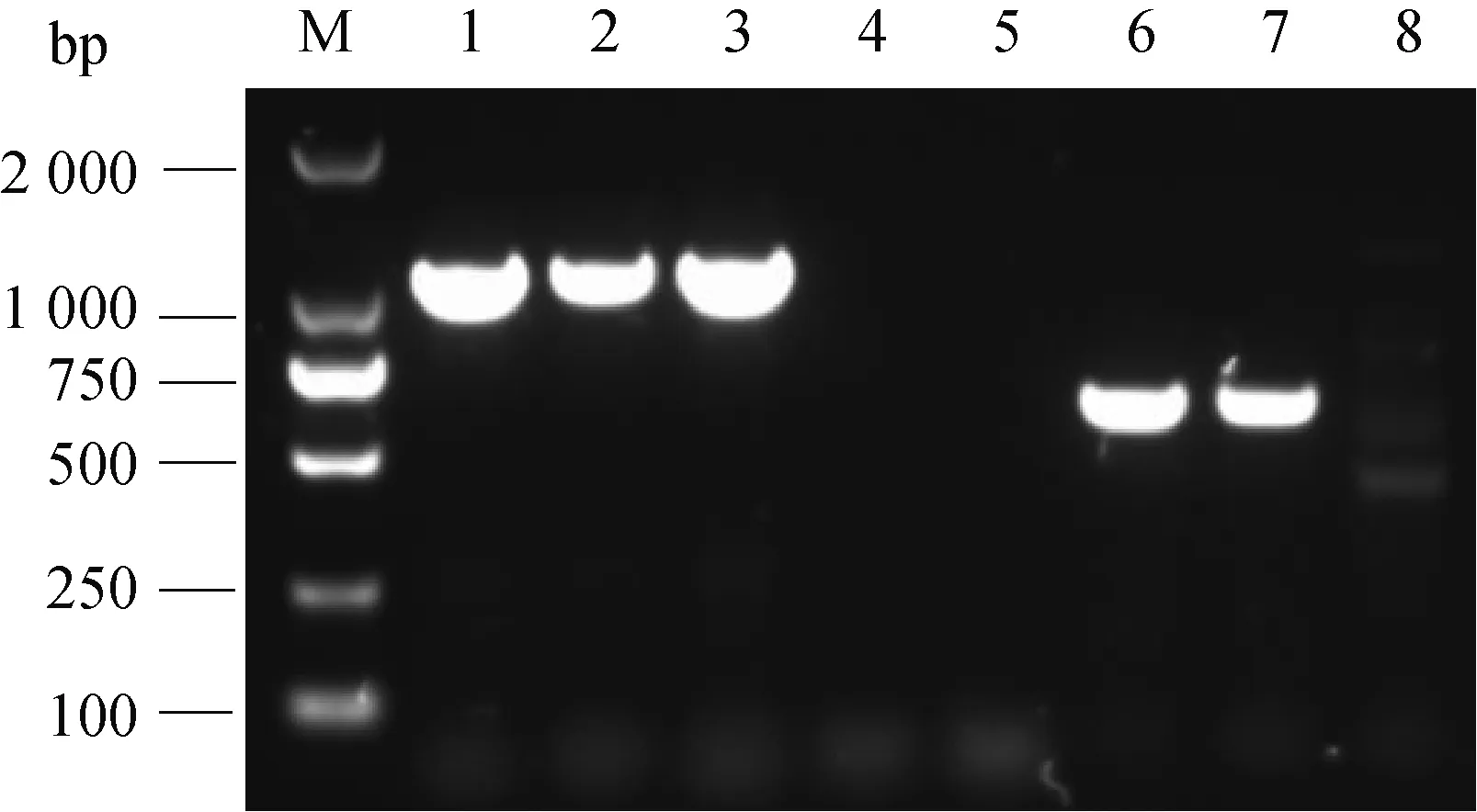
M.DL2000相對分子質量標準;1.ompA基因陽性對照;2、3.ompA基因擴增;4、5.recA基因擴增;6、7.ermF基因擴增;8.ermF基因陰性對照
2.2 cΔrecA基因回復株的構建
經PCR擴增驗證,ΔrecA菌株中轉入回復質粒pCPRA::RecA后,可以擴增到recA基因(圖2);對PCR產物測序驗證,與目標序列的相似性為100%,說明回復株cΔrecA構建成功。

M.DL2000相對分子質量標準;1.ompA基因陰性對照;2.ompA基因陽性對照;3.ompA基因擴增;4.recA基因陽性對照;5.recA基因擴增;6.recA基因陰性對照
2.3 生長曲線
根據12 h內的生長曲線,與親本株RA-GD相比,缺失株ΔrecA的生長速率沒有明顯差異(圖3),提示recA基因對于鴨疫里默氏桿菌的生長特性沒有明顯影響。
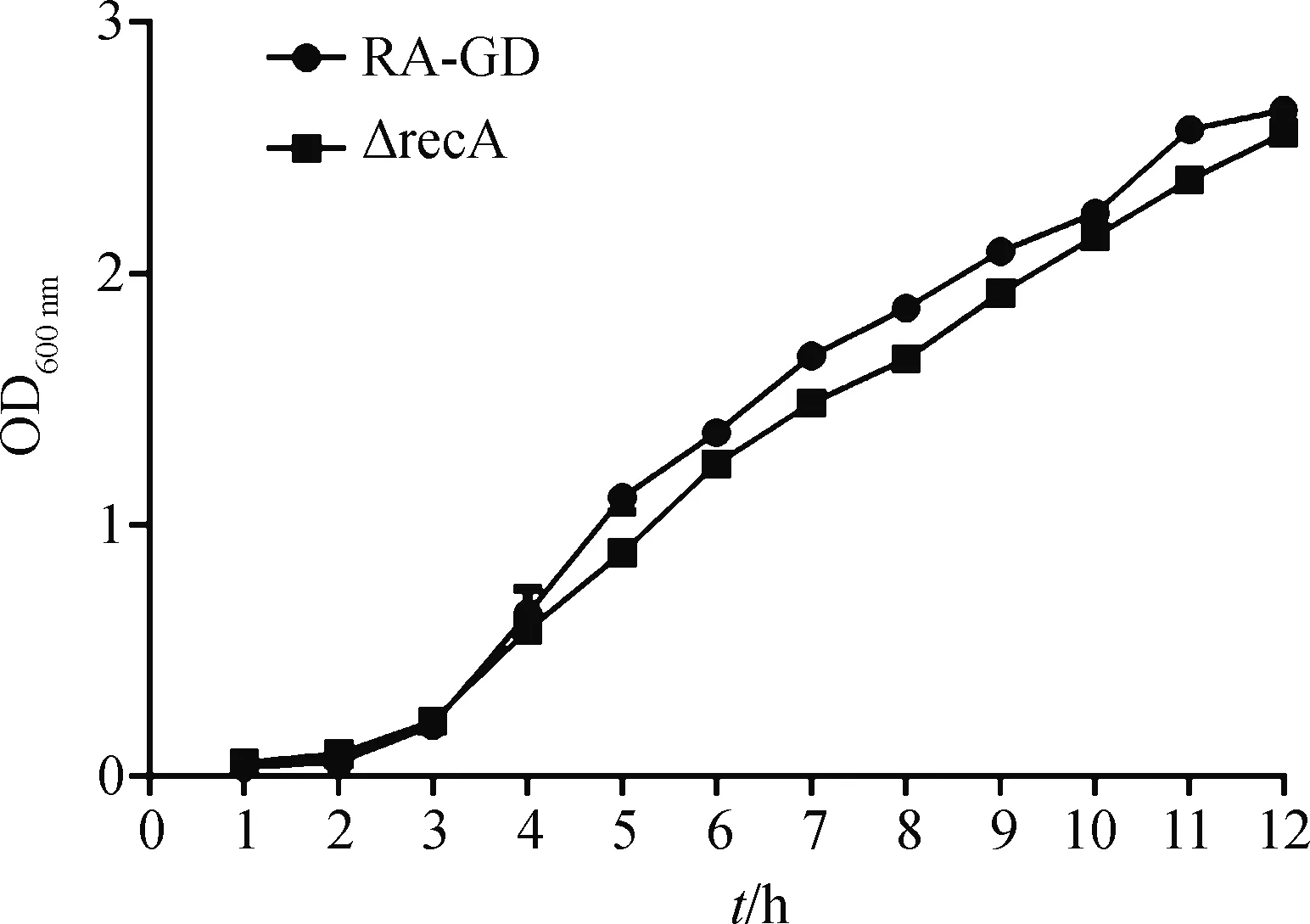
圖3 親本株RA-GD和缺失株△recA的生長曲線
2.4 recA基因的轉錄水平
在紫外線處理的條件下,RA-GD株的recA基因的轉錄水平在0~45 min內隨紫外線輻照時間的延長而顯著增加(圖4)。

圖4 紫外線輻照不同時間的RA-GD菌株recA基因的轉錄水平
2.5 DNA損傷試驗
在紫外線輻照的0~45 min內,親本株RA-GD和回復株cΔrecA dsDNA的熒光信號顯著強于缺失株cΔrecA(圖5),說明紫外線可以破壞鴨疫里默氏桿菌dsDNA的完整性,并且recA基因缺失導致dsDNA的完整性明顯下降,提示recA基因參與了dsDNA的損傷修復反應(SOS反應)。

圖5 紫外線處理不同時間條件下RA-GD、cΔrecA和ΔrecA的熒光信號
在0~45 min,RA-GD、cΔrecA和ΔrecA的CFU均隨著紫外線輻照時長增加而減小,表明紫外線對細菌的殺滅效果隨照射時間延長而加強。在相同輻照時長下,RA-GD和cΔrecA的CFU均明顯多于ΔrecA;與輻照時間0 min相比,輻照15、30和45 min時,RA-GD/ΔrecA和cΔrecA/ΔrecA的CFU的比值均顯著增大,說明recA基因滅活可使RA-GD對UV的抵抗力下降,生存能力降低(表3)。

表3 紫外線處理不同時間條件下RA-GD、cΔrecA和ΔrecA的CFUs
3 討 論
SOS反應會引發大量的細菌細胞反應,包括DNA修復、細菌細胞伸長、誘導易出錯的DNA聚合酶、誘導潛伏噬菌體和抑制細胞分裂等[18-19]。RecA和LexA蛋白在SOS反應中發揮關鍵調控作用。在正常生長過程中,LexA二聚體通過結合啟動子區域的特定操作序列,作為SOS調控基因的轉錄抑制因子[20-21]。RecA作為一種輔蛋白酶,刺激LexA和其他相關蛋白的自裂解。鴨疫里默氏桿菌RecA蛋白是1個37 ku的蛋白,與大腸桿菌的RecA蛋白具有60.5%的氨基酸序列相似性,但是該蛋白的功能目前還未見報道。
關于鴨疫里默氏桿菌RecA蛋白在其受到外界因素損傷時是否發揮調控SOS反應,目前還未見相關報道。鑒于此,本研究對此問題進行研究。首先構建鴨疫里默氏桿菌recA基因的缺失株和回復株。若recA基因滅活不明顯影響菌株的生長能力,可以更好地確定菌株其他性狀的改變與recA基因的功能相關。因此,對親本株和recA基因缺失株的生長能力進行檢測。依據菌株在12 h內的生長曲線,發現recA基因缺失沒有明顯影響菌株的生長能力,說明該基因與鴨疫里默氏桿菌的生長之間沒有明顯的相關性。此結果與一項關于脆弱擬桿菌的研究結論相符。該研究表明,與正常的野生株相比,脆弱擬桿菌recA突變株在正常條件下的生長時間沒有顯著延長[22]。
RecA蛋白是參與細菌SOS反應并發揮關鍵作用的重組酶。當細菌受到外界破壞因素刺激而損害到其基因組DNA時,細菌啟動SOS反應以應對生存危機,此時RecA蛋白發揮促進損傷DNA修復的功能,轉錄和表達水平可能上調。Niccum等[23]通過qRT-PCR法檢測了紫外線處理對大腸桿菌recA基因轉錄水平的影響,結果顯示recA基因的轉錄水平顯著上調,表明recARNA是SOS應答早期能檢測到的可靠指標。筆者也檢測了鴨疫里默氏桿菌在紫外線輻照下的recA基因的轉錄水平。結果顯示,經紫外線輻照的菌株其recA基因的轉錄水平顯著上調,推測菌株啟動了依賴于RecA蛋白的SOS反應。
檢測細菌的存活能力及其dsDNA的損傷程度是判定SOS反應的重要指標,需要穩定可靠的檢測方法。本試驗中,在紫外線損傷下鴨疫里默氏桿菌親本株RA-GD和回復株cΔrecA的熒光信號顯著高于缺失株ΔrecA,說明其dsDNA損傷程度明顯小于缺失株,并且其存活能力顯著高于缺失株。這些數據說明recA基因的缺失阻礙了DNA的損傷修復反應(SOS應答),提示鴨疫里默氏桿菌RecA蛋白在DNA損傷修復反應中發揮正調控作用。
4 結 論
鴨疫里默氏桿菌RecA蛋白與其生長能力無明顯相關性,參與紫外線損傷后細菌的存活及其基因組dsDNA的修復,調控鴨疫里默氏桿菌的SOS反應。

