成年牦牛皮膚中血管與神經的組織學觀察及HIF-1α在皮膚中的表達
任鈺昕,崔 燕,2*,鄒勝南,白雪峰,余四九,2,何俊峰,廖 博
(1.甘肅農業大學動物醫學院,蘭州 730070;2.甘肅省牛羊胚胎工程技術研究中心,蘭州 730070)
牦牛是我國高原牧區主要家畜之一,大都繁衍生息在我國青藏高原及周圍3 000 m以上的高寒地區,對其生態環境條件具有極強的適應性。皮膚是畜體最大的器官,作為直接接觸外界環境的器官,具有分泌、體溫調節、保護機體免受外界損傷等作用[1-3]。皮膚由表皮和真皮組成,借皮下組織與深部組織相連。表皮位于皮膚最表層,主要由大部分的角質形成細胞和少量的諸如黑素細胞、朗格漢斯細胞、梅克爾細胞等組成。真皮層內埋置著毛囊、汗腺、皮脂腺、血管、淋巴管、神經等[4]。崔燕等[5]已經對成年牦牛汗腺和皮脂腺的組織學進行了研究。而真皮層及皮下組織有豐富的神經末梢和血管網,血管的擴張和收縮有助于動物的體溫調節,神經則調控著體溫通路。低氧誘導因子-1α(hypoxia-inducible factor 1-alpha,HIF-1α)是低氧誘導因子-1(hypoxia-inducible factor-1,HIF-1)特有的一種亞基結構,是一種調節亞基,同時也是一種活性亞基[6],其蛋白穩定性和轉錄活性均受細胞內氧濃度的調節。在低氧條件下,HIF-1α蛋白水平增加、入核、二聚化,結合于低氧反應基因的HIF-1α結合位點上,促進轉錄,介導低氧反應,并在多種組織細胞中廣泛表達。HIF-1α介導缺氧信號與眾多缺氧誘導基因(如血管內皮生長因子VEGF、轉化生長因子TGF-β1等)轉錄激活,作為反式作用因子可與細胞核染色體上的順式作用元件(缺氧反應元件)相互作用,進而調控下游基因的轉錄和翻譯,對低氧或創傷環境中細胞和機體氧穩態的調節具有重要作用[7]。目前,有關HIF-1α在成年牦牛皮膚中的定位和表達研究尚未見報道。因此,本試驗采用HE、Masson’s三色和Verhoeff VG染色法對成年牦牛皮膚內的血管和神經進行組織學觀察,用免疫組織化學、qRT-PCR法、Western blot法對HIF-1α的mRNA和蛋白進行不同部位皮膚組織上的定位與定量分析,為哺乳動物皮膚的研究提供組織學的相關資料,也進一步探究了牦牛在高寒低氧環境下適應性生理條件。
1 材料與方法
1.1 試驗樣品與材料
1.1.1 試驗動物和取材 自青海省西寧市采集成年(3~5歲)健康牦牛皮膚樣品,各10頭份,雌雄各半,經頸動脈放血處死后立即采集頸部、前臂部、小腿部、跖部皮膚,將皮膚組織體積的1/2迅速放入液氮,用于提取組織中的RNA和蛋白質;剩余1/2置于4%多聚甲醛溶液,用于制備石蠟切片。
1.1.2 主要儀器和試劑 全自動排氣組織脫水機(TP1020,Leica德國),全自動包埋儀(EG1160,Leica德國),精密輪轉式切片機(RM2235,Leica德國),SP試劑盒(SP-0023,北京博奧森生物技術有限公司),二氨基聯苯胺(diamino-benzidine,DAB)顯色試劑(ZLI-9019,北京中杉金橋生物技術有限公司);PCR儀(eppendorf,艾本德公司,德國),熒光定量PCR儀(LightCycler?96SW1.1,Roche公司,瑞士),Tranzol試劑、EasyPure Plasmid MiniPrep Kit均購自北京全式金生物技術有限公司,TaqPCR Master Mix、GoScriptTMReverse Transcription System、Wizard?SVdGel和PCR Clean-Up System均購自Promega公司(美國);鼠抗HIF-1α和β-actin單克隆抗體分別購自Abcam公司和全式金生物技術有限公司。
1.2 試驗方法
1.2.1 組織學觀察 皮膚樣品固定1個月后,分別選取4個不同部位牦牛皮膚各10個組織塊(組織塊大小為0.5 cm×0.5 cm×0.5 cm),流水沖洗24 h以沖洗多聚甲醛,放入軟化液中48 h。按常規組織學方法制作石蠟切片(厚5 μm,橫切)(橫切是平行于皮膚的方向),分別進行蘇木精-伊紅(hematoxylin-eosin staining,HE)染色、Masson’s三色和Verhoeff VG染色。用Olympus-73光學顯微系統觀察,拍攝組織學圖片。
1.2.2 免疫組織化學檢測 制成5 μm(橫切)的石蠟切片脫蠟至水,用0.01 mol·L-1的檸檬酸鹽緩沖液進行抗原修復,染色方法參照SP試劑盒(SP-0023,Bioss)。一抗HIF-1α(Abcam)以1∶500稀釋,4 ℃孵育過夜。空白對照用0.02 mol·L-1的PBS代替一抗,DAB顯色劑按1∶20稀釋后進行顯色,最后進行蘇木精復染細胞核、脫水、透明及封片。用Olympus-73光學顯微鏡觀察、拍攝組織學圖片。
1.2.3 qRT-PCR 用Primer Premier 5.0軟件設計出HIF-1α引物序列,β-actin作為內參引物,由上海生工合成。引物序列為HIF-1α-R: 5′-TATCCAAATCACCAGCATCCAG-3′, HIF-1α-F: 5′-TAGAGATGCAGCCAGATCTCGT-3′;β-actin-F: 5′-CGTCCGTGACATCAAGGAGAAGC-3′, β-actin-R: 5′-GGAACCGCTCATTGCCGATGG-3′。采用Trizol法提取4個不同部位的皮膚組織的總RNA,按照GoScriptTMReverse Transcription System反轉錄試劑盒(Promega,美國)說明書合成cDNA。PCR總反應體系20 μL:SYBR Green Mix 10 μL,無菌去離子水6.4 μL,cDNA(500 ng·μL-1)2 μL,上、下游引物各0.8 μL。反應條件:95 ℃預變性30 s;95 ℃變性5 s、60 ℃退火30 s、72 ℃延伸10 s,循環40次,每組重復4次(n=4)。根據實時熒光定量熔解曲線判斷引物特異性,根據每個樣品的Cq值,用2-ΔΔCt計算HIF-1α mRNA在牦牛不同部位皮膚中相對表達量。
1.2.4 Western blot 將成年牦牛4個部位的組織樣研磨各稱取100 mg,加入蛋白裂解液(RIPA∶RMSF=100∶1),離心取上清液,與4×蛋白上樣緩沖液按3∶1混合,在100 ℃的恒溫金屬浴中加熱10 min進行蛋白變性。配制8%的分離膠和5%的濃縮膠,進行SDS-PAGE凝膠電泳,轉至PVDF膜上,5%脫脂奶粉室溫封閉6 h,一抗HIF-1α(1∶500)4 ℃孵育過夜,PBST(磷酸鹽緩沖液+tween 20)洗1 h,鼠二抗(1∶2 000)室溫孵育1 h,PBST洗90 min。以β-actin作為內參,滴加電化學發光液(electro-chemi-luminescence,ECL)顯影,用Image J軟件對條帶進行分析。
1.2.5 計數和統計學分析 從每個組織塊橫切切片中切取連續切片,隔3取1,取30張切片,在100倍鏡視野下(面積為0.25 cm2)計數動脈、靜脈、毛細血管、神經,換算為每平方厘米的數量,用均值±標準誤差表示(x±sx,n=30),即血管與神經的密度。用SPSS19.0軟件對所有數據進行統計學處理。采用單因素方差法分析以P>0.05表示差異不顯著,P<0.05表示差異顯著。
2 結 果
2.1 成年牦牛皮膚內不同血管和神經的密度及分析
通過HE切片觀察發現(圖1),牦牛頸部、前臂部、小腿部、跖部皮膚內血管和神經分布相似。表皮層內無血管,真皮層內觀察有豐富的血管和神經,且神經常與血管伴行,動脈和靜脈多為中動脈和中靜脈。動脈也常與靜脈伴行,如圖1a所示的動靜脈吻合支,形成血液間的小循環,調節局部皮膚的血流量和體溫。汗腺周圍也常分布有血管和神經,如圖1b所示,應與汗腺的代謝與調節作用有關,汗腺分泌汗液,進行體內物質的代謝,從而調節血管的收縮,而血液輸送代謝物質,實現體內外的物質交換過程;神經則調節著汗腺和血管規律的進行代謝活動。真皮層排列著豐富的膠原纖維束,大而粗。夾雜少量肌纖維,支持著皮膚的活動。統計不同部位動脈密度,結果表明:頸部動脈密度最高,前臂部和小腿部次之,跖部密度最低,部位間差異顯著(P<0.05)(表1);靜脈、毛細血管、神經不同部位的密度計數結果類似于動脈,頸部最高,跖部最低(表1)。由此可以推測出牦牛軀干部血管和神經密度最高,前肢明顯高于后肢,后上肢明顯高于后下肢。

a.頸部;b.前臂部;c.小腿部;d.跖部;ERS.毛囊的上皮根鞘;SW.汗腺;NE.神經;A.動脈;V.靜脈;C.毛細血管;CF.膠原纖維
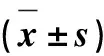
表1 成年牦牛不同部位皮膚中動脈、靜脈、毛細血管和神經的密度
2.2 Masson’s三色和Verhoeff VG染色
Masson’s三色染色結果顯示牦牛頸部、前臂部、小腿部、跖部皮膚結構基本一致:真皮和皮下組織大部分平行排列著膠原纖維(藍色),長短不一,夾雜少量彈性纖維(藍粉色),比膠原纖維細短;血管常與神經伴行(紅色)(圖2a)。Verhoeff VG染色結果顯示頸部、前臂部、小腿部、跖部皮膚結構基本一致:真皮和皮下組織大部分都是膠原纖維(紅色);動脈內彈性膜呈鋸齒狀(黑色),中膜由數十層環形平滑肌組成(黃色),外膜界限明顯,呈螺旋狀(黑色);靜脈管壁薄,內彈性膜不明顯,中膜由較少的幾層平滑肌構成;神經分布在血管周圍(黃色)(圖2b)。

a.Masson’s 三色染色;b.Verhoeff VG染色;NE.神經;A.動脈;V.靜脈;C.毛細血管;CF.膠原纖維;EF.彈性纖維;IEM.內彈性膜;TM.中膜;TA.外膜
2.3 成年牦牛不同部位皮膚中HIF-1α的分布情況
免疫組織化學結果顯示:HIF-1α陽性表達在細胞質,主要分布在表皮層、初級毛囊和次級毛囊的上皮根鞘(內根鞘和外根鞘)、汗腺分泌部和導管部、皮脂腺、神經、血管、豎毛肌;其中表皮、初級毛囊的外根鞘、汗腺的上皮細胞、皮脂腺細胞、血管的內彈性膜、豎毛肌纖維細胞呈強陽性表達,初級毛囊的毛囊內根鞘、次級毛囊的內外根鞘、血管的中膜、神經的外膜和纖維為陽性表達。頸部表達量最高,跖部表達量最低(圖3)。

a.頸部(a1、a2.陽性表達;a3、a4.空白對照);b.前臂部(b1、b2.陽性表達;b3、b4.空白對照);c.小腿部(c1、c2.陽性表達;c3、c4.空白對照);d.跖部(d1、d2.陽性表達;d3、d4.空白對照);E.表皮;ERS.毛囊的上皮根鞘;SW.汗腺;SG.皮脂腺;A.動脈;V.靜脈;C.毛細血管;NE.神經
2.4 成年牦牛不同部位皮膚中HIF-1α mRNA的表達
HIF-1α在成年牦牛不同部位的皮膚中均有表達。小腿部表達量最高,跖部最低。跖部表達量差異顯著低于其他部位(P<0.05),頸部、前臂部、小腿部兩兩比較,差異不顯著(P>0.05)(圖4)。

不同字母表示差異顯著(P<0.05),相同字母表示差異不顯著(P>0.05)。圖5同
2.5 成年牦牛不同部位皮膚中HIF-1α蛋白的相對表達量
Western blot結果顯示,HIF-1α在成年牦牛不同部位皮膚均有表達。頸部表達量最高,跖部表達量最低(圖5A)。頸部差異顯著高于其他3個部位(P<0.05),前臂部差異顯著高于其他3個部位(P<0.05),小腿部和跖部差異不顯著(P>0.05)(圖5B)。

圖5 成年牦牛不同部位皮膚HIF-1α蛋白的相對表達量
3 討 論
牦牛是高原環境下的主要畜種,更是世界上唯一能在高寒、低氧和牧草營養短缺等極端環境中生存的大型哺乳動物。皮膚作為與環境直接接觸,抵御微生物入侵、物理攻擊和化學攻擊的第一道防線,與牦牛高原低氧適應性機制緊密相關。在適應高原高寒、低氧、強紫外線環境的過程中,皮膚結構隨著生活環境的變化也發生了適應性變化[8]。首先牦牛的體型較其他牛種較小,四肢較短,體表褶皺較少,這樣明顯減少了單位面積的散熱量。其次牦牛表皮中的黑素細胞在皮膚維持穩態的機制中發揮作用。牦牛在高原地區常年受到紫外線的照射,皮膚中大量的色素細胞交叉形成一定厚度的色素層,吸收部分紫外線的輻射,達到減輕紫外輻射對皮膚及機體內部器官損傷的作用。因為頸部皮膚直接暴露在光線照射下,所以它的代償性作用遠強于沒有直接暴露在光線下的跖部、前臂部和小腿部受光線照射程度接近。而牦牛皮膚中的血管發生了一定的適應性變化是低氧適應機制的關鍵。低氧環境下血管內皮細胞增生,管壁增厚,管腔變窄[9],因此血流量減少,從而減少體溫的散失,減慢了皮膚與外界能量的交換。青海牦牛皮膚血管分布稀少[10],同樣使血液的對流散熱減少,從而增強了皮膚的絕熱性能。已經有研究表明,人體皮膚血液由身體上部至下部有逐漸降低的趨勢[11],與本試驗結果一致,證明牦牛皮膚內血液也有從上到下逐漸降低的趨勢。根據于川等[12]對牦牛皮膚厚度的統計學研究,頸部真皮厚度明顯高于其他3個部位,而血管分布在皮膚的真皮層,所以推測頸部皮膚有更好的低氧適應性機制。神經可以調控血管的收縮與舒張,根據本試驗對皮膚內不同部位的神經密度的統計,證明成年牦牛皮膚內神經有“從軀干部到四肢,從前肢到后肢遞減”的趨勢。
HIF-1α對皮膚穩態至關重要,主要表達在表皮的基底層[13-14]。HIF-1α已經被證明可以調節皮膚細胞的黏附和遷移,如人成纖維細胞[15]和角質細胞[16]。HIF-1α調節的通路顯著參與了組織穩態和新生血管的形成,產生新的膠原、彈性蛋白、糖胺聚糖和滋養血管[17]。HIF-1α的調節已被證明是皮膚內穩態的關鍵,在傷口愈合中起重要作用,這表明HIF-1α參與真皮組織修復[18-19]。HIF-1α途徑下游100多個基因的進一步激活對控制血管生成、細胞增殖、遷移和葡萄糖代謝至關重要[20-21]。皮膚作為感受氧含量變化的第一道屏障,通過調節皮膚HIF-1α含量及皮膚血流量而影響EPO的表達水平,就可以將缺氧代償反應擴展到全身,因此皮膚是介導全身性低氧反應的一個敏感調控器[22]。單波長紅外線/紅光治療能提高皮膚組織HIF-1α、VEGF表達水平,HIF-1α及VEGF表達水平下降導致皮膚真皮層新生血管缺乏[23]。結合本試驗結果,牦牛長期受強光照射,因此皮膚中HIF-1α和VEGF表達水平升高,從而促進了真皮層新生血管的生成。也有研究證明,在皮膚基底細胞癌(BBC)與皮膚鱗狀細胞癌(cSCC)中,HIF-1α和VEGF高表達,且呈正相關[24]。羅鴻[25]得出結論,低氧條件下HIF-1α具有時間依賴性,當缺氧48 h時,HIF-1α的mRNA和蛋白表達水平達到最高;且具有氧濃度遞減依賴性,當氧濃度下降到1%時,HIF-1α的mRNA和蛋白表達水平達到最高。
本研究結果表明HIF-1α在成年牦牛皮膚的不同部位均有表達,但mRNA與蛋白表達趨勢并不完全一致。究其原因,可以用其降解特征解釋:基因可以編碼蛋白質,但不是所有基因都會表達,基因從表達到產生蛋白質要經過轉錄和翻譯過程。mRNA的修飾、運輸、降解和一些small RNA,如miRNA的調節,均可改變蛋白質的表達水平。HIF-1α在翻譯后,可通過泛素化、乙酰化、磺酰化和磷酸化等方式調節其穩定性和轉錄活性。拜占春等[26]證明了HIF-1α的mRNA和蛋白在成年牦牛腦組織的不同部位的表達具有差異性,李慧[27]也證明HIF-1α在牦牛不同組織中mRNA和蛋白表達趨勢不盡一致。
4 結 論
成年牦牛皮膚中血管和神經結構與分布不同部位間相似,密度具有部位間差異;HIF-1α在皮膚中均有表達,頸部最高,跖部最低。推測HIF-1α在成年牦牛皮膚低氧適應性機制中發揮了作用。

