不同類型腸內營養對感染性休克患者瘦素、血清趨化素等指標及預后的影響
陳 歡,周 偉,許 鎖,朱小浩,李守林,駱繼業△
連云港市第一人民醫院:1.急診內科;2.急診ICU,江蘇連云港 222002
感染性休克是指因病毒或細菌等感染造成的機體系統性的炎性反應,具體為患者感染灶中的微生物及毒素等進入血液循環,從而激活機體內多種體液及細胞系統,并分泌內源性介質及細胞因子,最終影響機體多個系統或器官,嚴重者甚至出現功能障礙[1]。同時相關臨床資料表明,此類患者的發病率較高,若不及時診治,可誘發膿毒癥或敗血癥,從而增加患者的病死率,嚴重威脅患者生命健康[2]。而目前臨床上對于感染性休克患者主要還是以抗休克、抗感染等多種對癥治療方式為主[3]。隨著醫學的不斷發展,人們發現對于燒傷、創傷的患者來說,應用免疫增強型腸內營養可顯著改善其治療效果,同時部分學者證實將免疫增強型腸內營養應用于感染休克患者亦可顯著提高其免疫功能[4]。因此本研究探討不同類型的腸內營養是否影響感染性休克患者瘦素、血清趨化素等指標及預后,旨在為進一步優化此類患者治療手段提供理論依據。
1 資料與方法
1.1一般資料 選取2016年1月至2019年5月連云港市第一人民醫院收治的78例感染性休克患者作為研究對象,根據研究對象腸內營養治療方式的不同,分為免疫增強型腸內營養治療39例患者(研究組)、常規腸內營養混懸液治療39例患者(對照組)。研究組中男22例、女17例;年齡42~75歲,平均(58.5±6.2)歲;體質量指數(BMI)為20.5~31.2 kg/m2,平均BMI為(23.8±4.2)kg/m2;對照組中男25例、女14例;年齡46~73歲,平均(58.1±5.9)歲;BMI為19.8~30.8 kg/m2,平均BMI為(23.5±5.6)kg/m2。兩組一般資料比較,差異均無統計學意義(P>0.05),具有可比性。本研究經本院倫理委員會批準,患者均知情同意。
1.2納入及排除標準 納入標準:(1)患者均符合文獻[5]提出的感染性休克診斷標準,臨床上有明顯感染病灶,體溫持續高于38.5 ℃或低于35.5 ℃,收縮壓低于 90 mm Hg;(2)全部患者入院后經過病史詢問、臨床表現和對應檢查確診為感染性休克;(3)全部患者均存在進食障礙且1周內無法恢復;(4)所有患者及家屬簽署治療知情同意書。排除標準:(1)合并嚴重的免疫功能障礙;(2)合并胃腸功能紊亂及重要臟器衰竭等。
1.3儀器與試劑 邁瑞BS-280型全自動生化分析儀,購自深圳邁瑞生物醫療電子股份有限公司;酶聯免疫吸附試驗法檢測試劑盒購自上海酶聯生物科技有限公司;邁瑞MR-96A酶標儀購自深圳邁瑞生物醫療電子股份有限公司。
1.4方法
1.4.1治療方法 兩組患者均給予常規抗休克、抗感染等治療,同時留置鼻胃管,且給予腸內營養時患者取頭高臥位30°~45°,并用營養泵經鼻胃管常速泵入。其中對照組入院當日給予600 mL腸內營養混懸液,同時劑量每日增加200 mL,直至1 200 mL/d。研究組入院當日給予免疫增強型腸內營養制劑(富含ω-3 多不飽和脂肪酸、谷氨酰胺及精氨酸等)600 mL,同時劑量每日增加200 mL,直至1 200 mL/d。以上兩組患者若缺乏足夠多的熱量時,部分可通過靜脈輸入營養液進行補充,且預計的營養需求1周內即可以達標。
1.4.2評估指標 (1)比較兩組患者治療前后相關免疫指標水平[免疫球蛋白A(IgA)、免疫球蛋白G(IgG)及免疫球蛋白M(IgM)]差異情況;(2)比較兩組患者治療前后炎性因子指標,如白細胞介素(IL)-6、C反應蛋白(CRP)和IL-8水平的差異情況;(3)比較兩組患者治療前后脂肪因子指標(血清趨化素及瘦素)水平的變化情況;(4)對比兩組患者治療前后腸功能屏障指標(內毒素、D-乳酸及二胺氧化酶)水平變化;(5)對比治療后兩組患者急性生理學與慢性健康狀況評分Ⅱ(APACHE-Ⅱ)評分及入住ICU時間的改變情況。
1.4.3實驗方法 治療前后抽取兩組患者的5 mL空腹靜脈血,其中免疫指標應用全自動生化分析儀檢測;炎性因子及脂肪因子指標利用酶聯免疫吸附試驗法測定,均嚴格按照試劑盒說明書步驟進行操作,酶標儀檢測450 nm處的吸光度值,根據標準曲線計算濃度。依據APACHE-Ⅱ評分方法[6]對12項急性生理學變量、慢性健康狀況及年齡因素分值進行評分,將各部分評分相加為總分值,滿分71分,得分越高,說明疾病情況越嚴重。
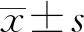
2 結 果
2.1兩組治療前后免疫指標水平對比 兩組患者治療后IgA、IgG、IgM水平均高于同組治療前,差異均有統計學意義(P<0.05);研究組治療后IgA、IgG、IgM水平與對照組治療后比較,差異均有統計學意義(P<0.05)。見表1。

表1 兩組治療前后免疫指標水平對比
2.2兩組治療前后炎性因子水平對比 兩組患者治療后CRP、IL-6、IL-8水平均低于同組治療前,研究組治療后CRP、IL-6、IL-8水平與對照組治療后比較,差異均有統計學意義(P<0.05)。見表2。

表2 兩組治療前后炎性因子水平對比
2.3兩組治療前后脂肪因子水平對比 兩組患者治療后血清趨化素、瘦素水平均較治療前下降,研究組治療后血清趨化素、瘦素水平與對照組治療后比較,差異均有統計學意義(P<0.05)。見表3。

表3 兩組治療前后脂肪因子水平對比
2.4兩組治療前后腸功能屏障指標水平對比 兩組患者治療后內毒素、D-乳酸、二胺氧化酶水平較治療前下降,研究組治療后內毒素、D-乳酸、二胺氧化酶水平與對照組治療后比較,差異均有統計學意義(P<0.05)。見表4。

表4 兩組治療前后腸功能屏障指標水平對比
2.5兩組治療后臨床指標對比 研究組患者治療后APACHE-Ⅱ評分及入住ICU的時間均較對照組治療后減少,差異均有統計學意義(P<0.05)。見表5。
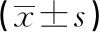
表5 兩組治療后臨床指標對比
3 討 論
感染性休克是感染性疾病較為常見且嚴重的并發癥之一,此類患者機體炎性因子顯著升高,并可影響體內多個系統或器官功能,嚴重者可致死亡,具有發病迅速、病死率高等特征,是全球重癥患者常見的致死因素之一[7-8]。大量的流行病學數據分析發現,感染性休克的病死率逐年上升,極大地增加了重癥醫學醫務人員的工作壓力,同時亦極大地影響了感染性休克患者生命健康[9]。而目前針對感染性休克除常規的抗休克、抗感染等治療外,人們逐漸發現營養不良可導致此類患者免疫功能受損,而普通的腸內營養制劑并不能有效地糾正應激狀態下機體的炎性反應,進而影響常規治療的療效[9-10]。因此尋找有效的腸內營養制劑來提高感染性休克患者的免疫功能,可能會對改善此類患者的預后有一定的幫助[11]。
本研究結果顯示,兩組患者治療后IgA、IgG、IgM水平均高于同組治療前,差異均有統計學意義(P<0.05);研究組治療后IgA、IgG、IgM水平與對照組治療后比較,差異均有統計學意義(P<0.05)。分析原因可能與應用免疫增強型腸內營養有關,由于免疫增強型腸內營養制劑在原有標準營養配方的基礎上增加了ω-3不飽和脂肪酸、谷氨酰胺及精氨酸等多種營養物質,從而增強了機體的免疫功能[12-13]。另外,兩組患者治療后炎性因子水平均低于同組治療前,表明應用免疫增強型腸內營養不僅能有效調節患者機體的免疫功能,同時還可減輕機體炎癥水平[14]。
研究發現脂肪因子(血清趨化素及瘦素)可參與銀屑病、炎癥性腸病等多種炎癥性疾病的發生、發展過程,同時還可作為感染性休克患者預后評估的指標來應用[15]。本研究結果顯示,兩組患者治療后血清趨化素及瘦素水平均較治療前下降,研究組治療后血清趨化素及瘦素水平與對照組治療后比較,差異均有統計學意義(P<0.05),這從血清學角度進一步證實應用免疫增強型腸內營養可顯著改善感染性休克患者的預后情況。D-乳酸作為細菌代謝產物,人類本身無法分泌D-乳酸,當其腸屏障功能受損后,D-乳酸進入血液中從而反映腸黏膜損傷情況;二胺氧化酶作為腸黏膜上皮細胞內酶,亦能夠在腸黏膜細胞受損后進入血液中,能夠反映腸黏膜損傷情況;而內毒素作為革蘭陰性細菌的重要成分,正常的腸黏膜屏障功能可以阻擋內毒素進入血液,當腸屏障功能損傷,內毒素則通過腸黏膜進入循環系統,從而被檢測出[16-17]。因此,血清D-乳酸、內毒素及二胺氧化酶水平能夠一定程度上反映感染性休克患者預后。本研究發現兩組患者治療后內毒素、D-乳酸、二胺氧化酶水平較治療前下降,差異均有統計學意義(P<0.05);研究組患者治療后APACHE-Ⅱ評分及入住ICU的時間均較對照組治療后減少,差異均有統計學意義(P<0.05),進一步體現出免疫增強型腸內營養治療感染性休克的臨床價值[18]。
綜上所述,免疫增強型腸內營養治療感染性休克患者的療效較為顯著,不僅可顯著提高患者的免疫功能,同時還可減輕其炎性反應程度,并能很好地改善其預后,值得臨床推廣應用。

