血漿miR-130a-3p在高原低氧環境中表達的研究*
閆 巖,袁云龍
南京醫科大學附屬蘇州醫院/蘇州市立醫院醫學檢驗科,江蘇蘇州 215000
微小核糖核酸(miRNA)是一類長度約22個核苷酸的小的非編碼RNA,它們能夠通過在轉錄后水平降低或阻斷信使RNA的翻譯來調節基因的表達,從而參與多種生理、病理過程[1]。miRNA穩定存在于多種體液中,并且可作為許多疾病的潛在生物標志物[2-3]。缺氧或低氧張力,是一種獨特的環境壓力,能夠引起轉錄因子和信號蛋白的廣泛變化以協調細胞在代謝、增殖、DNA修復和凋亡中的適應。機體調控細胞適應缺氧的過程是復雜且不完全相同的。一些證據表明,miRNA通過轉錄后機制調節基因的表達在應對缺氧反應中起關鍵作用,此外缺氧在對miRNA的生成、活性等方面也有重要的調節作用[4-5]。多項研究表明在缺氧條件下或與缺氧相關的疾病中miR-130a-3p在細胞或組織內的表達水平發生變化[6-7]。但是高原低氧環境能否影響循環miR-130a-3p表達的報道較為少見。本研究采用實時熒光定量 PCR(qRT-PCR)法,對移居到我國高原地區的健康漢族人和長期居住在平原地區的健康漢族人群血漿中miR-130a-3p水平進行比較分析。
1 資料與方法
1.1一般資料 收集包括從江蘇省、安徽省、上海市移居到海拔3 560 m的高原地區1~2年(平均17個月)的健康漢族人(高原漢組)的血漿,高原漢組中男性55例,女性25例,平均年齡為(36.13±11.70)歲;同時期收集與移居到高原地區個體年齡、性別相匹配的150例長期居住在海拔高度8.9 m的平原地區健康漢族個體(平原漢組)的血漿作為對照。平原漢組中男性88例,女性62例,平均年齡為(34.87±9.40)歲,所有入選對象均經病史詢問,排除血液系統疾病、全身免疫性疾病、急慢性感染性疾病、高血壓、心臟病、腫瘤等干擾性疾病。
1.2儀器與試劑 2720型PCR儀(美國Applied Biosystem公司),7300型實時熒光定量PCR儀(美國Applied Biosystem公司),5418型高速冷凍離心機(德國Eppendorf 公司),XE-2100全自動血液分析儀(日本Sysmex 公司);Trizol試劑(美國Invitrogen公司),異丙醇、氯仿、無水乙醇(國藥集團試劑公司),人工合成peu-MIR2911、miR-130a-3p的引物和探針(美國Applied Biosystem公司);逆轉錄反應體系及qRT-PCR反應體系所用試劑(日本TaKaRa公司) 。
1.3方法
1.3.1標本采集 所有受試者均空腹8~10 h,清晨采集2 mL靜脈血于乙二胺四乙酸二鉀抗凝真空采血管中,15 min內上機進行血常規檢測。剩余血液迅速用室溫離心機1 500×g離心10 min。收集分離出的血漿于Eppendorf(EP)管中,置于-80 ℃保存。
1.3.2血漿RNA提取 采用苯酚氯仿抽提法進行,將上述收集的血漿樣本室溫融化混勻后,各取100 μL血漿樣本于新的除酶的EP管中,再加300 μL DEPC水稀釋混勻血漿標本;每管中各加入200 μL水飽和酚,充分渦旋混勻,然后每管加入20 μL人工合成的外源性植物miRNA MIR2911(MIR2911序列:5′-GGC CGG GGG ACG GGC UGG GA-3′) 以控制樣本提取純化過程中的差異,渦旋混勻,室溫靜置5 min;每管中各加入200 μL氯仿,充分渦旋混勻,室溫靜置5 min;室溫,16 000×g,離心20 min;取離心后的上清液于新的除酶EP管中;每管加入1/10倍上清液體積的乙酸鈉(濃度=3 mol/L,pH=5.3)和2倍上清液體積的異丙醇。渦旋顛倒混勻數次,置于-20 ℃沉淀60 min;沉淀結束后,4 ℃,16 000×g,離心20 min;離心后去除上清液,保留沉淀,每管加1 mL 75% DEPC水乙醇洗滌沉淀;4 ℃,16 000×g,離心20 min。離心后棄去上清液,保留沉淀,將EP管倒置,室溫干燥沉淀;沉淀晾干后,每管加入20 μL DEPC水溶解沉淀,將溶解好的RNA置于-80 ℃冰箱備用。
1.3.3qRT-PCR檢測 采用基于TaqMan 探針的qRT-PCR方法檢測所有受試者血漿標本中miR-130a-3p表達水平。逆轉錄反應體系(10 μL體系):DEPC水3.5 μL,5×反轉錄緩沖液2.0 μL,10 mmol/L dNTP 1.0 μL,AMV反轉錄酶0.5 μL,miR-130a-3p反轉錄引物1.0 μL,RNA 標本2.0 μL。反應條件:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min,4 ℃保存,1個循環;qRT-PCR 總反應體系(20 μL體系),ddH2O 14.77 μL、10×PCR buffer 2 μL、10 mmol/L dNTP 0.4 μL、25 mmol/L MgCl21.2 μL、Taq 酶0.3 μL,探針及上、下游引物 0.33 μL,cDNA 1 μL。以DEPC水作為陰性對照,每個樣本均設3個復孔,陰性對照的cDNA與待測樣本的cDNA同時進行擴增,95 ℃ 5 min;95 ℃ 15 s,60 ℃ 1 min,共40個循環。血漿中miRNA表達水平采用相對定量的方法進行計算。用樣本中待測miRNA的Cq值減去相應樣本中參考基因Cq值得到ΔCq值,即ΔCq=Cq(miR-130a-3p)-Cq(MIR2911)。待測miRNA相對于參考基因的表達水平用2-ΔCq表示。
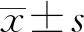
2 結 果
2.1兩組臨床基本信息 兩組人群的年齡、性別比較差異無統計學意義(P>0.05)。與平原漢組比較,高原漢組血液中紅細胞計數(RBC)、血紅蛋白(Hb)、血細胞比容(Hct)、平均血紅蛋白含量(MCH)均顯著升高,而血小板計數(PLT)則顯著降低,差異有統計學意義(P<0.05);兩組血液中平均血紅蛋白濃度(MCHC)比較,差異無統計學意義(P>0.05)。見表1。

表1 兩組臨床基本信息
2.2兩組血漿外源性MIR2911表達水平比較 采用qRT-PCR技術分別檢測150例平原漢組及80例高原漢組血漿中的MIR2911表達水平,用Cq值表示。兩組血漿中外源性MIR2911表達水平比較,差異無統計學意義(P=0.087 1),見圖1。

圖1 兩組血漿外源性MIR2911表達水平比較
2.3血漿miR-130a-3p的qRT-PCR檢測結果 高原漢組血漿miR-130a-3p表達水平為[323.12(209.46,618.54)]×10-5高于平原漢組血漿miR-130a-3p表達水平[210.51(158.18,274.98)]×10-5,差異有統計學意義(Z=-5.318,P<0.05)。
2.4miR-130a-3p與血液學指標的相關性 為了驗證miR-130a-3p與機體適應高原低氧環境相關,進一步利用Spearman秩相關分析了miR-130a-3p與RBC、Hb、Hct、PLT之間的相關性。miR-130a-3p與RBC(r=0.58、P<0.001)、Hb(r=0.59、P<0.001)、Hct(r=0.69、P<0.001)均呈正相關,而與PLT(r=-0.21,P=0.001 4)呈負相關。
2.5miR-130a-3p的靶基因預測 為了探討miR-130a-3p在應對高原低氧環境中的作用及潛在的分子學機制,利用TargetScan,miRanda和PicTar靶基因預測軟件預測了其潛在的靶基因,發現miR-130a-3p存在一些與缺氧相關(DDX6、EGLN3、FOSL1、EDN1、CHRN2、PRKA1、I7PR1、PXDN、TGFB1、TGFB2、UCP3等)、紅細胞生成相關(SMAD5、SP1等)、巨核細胞系統增殖與分化(MAFB、HOXD1、CXDCL2、CBFA、MYB、PDGFRA、MAFG、HOXA3)等相關的靶基因。
3 討 論
miRNA可作為多種疾病的潛在生物標志物,但是環境等非病理因素對miRNA表達的影響研究很少。為了將miRNA更好地應用到疾病的診斷、預測中去,必須了解非病理因素對miRNA表達的影響。缺氧發生在許多病理生理過程中,例如組織的快速生長、急慢性缺血及處于高海拔地區等。當平原地區的居民移居到高原環境中時將面對缺氧的威脅,而身體在高原發生缺氧的生理變化很復雜,涉及一系列的生理機制[8-9]。有研究發現,在缺氧情況下機體、細胞中的一些miRNA的表達水平會發生變化,除此之外在與缺氧相關的疾病中一些miRNA的表達水平也會發生變化[5-7]。然而這些研究主要集中在組織或細胞層面的miRNA的表達水平上。考慮到miRNA是應對缺氧的關鍵因素,推測高原低氧環境可能對循環miRNA的表達也存在影響。
紅細胞的生理功能是將氧氣從肺部毛細血管運輸到組織毛細血管進行氣體交換,紅細胞生成過程受到包括氧含量在內的多種因素的影響。當平原地區居民移居到高海拔地區時不能很好地適應高原低氧的環境,為了獲得充分的氣體交換,機體內RBC、Hb、Hct等會升高[10]。本研究發現,與一直居住在平原地區的人群相比,從平原地區移居到高原地區的人群的RBC、Hb、Hct都顯著升高,與其他研究報道結果一致[9-10]。進一步分析了miR-130a-3p與這些血液學指標的關系,發現miR-130a-3p與RBC、Hb、Hct呈正相關。這些結果提示 miR-130a-3p可能通過調節紅細胞的生成、分化等參與機體對低氧環境的適應過程。
另外,通過分析生物信息學技術預測了miR-130a-3p的靶基因,發現miR-130a-3p的部分靶基因與氧代謝及氧敏感度有關。如預測到miR-130a-3p的靶基因DDX6,miR-130a-3p能夠通過靶向調節DDX6進而增強缺氧誘導因子1α(HIF-1α)的作用來調節細胞對缺氧的反應[11]。此外,miR-130a-3p還存在一些與紅細胞生成、巨核細胞分化相關的靶基因。例如,SMAD5[12]和SP1[13]是與紅細胞生成有關的靶基因,MAFB[14]和MYB[15]是在巨核細胞分化過程中起重要作用的轉錄因子。以上結果進一步說明miR-130a-3p可能通過參與紅細胞的生成和巨核細胞的分化來調節機體對高原低氧環境的適應過程。但是,在本研究中并未涉及miR-130a-3p在機體應對低氧環境中的具體分子機制,在之后的試驗中有待更深入的研究。
綜上所述,高原低氧環境能夠影響血漿miR-130a-3p表達水平,miR-130a-3p可作為應對缺氧環境的一個循環因子。本研究進一步分析了miR-130a-3p與血細胞指標的相關性并預測了miR-130a-3p的一些潛在的靶基因。以上研究結果為研究人類適應高原環境的分子機制提供了新視角,miR-130a-3p可能參與這一適應過程。

