circ_0001946靶向miR-1270/Cyclin T2軸調控胃癌細胞惡性表型的分子機制研究
王 競,趙亞男,文 歡,劉為平,霍曉輝,范紅云
據GLOBOCAN最新統計數據顯示,2018年胃癌新發病例約103.3萬例,死亡病例約78.3萬例,其發病率在所有惡性腫瘤中位居第5,病死率位居第3[1]。中國是胃癌高發國家,且存在明顯的地區差異。胃癌發病隱匿,易誤診,多數患者預后較差[2]。目前胃癌發病機制尚未明了,且缺乏有效的治療方法。環狀RNA(circRNA)和微小RNA(miR)是2類非編碼RNA,且circRNA可作為競爭性內源性RNA與miR靶向結合,調控miR靶基因表達,進而影響細胞增殖和凋亡等生命活動,參與腫瘤發展過程[3]。研究顯示,circ_0001946在結直腸癌組織中表達升高,沉默其表達可通過靶向miR-135a-5p/上皮間質轉化(EMT)軸抑制癌細胞生長、遷移和侵襲能力,其可能是結直腸癌治療的分子靶點[4]。膠質母細胞瘤細胞中circ_0001946表達較低,circ_0001946過表達通過靶向miR-671-5p/CDR1軸降低體外膠質母細胞瘤細胞的增殖、遷移和侵襲能力,增加細胞凋亡,并抑制體內異種移植瘤生長,提示其在膠質母細胞瘤中起抑癌作用[5]。Starbase靶基因在線軟件預測顯示,circ_0001946可能與miR-1270存在靶向調控關系,細胞周期蛋白T2(Cyclin T2)可能是miR-1270的靶基因。研究顯示,miR-1270在卵巢癌[6]、肺腺癌[7]、多形膠質母細胞瘤[8]和骨肉瘤[9]等腫瘤中表達降低,上調miR-1270表達可抑制腫瘤細胞惡性表型,進而抑制腫瘤發展。有報道稱,靶向抑制Cyclin T2表達可削弱胃癌細胞的增殖、遷移和侵襲能力,并阻礙細胞周期進程,誘導細胞凋亡,其可作為促癌基因參與胃癌的發展進程[10]。本研究檢測了胃癌組織和細胞系中circ_0001946與miR-1270的表達,并以miR-1270/Cyclin T2軸為切入點,探究circ_0001946對胃癌細胞增殖、凋亡和侵襲的影響及可能作用機制。
1 材料與方法
1.1組織、細胞和試劑 45例胃癌組織及癌旁組織取自2017年6月—2019年12月在本院確診并行手術治療的胃癌患者,其中男25例、女20例,年齡(58.63±8.49)歲。正常胃黏膜上皮細胞GES-1及胃癌細胞系(HGC-27、AGS、MKN45),由中國科學院上海細胞庫提供;RNA抽提試劑盒、逆轉錄試劑盒和PCR試劑盒,購自寶生物工程(大連)有限公司;RPMI 1640培養液、BCA蛋白檢測試劑盒和雙熒光素酶活性檢測試劑盒,購自北京索萊寶科技有限公司;胎牛血清,購自浙江天杭生物科技股份有限公司;LipofectamineTM2000試劑盒,購自美國Invitrogen公司;PCR引物、circ_0001946小干擾RNA(si-circ_0001946)、小干擾RNA陰性對照(si-NC)、miR-1270抑制劑(anti-miR-1270)及陰性序列(anti-miR-NC)、miR-1270模擬物(mimics)及對照序列(miR-NC),購自生工生物工程(上海)股份有限公司。
1.2研究方法
1.2.1qRT-PCR法檢測circ_0001946和miR-1270表達:將組織樣本在液氮保護下充分研磨,用RNA抽提試劑提取組織總RNA,并逆轉錄為cDNA,行PCR擴增。擴增程序:95℃ 5 min,95℃ 10 s,60℃ 30 s,72℃ 30 s,共35個循環。引物序列見表1。用2-ΔΔCt法計算circ_0001946相對于內參GAPDH、miR-1270、U6的表達水平。

表1 引物序列
1.2.2細胞培養:復蘇正常胃黏膜上皮細胞GES-1及胃癌細胞系(HGC-27、AGS、MKN45),均用含10%胎牛血清的RPMI 1640培養液于普通培養箱中培養。將各對數生長期細胞接種至6孔板中(1.0×105個/孔),培養24 h后收集細胞,qRT-PCR法檢測細胞中circ_0001946和miR-1270表達,方法同“1.2.1”,選擇circ_0001946和miR-1270表達較GES-1細胞差異最顯著的胃癌細胞HGC-27進行后續實驗。
1.2.3細胞轉染:將對數生長期HGC-27細胞接種至6孔板中(1.0×105個/孔),培養4 h后棄培養液。用LipofectamineTM2000脂質體法,分別轉染si-NC(si-NC組)、si-circ_0001946(si-circ_0001946組)、miR-NC(miR-NC組)、miR-1270 mimics(miR-1270組)、共轉染si-circ_0001946與anti-miR-NC(si-circ_0001946+anti-miR-NC組)、共轉染si-circ_0001946與anti-miR-1270(si-circ_0001946+anti-miR-1270組)。轉染12 h后,換為新鮮培養液再培養24 h,qRT-PCR法檢測細胞中circ_0001946或miR-1270表達驗證轉染效果,方法同“1.2.1”,并收集細胞備用。同時設置對照組(Control組),細胞常規培養,不進行轉染操作。
1.2.4CCK-8法檢測細胞增殖情況:將轉染后的各組細胞接種至96孔板中(2.5×104個/孔),分別培養24、48和72 h后加CCK-8 10 μl孵育2 h,用酶標儀于450 nm波長處測光密度(OD)值。
1.2.5克隆形成實驗:將轉染后各組細胞接種至6孔板中(1.0×104個/孔),每2天換新鮮培養液1次。培養14 d后棄培養液,經多聚甲醛固定、結晶紫染色后,顯微鏡下統計超過50個細胞的克隆數。
1.2.6Transwell法檢測細胞侵襲情況:將轉染后的各組細胞密度調至5.0×104個/ml。Transwell小室置于24孔板中,鋪Matrigel基質膠,自然晾干。在上室中加細胞懸液100 μl,下室加培養液500 μl。培養48 h后棄培養液,多聚甲醛固定、結晶紫染色,顯微鏡下隨機取5個視野記數細胞侵襲情況。
1.2.7雙熒光素酶報告基因實驗:由生工生物工程(上海)股份有限公司根據Starbase靶基因在線軟件預測的miR-1270與circ_0001946或Cyclin T2結合位點,分別設計并合成circ_0001946、Cyclin T2的野生型熒光素酶載體(WT-circ_0001946、WT-Cyclin T2)及突變型熒光素酶載體(MUT-circ_0001946、MUT-Cyclin T2)。將HGC-27細胞接種至6孔板中(1.0×105個/孔),用LipofectamineTM2000脂質體法,分別共轉染miR-1270 mimics與WT-circ_0001946或WT-Cyclin T2、miR-NC與WT-circ_0001946或WT-Cyclin T2、miR-1270 mimics與MUT-circ_0001946或MUT-Cyclin T2、miR-NC與MUT-circ_0001946或MUT-Cyclin T2。轉染12 h后,換新鮮培養液再培養24 h,收集各組細胞并裂解。3500 r/min離心5 min后取上清,檢測熒光素酶活性。
1.2.8蛋白免疫印跡法檢測Cyclin T2蛋白表達:將轉染后的各組細胞接種至6孔板中(1.0×105個/孔),培養48 h后用RIPA試劑提取細胞中總蛋白。經BCA定量、電泳、轉膜和封閉后,分別用Cyclin T2(1︰500)和GAPDH(1︰1000)一抗4℃孵育過夜。洗膜后,用山羊抗兔二抗(1︰1000)37℃孵育2 h。顯影液避光顯影,凝膠系統拍照,Image J軟件分析Cyclin T2對于GAPDH表達量。

2 結果
2.1胃癌組織中circ_0001946與miR-1270表達及相關性 胃癌組織中circ_0001946表達高于癌旁組織(2.65±0.18 vs 1.00±0.06),而miR-1270表達低于癌旁組織(0.26±0.06 vs 1.00±0.05),差異有統計學意義(P<0.05)。Pearson相關性分析顯示,胃癌組織中circ_0001946與miR-1270表達呈負相關(r=-0.752,P<0.05)。見圖1。
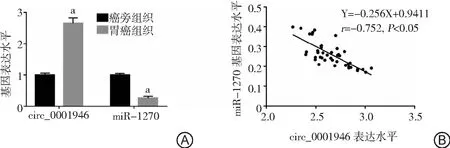
圖1 胃癌組織中circ_0001946與miR-1270表達及相關性A.胃癌組織中circ_0001946和miR-1270的表達水平,與癌旁組織比較,aP<0.05;B.胃癌組織中circ_0001946與miR-1270表達的相關性
2.2胃癌細胞系中circ_0001946與miR-1270表達情況 胃癌細胞系(HGC-27、AGS、MKN45)中circ_0001946表達高于正常胃黏膜上皮細胞GES-1(2.81±0.17、1.43±0.08、2.08±0.15 vs 1.00±0.01),而miR-1270表達低于GES-1細胞(0.29±0.07、0.79±0.09、0.52±0.09 vs 1.00±0.00),差異有統計學意義(P<0.05)。見圖2。
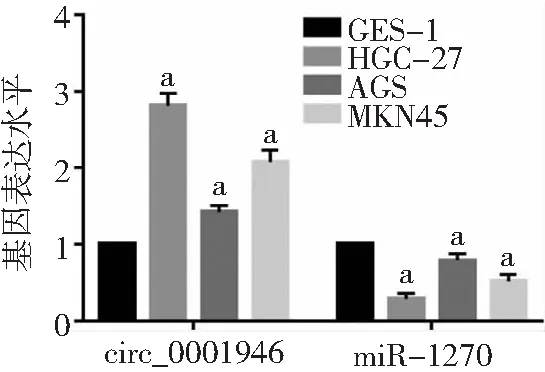
圖2 胃癌細胞系中circ_0001946與miR-1270的表達與GES-1細胞比較,aP<0.05
2.3circ_0001946過表達對胃癌HGC-27細胞增殖、凋亡和侵襲能力的影響 si-circ_0001946組胃癌HGC-27細胞中circ_0001946表達量低于Contorl組和si-NC組(P<0.05),表明敲減circ_0001946的HGC-27細胞構建成功,見圖3。si-circ_0001946組HGC-27細胞OD值、克隆形成數和侵襲數低于Contorl組和si-NC組,凋亡率高于Contorl組和si-NC組,差異有統計學意義(P<0.05);Contorl組與si-NC組各檢測指標比較差異無統計學意義(P>0.05)。見圖4~7及表1。
表1 敲減circ_0001946對胃癌HGC-27細胞克隆、凋亡和侵襲能力的影響
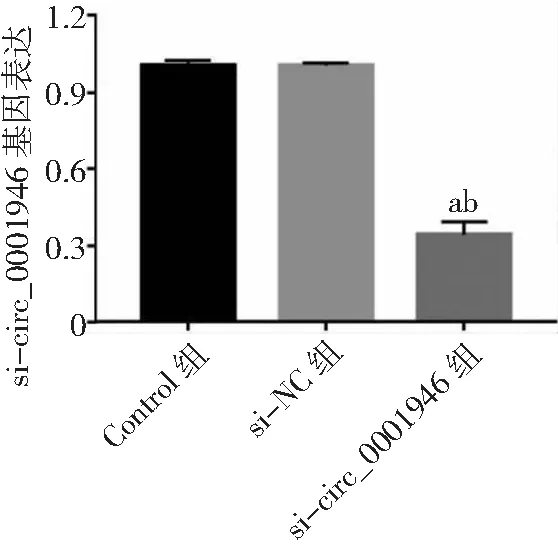
圖3 胃癌HGC-27細胞si-circ_0001946轉染效果與Control組比較,aP<0.05;與si-NC組比較,bP<0.05
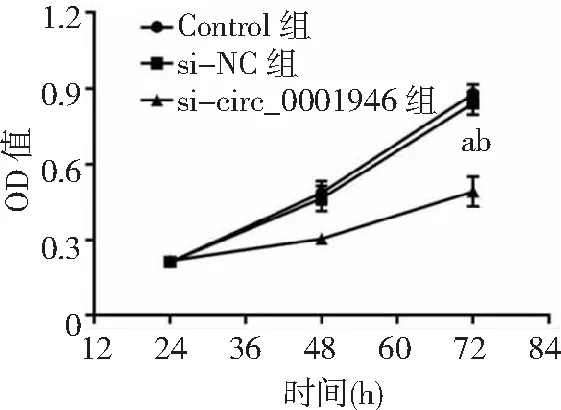
圖4 敲減circ_0001946對胃癌HGC-27細胞OD值的影響OD為光密度;與Control組比較,aP<0.05;與si-NC組比較,bP<0.05
2.4miR-1270過表達對胃癌HGC-27細胞增殖、凋亡和侵襲能力的影響 miR-1270組胃癌HGC-27細胞中miR-1270表達量高于Control組和miR-NC組(P<0.05),表明miR-1270過表達的HGC-27細胞構建成功,見圖8。miR-1270組HGC-27細胞OD值、克隆形成數和侵襲數低于Control組和miR-NC組(P<0.05),凋亡率高于Control組和miR-NC組(P<0.05),而Control組與miR-NC組各檢測指標比較無統計學意義(P>0.05)。見圖9~12及表2。
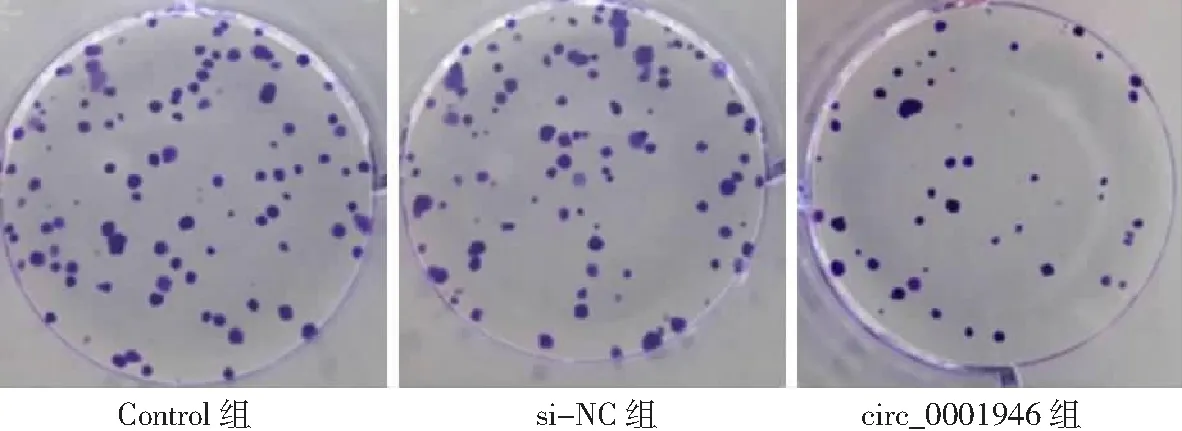
圖5 敲減circ_0001946對胃癌HGC-27細胞克隆形成數的影響(×10)
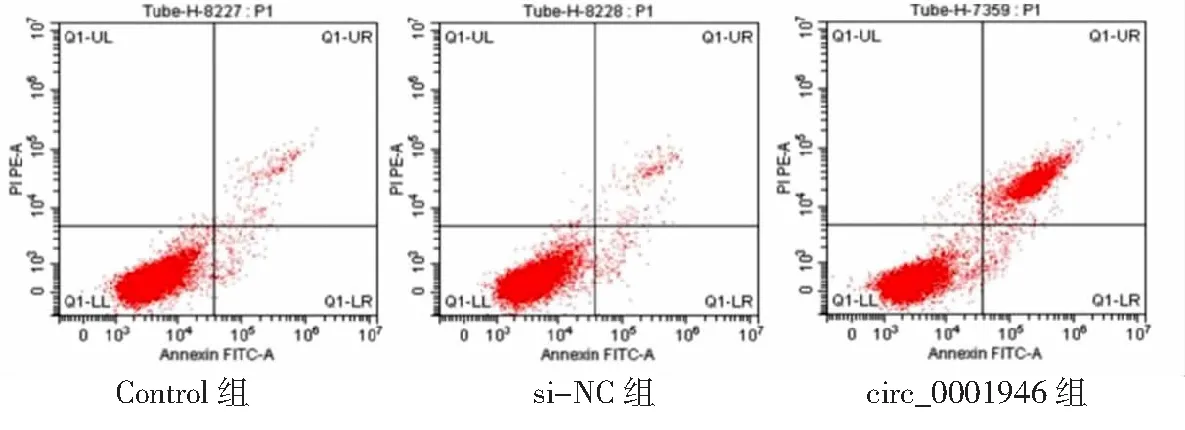
圖6 敲減circ_0001946對胃癌HGC-27細胞凋亡的影響
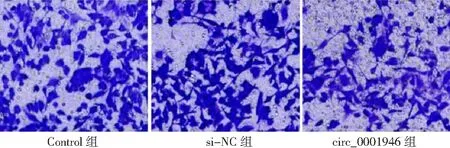
圖7 敲減circ_0001946對胃癌HGC-27細胞侵襲的影響(×100)
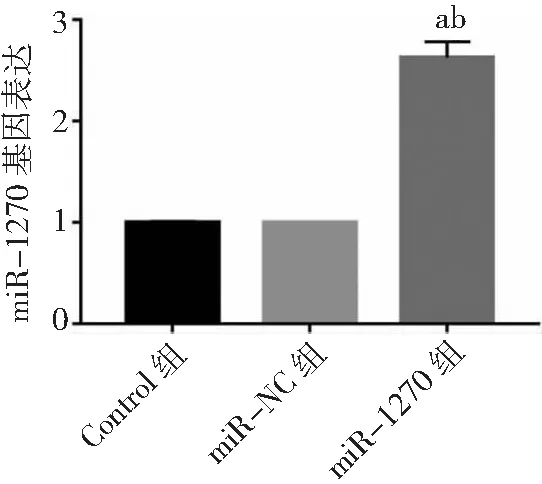
圖8 胃癌HGC-27細胞miR-1270 mimics轉染效果與Control組比較,aP<0.05;與miR-NC組比較,bP<0.05
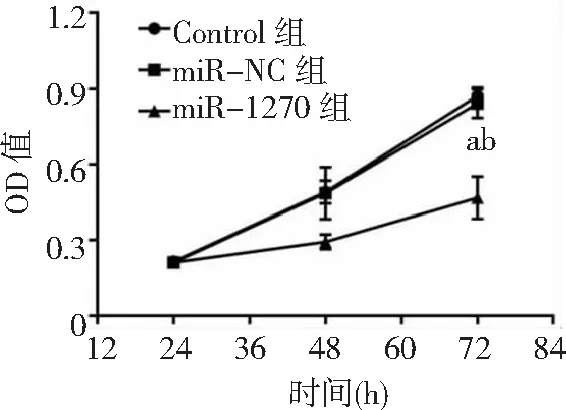
圖9 miR-1270過表達對胃癌HGC-27細胞OD值的影響OD為光密度;與Control組比較,aP<0.05;與miR-NC組比較,bP<0.05
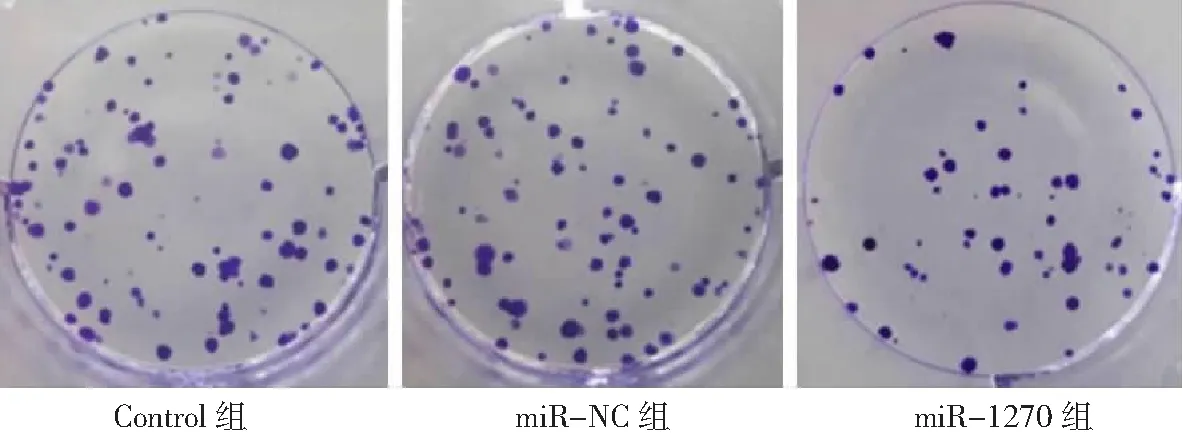
圖10 miR-1270過表達對胃癌HGC-27細胞克隆形成數的影響(×10)

圖11 miR-1270過表達對胃癌HGC-27細胞凋亡的影響
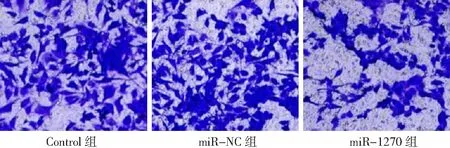
圖12 miR-1270過表達對胃癌HGC-27細胞侵襲的影響(×100)
表2 miR-1270過表達對胃癌HGC-27細胞克隆、凋亡和侵襲能力的影響
2.5敲減miR-1270抑制敲減circ_0001946對胃癌細胞的影響 si-circ_0001946+anti-miR-1270組胃癌HGC-27細胞miR-1270表達量低于si-circ_0001946+anti-miR-NC組(P<0.05),細胞OD值、克隆形成數和侵襲數高于si-circ_0001946+anti-miR-NC組(P<0.05),凋亡率低于si-circ_0001946+anti-miR-NC組(P<0.05),而si-circ_0001946組與si-circ_0001946+anti-miR-NC組各指標無差異(P>0.05)。見圖13~17及表3。
表3 敲減miR-1270抑制敲減circ_0001946對胃癌細胞克隆、凋亡和侵襲能力的影響
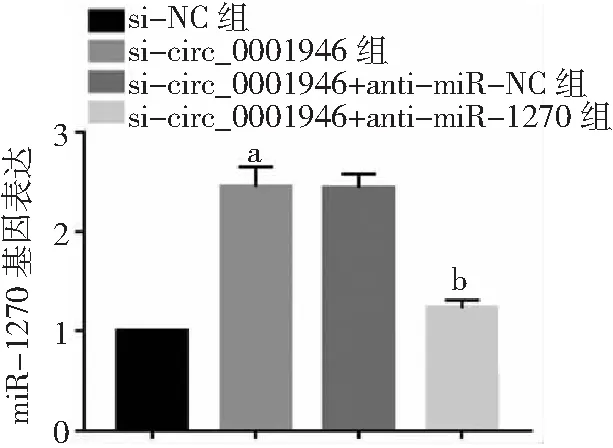
圖13 胃癌HGC-27細胞anti-miR-1270轉染效果與si-NC組比較,aP<0.05;與si-circ_0001946+anti-miR-NC組比較,bP<0.05
2.6circ_0001946對miR-1270/Cyclin T2的影響 雙熒光素酶報告基因實驗結果顯示,miR-1270與WT-circ_0001946或WT-Cyclin T2共轉染后的胃癌HGC-27細胞熒光素酶活性顯著降低(P<0.05),而與MUT-circ_0001946或MUT-Cyclin T2共轉染后的胃癌HGC-27細胞熒光素酶活性無顯著變化(P>0.05)。見圖18。si-circ_0001946組胃癌HGC-27細胞中miR-1270表達高于Control組和si-NC組(P<0.05),而Cyclin T2蛋白表達低于Control組和si-NC組(P<0.05)。miR-1270組胃癌HGC-27細胞中Cyclin T2蛋白表達低于Control組和miR-NC組(P<0.05),而si-circ_0001946+anti-miR-1270組HGC-27細胞中Cyclin T2蛋白表達高于si-circ_0001946+anti-miR-NC組(P<0.05)。見圖19、20。
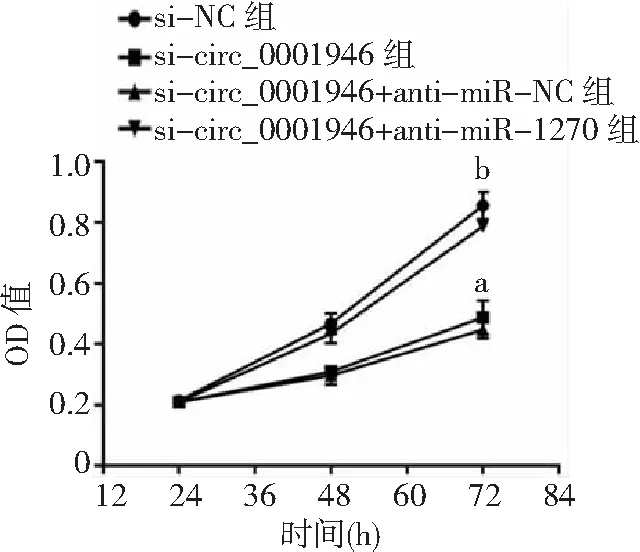
圖14 敲減miR-1270抑制敲減circ_0001946對胃癌HGC-27細胞OD值的影響OD為光密度;與si-NC組比較,aP<0.05;與si-circ_0001946+anti-miR-NC組比較,bP<0.05

圖15 敲減miR-1270抑制敲減circ_0001946對胃癌HGC-27細胞克隆形成數的影響(×10)

圖16 敲減miR-1270抑制敲減circ_0001946對胃癌HGC-27細胞凋亡的影響
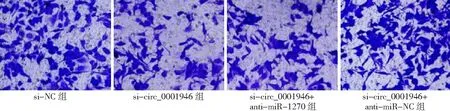
圖17 敲減miR-1270抑制敲減circ_0001946對胃癌HGC-27細胞侵襲的影響(×100)
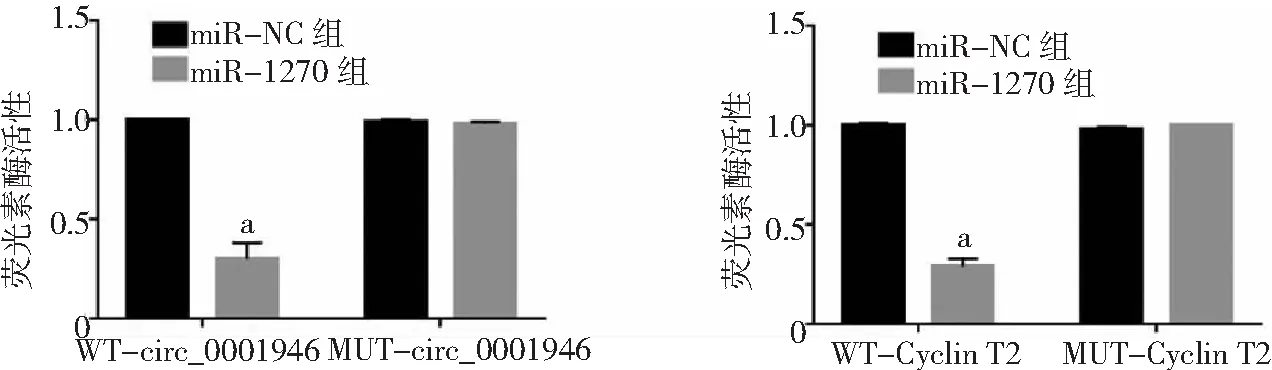
圖18 雙熒光素酶報告基因實驗結果與miR-NC組比較,aP<0.05
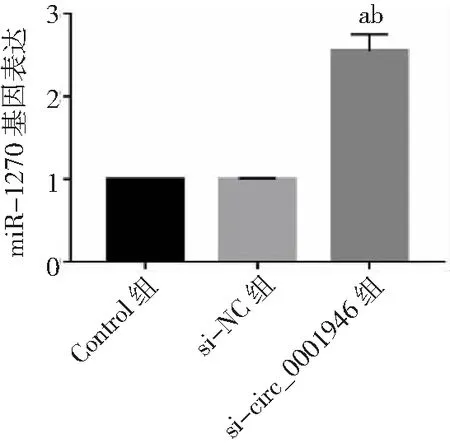
圖19 敲減circ_0001946對胃癌HGC-27細胞miR-1270表達的影響與Control組比較,aP<0.05;與si-NC組比較,bP<0.05
3 討論
胃癌的發生發展與多種因素有關[11-12],其中原癌基因的激活與抑癌基因的失活在胃癌的發生發展中起重要作用[13]。circRNA呈閉合環狀結構,具有較高的穩定性和保守性,在真核生物中廣泛存在。近年來,隨著高通量測序技術的發展,發現腫瘤中存在大量異常表達的circRNA,這些異常表達的circRNA參與調控腫瘤細胞的惡性表型,進而影響腫瘤的發生發展。
已有研究表明,circ_0032627[14]、circ-ZNF609[15]、circ-CCDC66[16]等多種circRNA在胃癌中表達升高,促進了胃癌的發展進程。作為一種circRNA,circ_0001946參與了多種腫瘤的發展進程。有報道稱,circ_0001946在肺腺癌組織和細胞系中均過表達,敲減其表達可通過靶向miR-135a-5p/SIRT1軸抑制癌細胞生長,提示其可能是治療肺腺癌的潛在生物學標志物[17]。本研究首先采用qRT-PCR技術檢測了胃癌組織及細胞系中circ_0001946的表達情況,結果顯示,circ_0001946在胃癌組織及細胞系中表達升高,提示其可能促進了胃癌的發展進程;通過干擾胃癌細胞中circ_0001946的表達,發現干擾circ_0001946能夠顯著削弱胃癌細胞的增殖和侵襲能力,并促進胃癌細胞凋亡,提示circ_0001946也有可能成為胃癌治療的分子靶點。


圖20 circ_0001946靶向miR-1270調控胃癌HGC-27細胞中Cyclin T2蛋白基因表達情況A為Control組,B為si-NC組,C為si-circ_0001946組,D為miR-NC組,E為miR-1270組,F為si-circ_0001946+anti-miR-NC組,G為si-circ_0001946+anti-miR-1270組;與Control組比較,aP<0.05;與si-NC組比較,bP<0.05;與miR-NC組比較,cP<0.05;與si-circ_0001946+anti-miR-NC組比較,dP<0.05
為探究敲減circ_0001946抑制胃癌細胞惡性表型的分子機制,本研究利用雙熒光素酶報告基因實驗證實了circ_0001946可競爭性結合miR-1270,同時敲減circ_0001946可促進胃癌細胞中miR-1270的表達,這與本文胃癌組織中circ_0001946與miR-1270表達呈負相關的結果相一致。miR-1270參與多種腫瘤的發展進程,且在不同腫瘤中發揮的作用不同。有報道稱,circ_0001247在宮頸癌中表達升高,其通過競爭性結合miR-1270上調ZEB2表達,進而促進宮頸癌細胞的增殖和轉移,減少癌細胞凋亡[18];circ_103809在肝癌細胞中高表達,干擾circ_103809可通過靶向miR-1270/PLAGL2軸抑制肝癌細胞增殖、遷移、侵襲能力及EMT過程[19]。miR-1270在甲狀腺乳頭狀癌細胞系和腫瘤組織中表達上調,可促進癌細胞增殖和遷移[20]。本研究結果顯示,miR-1270在胃癌組織及細胞系中表達降低, miR-1270過表達可有效阻礙胃癌細胞增殖和侵襲,并加劇胃癌細胞凋亡,說明miR-1270在胃癌的發展中起抑制作用。本研究結果還顯示,敲減miR-1270可抑制敲減circ_0001946對胃癌細胞增殖、凋亡及侵襲能力的影響,提示circ_0001946可能通過靶向結合miR-1270影響胃癌細胞的惡性表型。
Cyclin T2是細胞周期調控蛋白,其可與CDK9結合形成異二聚體后活化轉錄延長促進因子P-TEFb,進而調控細胞周期,影響細胞增殖。研究顯示,胃癌組織中miR-142-3p表達降低,上調其表達可通過靶向抑制Cyclin T2的表達降低胃癌細胞的增殖、侵襲和遷移能力[21]。本研究證實了Cyclin T2是miR-1270的靶基因,且敲減circ_0001946或miR-1270過表達可降低胃癌細胞中Cyclin T2的表達,且敲減miR-1270可降低敲減circ_0001946對胃癌細胞Cyclin T2表達的抑制作用,進一步提示circ_0001946可通過靶向結合miR-1270進而調控Cyclin T2的表達。
綜上,circ_0001946在胃癌組織和細胞系中表達升高,敲減其表達可有效阻礙胃癌細胞增殖和侵襲,并促進胃癌細胞凋亡,其可能通過競爭性結合miR-1270并調控Cyclin T2來影響胃癌細胞的惡性表型,有可能成為胃癌治療的分子靶點。

