芝麻素對糖尿病心肌病的保護作用及機制研究
郭振,劉方圓,安鵬,汪銘煜,楊丹,楊政,樊迪,唐其柱
糖尿病心肌病(DCM)是1 型和2 型糖尿病最為嚴重且常見并發癥之一[1]。DCM 的主要機制是高血糖和晚期糖基化終產物的產生,導致內皮功能障礙,引起炎癥和氧化應激的增加[2],其主要特征是心肌結構和功能的改變,表現為早期心肌順應性降低和舒張期充盈受阻的舒張功能不全,晚期收縮功能不全[3]。
芝麻素(sesamin,SES)是一種木脂素類植物營養素,是芝麻籽和芝麻油的主要成分之一[4]。研究表明,它具有多種生物學功能,包括抗氧化應激[5-7]、抗炎[8-9]、抗高血壓[10]的作用。而其在DCM 中的作用尚少見報道,結合SES 具有的抗炎、抗氧化的藥理作用,本研究猜想SES 是否可以改善鏈脲佐菌素(streptozotocin,STZ)誘導的糖尿病心肌損害。
1 材料與方法
主要試劑與材料:SES(#607-80-7)購自上海融禾醫藥科技發展有限公司(上海),其純度≥99%。STZ 購自Sigma Aldrich(St Louis,MO,美國),血糖、丙二醛(MDA)、超氧化物歧化酶(SOD)檢測試劑盒購自南京建成生物試劑公司(江蘇,中國),白細胞介素1β(IL-1β)、白細胞介素6(IL-6)、腫瘤壞死因子α(TNF-α)等引物由生工生物工程公司合成(上海),細胞DCMEM 培養基和胎牛血清購自GIBCO Life Technologies(GIBCO,美國)。羊抗兔二抗(美國CST 公司,7074);反轉錄試劑盒和實時PCR(RT-PCR)試劑(瑞士Roche 公司,4896866001),SYBRGreen I Master(瑞士Roche 公司4707516001)。定量RT-PCR 儀(瑞士R oche 公司,型號:LC480),酶標儀(美國伯騰儀器有限公司,Synergy HT)。
動物分組及給藥方法:50 只健康雄性C57BL/6J小鼠,8 周齡,體重在18~23 g,購自中國醫學科學院動物研究所。實驗小鼠經過1 周檢疫后,將周齡及體重達標且健康的雄性小鼠入組。將小鼠隨機分為5組(每組8 只):對照組、SES組、DCM組、DCM+二甲雙胍(MET,10 mg/kg)灌胃組(簡稱DCM+MET組)以及DCM+SES(100 mg/kg)灌胃組(簡稱DCM+SES組)[11]。
DCM 模型建立:小鼠給與腹腔注射STZ(溶于0.1 mol/L 的檸檬酸鹽緩沖液中,pH=4.5,50 mg/kg),連續注射5 d。一周后,斷尾采血檢測其空腹血糖平均值≥16.6 mmol/L,且出現糖尿病典型癥狀,表示糖尿病模型建立成功。對照組小鼠注射等體積檸檬酸鹽溶液。STZ 注射12 周后進行MET 和SES 持續灌胃4 周。4 周后取出小鼠心臟用于病理和分子生物學分析。
葡萄糖耐量試驗(OGTT):小鼠麻醉取材前一天,饑餓處理16 h。葡萄糖(2.0 g/kg)灌胃,分別在0、30 min、60 min 和120 min 使用血糖儀測量小鼠血糖濃度。
心肌肌鈣蛋白I(cTnI)和肌酸激酶同工酶(CKMB)水平:MET 和SES 持續灌胃4 周后,麻醉前取小鼠眼眶下靜脈叢血液,室溫下放置2 h 后離心獲得血漿上清。使用cTnI 和CK-MB 檢測試劑盒,按照說明書檢測血清cTnI 和CK-MB 水平。
SOD 活性和MDA 含量檢測:MET 和SES 持續灌胃4 周后收集各組小鼠心臟組織按照試劑盒說明書檢測S0D 活性及MDA 水平。
二氫乙啶(DHE)染色檢測心肌氧化應激水平:取材后的小鼠心臟經脫水、石蠟包埋、切片后,脫蠟水合、DHE 染色、熒光顯微鏡下拍照。
免疫組化檢測炎癥浸潤程度:取材后的小鼠心臟經脫水、石蠟包埋、切片后,脫蠟水合、檸檬酸抗原修復、10%羊血清封閉后,孵育TNF-α、CD45 一抗4℃過夜,次日復溫,應用二氨基聯苯胺(DAB)顯色,拍照。
RT-PCR 檢測信使RNA(mRNA)表達水平:取出凍存的心臟組織每個檢測樣品15 mg,加入1 ml TRiZOL 研磨制成勻漿。按照總RNA 提取步驟獲得樣品組織總RNA。每個組織樣品取出2 μg 總RNA逆轉錄獲得互補DNA。使用SYBR GREEN I RTPCR 體系檢測心肌細胞相關基因的表達。
蛋白免跡印跡(Western blot)檢測炎癥和氧化應激標志物的蛋白水平:取心臟組織或H9c2 細胞,研磨后加入RIPA 裂解液進行裂解,提取蛋白并定量。每孔蛋白上樣量50 μg 進行聚丙烯酰胺凝膠(SDSPAGE)電泳。轉膜,封閉后分別孵育一抗,4℃過夜,次日二抗孵育1 h 后顯色。以甘油醛-3-磷酸脫氫酶(GAPDH)作為內參,采用Image-Pro Plus 6.0 軟件檢測各條帶的吸光度(A)值。
細胞培養Sirt3 抑制試驗:心肌H9c2 細胞使用10% FBS/DCMEM 培養基培養。心肌H9c2 細接種在六孔板上培養,1×104細胞數/孔。在37℃、5%二氧化碳(CO2)培養箱中常規培養24 h。將細胞分為8組:①對照組[5.5 mmol/L 葡萄糖(GLU)培養24 h]、②SES組[11](10 mmol/L 處理24 h)、③高糖(HG)組(33 mmol/L GLU刺激24 h)、④HG+SES組(33 mmol/L GLU+10 mmol/L SES 24 h),及在前四組的基礎上分別添加Sirt3 選擇性抑制劑(3-TYP,50 μmol/L 處理24 h)即:⑤對照+3-TYP組、⑥SES+3-TYP組、⑦HG+3-TYP組、⑧HG+SES+3-TYP組。細胞處理結束后使用細胞增殖檢測(CCK8)試劑盒(碧云天)檢測心肌H9c2 細胞的存活率。
統計學方法:數據分析采用SPSS 23.0 數據分析軟件。計量資料采用均數±標準差(±s)表示,多組間比較采用單因素方差分析,兩兩比較采用SNK-q 檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 各組血糖水平和心肌損傷標志物比較(圖1)
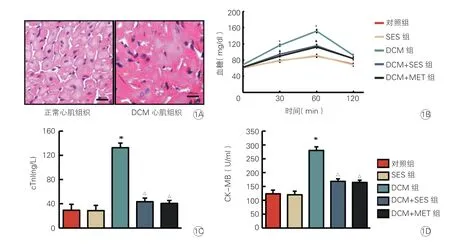
圖1 各組小鼠血糖水平和心肌損傷標志物的比較(各組n=8)
HE 染色結果表明,對照組心肌細胞排列整齊,結構清晰;DCM組心肌組織結構排列紊亂,結構不清晰,細胞核膜皺縮破裂(圖1A),可證明DCM 模型構建成功。在OGTT 試驗中分別檢測四個時間點小鼠餐后0 min、30 min、60 min 和120 min 的血糖水平。各組小鼠餐后血糖水平在60 min 時間達到高峰,DCM組小鼠血糖水平顯著高于對照組(P<0.05),DCM+SES組和DCM+MET組小鼠餐后血糖水平顯著低于DCM組(P<0.05),而DCM+MET組 與DCM+SES組小鼠餐后血糖水平差異無統計學意義(P>0.05,圖1B)。
DCM組小鼠cTnI、CK-MB 水平均顯著高于對照組(P均<0.05),DCM+SES組和DCM+MET組小鼠cTnI、CK-MB 水平均顯著低于DCM組(P均<0.05),而DCM+MET組與DCM+SES組小鼠cTnI、CK-MB 水平差異均無統計學意義(P均>0.05,圖1C、1D)。
2.2 SES 對DCM 小鼠心肌組織氧化應激狀態的影響(表1、圖2)
表1 各組小鼠MDA 和SOD 含量比較(各組n=8,±s)
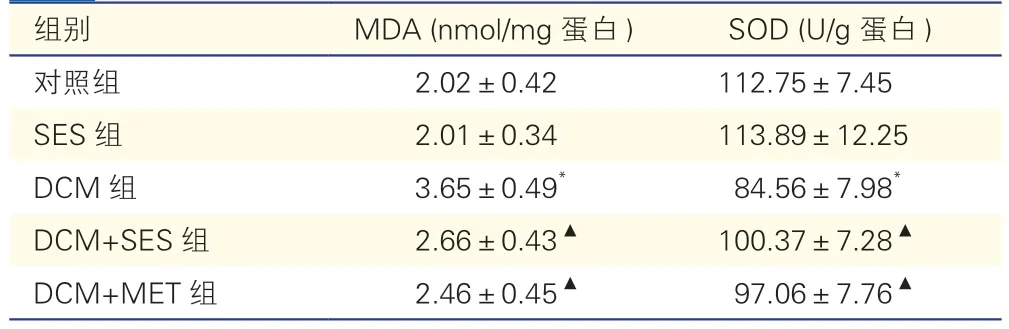
表1 各組小鼠MDA 和SOD 含量比較(各組n=8,±s)
注:SES:芝麻素;DCM:糖尿病心肌病;MET:二甲雙胍;MDA:丙二醛;SOD:超氧化物歧化酶。與對照組比較*P<0.05;與DCM組比較▲P<0.05

圖2 SES 對DCM 小鼠心肌組織氧化應激狀態的影響(各組n=8)
DCM組小鼠脂質過氧化產物MDA 顯著高于對照組,而SOD 活性含量顯著低于對照組(P<0.05);DCM+SES組心肌組織中MDA 顯著低于DCM組,而SOD 含量顯著高于DCM組(P<0.05),而DCM+MET組與DCM+SES組間MDA/SOD 含量水平差異均無統計學意義(P均>0.05,表1)。
DHE 染色結果表明,DCM組小鼠的DHE 陽性強度明顯強于對照組(P<0.05),DCM+SES組和DCM+MET組小鼠的DHE 陽性強度顯著低于DCM組(P<0.05),且DCM+MET組與DCM+SES組之間差異無統計學意義(P>0.05,圖2A、2B)。
RT-PCR 結果表明,DCM組小鼠的煙酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶功能亞基(p22phox、p67phox以及gp91phox)mRNA 表達水平明顯高于對照組(P均<0.05),DCM+SES組小鼠的p22phox、p67phox以及gp91phoxmRNA 表達水平顯著低于DCM組(P均<0.05),且DCM+MET組與DCM+SES組 間p22phox、p67phox及gp91phoxmRNA 表達水平差異均無統計學意義(P均>0.05,圖2C)。
Western blot 結果表明,DCM組小鼠的SOD2/p67phox蛋白表達水平明顯低于/高于對照組(P均<0.05),DCM+SES組小鼠心肌組織的SOD2/p67phox蛋白表達水平顯著高于/低于DCM組(P均<0.05),且DCM+MET組與DCM+SES組間SOD2/p67phox蛋白表達水平差異均無統計學意義(P>0.05,圖2D)。
2.3 SES 對糖尿病小鼠心肌組織炎癥的影響(圖3)
免疫組化染色結果表明,DCM組小鼠的CD45和TNF-α 陽性區域明顯高于對照組,DCM+SES組小鼠心肌組織的CD45 和TNF-α 陽性區域顯著低于DCM組(P均<0.05),且DCM+MET組與DCM+SES組間CD45 和TNF-α 陽性區域差異無統計學意義(P均>0.05,圖3A、3B)。
RT-PCR 結果表明,DCM組小鼠的IL-6、IL-1β 和TNF-α mRNA 表達水平明顯高于對照組(P均<0.05),DCM+SES組和DCM+MET組小鼠的IL-6、IL-1β 和TNF-α mRNA 表達水平顯著低于DCM組(P均<0.05,圖3C)。
Western blot 結果表明,DCM組小鼠的TNF-α蛋白表達水平顯著高于對照組(P<0.05);DCM+SES組和DCM+MET組小鼠的TNF-α 蛋白表達水平顯著低于DCM組(P<0.05),而DCM+MET組 與DCM+SES組間TNF-α 蛋白表達水平差異無統計學意義(P>0.05,圖3D)。
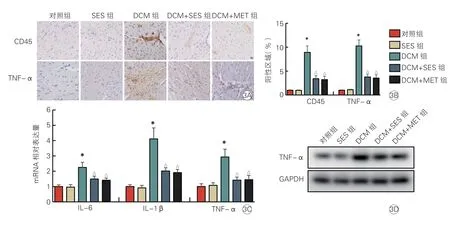
圖3 SES 對DCM 小鼠心肌組織炎癥的影響(各組n=8)
2.4 SES 通過上調Sirt3 對抗高糖導致的心肌細胞氧化應激和炎癥紊亂及細胞的損傷(圖4)
Western blot 結果表明,DCM組小鼠的Sirt3 蛋白表達水平顯著低于對照組(P<0.05);DCM+SES組小鼠的Sirt3 蛋白表達水平顯著高DCM組(P<0.05,圖4A、4B)。
細胞實驗中,通過設置不同的濃度梯度(0~50 mmol/L)的SES,在10 mmol/L 時,SES 能夠最大限度的保護由高糖引起的心肌細胞損傷,同時又能較明顯的激活Sirt3。細胞實驗中,HG+SES組的活性氧(ROS)水平顯著低于HG組(P<0.05);應用3-TYP后,HG+SES+3-TYP組 與HG+3-TYP組ROS 水平差異無統計學意義(P>0.05,圖4C)。Western blot 結果表明,在未加3-TYP 的條件下,SES 均可改善高糖誘導的氧化應激、炎癥狀態和凋亡(圖4D)。HG+SES組SOD2/p67phox蛋白表達水平顯著高于/低于HG組(P均<0.05),HG+SES+3-TYP組與HG+3-TYP組SOD2 和p67phox蛋白表達水平差異均無統計學意義(P均>0.05);HG+SES組TNF-α 蛋白表達水平顯著低于HG組(P<0.05),HG+SES+3-TYP組 與HG+3-TYP組TNF-α蛋白表達水平差異無統計學意義(P>0.05);HG+SES組BCL-2/BAX 蛋白表達水平顯著高于/低于HG組(P均<0.05),HG+SES+3-TYP組 與HG+3-TYP組BCL-2 和BAX 蛋白表達水平差異均無統計學意義(P均>0.05)。HG+SES組細胞存活率顯著高于HG組[(87.68±8.64)% vs.(55.67±7.85)%,P<0.05],HG+SES+3-TYP組 與HG+3-TYP組 細胞存活率差異無統計學意義[(55.39±8.32)%vs.(59.67±7.42)%,P>0.05,圖4E]。
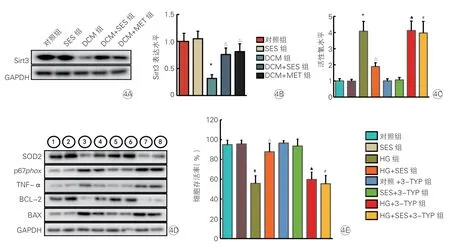
圖4 SES 通過上調Sirt3 對抗高糖導致的心肌細胞氧化應激和炎癥紊亂及細胞的損傷(各組n=6)
3 討論
長期以來,糖尿病一直對人類健康有著巨大的威脅。糖尿病患者易并發DCM,可以造成不可逆轉的心肌重構和心力衰竭,甚至引發心血管事件和死亡發生[12]。針對DCM 患者理想的治療藥物應該可以改善DCM 患者的葡萄糖代謝、心肌細胞內氧化應激和炎癥,而不會引起任何不良反應。然而,長期使用常規的抗糖尿病藥物進行治療和預防會帶來副作用并且對DCM 的緩解作用并不顯著。世界衛生組織糖尿病專家委員會宣布,400 多種傳統藥物有作為DCM 替代療法應用潛力[13]。良好的血糖控制是延緩或阻止糖尿病慢性并發癥發生發展的重要措施[14]。本研究表明,SES 同MET 可顯著降低糖尿病小鼠的血糖水平并可顯著改善STZ 引起的心臟損傷。
炎癥是DCM 的重要病理特征[15],高血糖和游離脂肪酸代謝增加與IL-6、TNF-α、單核細胞趨化蛋白-1 和核因子κB(NF-κB)等促炎細胞因子上調有關[16]。研究表明,SES 可通過減少心肌細胞凋亡和減輕炎癥反應來改善心肌梗死引起的心功能障礙[17]。在本研究中,與DCM組相比,SES 治療降低了CD45 和TNF-α 在心肌組織中的表達,表明SES 治療減少了炎癥細胞的浸潤。SES 治療降低了糖尿病小鼠心肌中TNF-α 等炎癥因子mRNA 的水平,其抗炎作用與MET 治療效果無顯著差異。這些數據表明SES 在控制DCM 中減輕炎癥方面有重要作用。
氧化應激增加與DCM 相關的生化和結構變化有著關鍵作用。SES 通過抑制氧化應激,對阿霉素誘導的急性肝腎毒性具有典型的保護作用[18]。SES通過抗氧化應激對STZ 誘導的胰腺細胞損傷具有保護作用[19]。此外,高糖高脂引起的心肌細胞損傷和凋亡可能與NADPH 氧化酶大量表達相關[20]。與這些結果相一致的是,SES 顯著降低了STZ 誘導的脂質過氧化產物MDA 含量的上升,以及明顯提升了SOD 活性。此外,SES 處理可降低由STZ 誘導的心肌ROS 的生成以及NADHP 氧化酶功能亞基的表達。本研究發現SES 可重建氧化及抗氧化平衡。
Sirt3 是線粒體中的一個重要的煙酰胺腺嘌呤二核苷酸(NAD)依賴的去乙酰化酶,能夠調控線粒體中許多代謝酶的活性。Sirt3 在控制ROS 穩態中起關鍵作用。Sirt3 能夠通過降低細胞ROS 水平來阻斷心肌肥厚[21]。研究表明,線粒體sirtuin 家族參與了糖尿病患者的胰島素抵抗[22]。Sirt3 可以預防甚至逆轉糖尿病引起的視網膜、骨骼和心臟損傷[23-24]。SES 介導的Sirt3 上調通過抑制ROS 產生和下游信號通路阻斷心臟重構反應[11]。與之前研究相一致[25],SES 和MET 上調Sirt3 的表達。為了探究Sirt3 是否在SES 對DCM 的保護作用中起著關鍵作用,本研究應用3-TYP 來抑制Sirt3 的表達。與期望符合的是,3-TYP 在細胞實驗中的應用消除了SES 抗炎癥、抗氧化應激和抗凋亡的保護作用,表現為SES 不能逆轉相關蛋白的表達。
本研究證實了SES 在STZ 誘導的DCM 損傷中的治療作用。SES 顯著的降血糖作用、抗氧化應激以及抗炎等等多種生理作用均被證實。更重要的是,SES 主要通過上調Sirt3 的表達來發揮抗氧化應激、抗炎和抗凋亡的作用。本研究仍存在一定的局限性。SES 激活Sirt3 的機制需要進一步的探索發現。本研究通過使用Sirt3 的外源性抑制劑3-TYP,進一步證實SES 通過Sirt3-SOD2 依賴途徑保護高糖誘導的心肌細胞損傷。總之,本研究結果為常見廣泛植物預防和治療DCM 提供有效證據,并且為DCM 治療藥物的研發提供了新思路。
利益沖突:所有作者均聲明不存在利益沖突

