布洛芬緩釋膠囊在中國健康受試者中生物等效性研究*
陳新民,劉杰,謝斌,楊沛欣,楊瓊
(珠海潤都制藥股份有限公司,珠海 519041)
布洛芬為非甾體類抗炎藥,其抗炎、鎮痛、解熱效果良好,臨床主要用于風濕及類風濕性疾病,以及肌肉痛、神經痛、關節痛等多種中慢性鈍痛。口服布洛芬吸收迅速,但消除半衰期較短,維持治療常需頻繁給藥,長期服用可引起胃腸道刺激反應[1-2],如腹脹、消化不良等,此外還會加重腎臟損傷。緩釋膠囊可有效避免患者日間頻繁給藥的困擾,仿制藥價格往往低于原研藥品,因此,對于眾多的疼痛病患者減輕治療負擔具有一定意義。珠海潤都制藥股份有限公司生產的布洛芬緩釋膠囊為化學藥品仿制藥口服固體制劑,已被列入首批2018年底前須完成仿制藥一致性評價的289個品種目錄中,需要對其進行質量和療效與原研藥(參比制劑)一致性評價工作,開展仿制藥質量和療效與原研藥一致性評價工作,對提升我國制藥行業整體水平,促進醫藥經濟結構調整和產業升級,提高醫藥產業國際競爭能力,滿足公眾用藥需求,都具有十分重要的意義。按照《普通口服固體制劑參比制劑選擇和確定指導原則》選取中美天津史克制藥有限公司的布洛芬緩釋膠囊(商品名:芬必得?)為參比制劑,擬通過兩項試驗(空腹和餐后兩種給藥條件下)評估珠海潤都制藥股份有限公司生產的布洛芬緩釋膠囊與原研制劑的生物等效性。
1 試藥與儀器
1.1試藥 受試制劑:布洛芬緩釋膠囊,規格:300 mg,批號:3091604015,珠海潤都制藥股份有限公司生產;參比制劑:布洛芬緩釋膠囊(商品名:芬必得?),規格:300 mg,批號:16080190,中美天津史克制藥有限公司生產。布洛芬對照品,純度:98%,批號:10-XJZ-87-1,來源Toronto Research Chemicals;布洛芬-d3(內標),純度:99.4%,批號:1503-016A1,來源:TLC Pharmachem。乙腈,色譜級,默克公司;甲醇,色譜級,默克公司;乙酸銨,色譜純Sigma-Aldrich。
1.2儀器 BT125D電子天平[賽多利斯科學儀器(北京)有限公司,感量:0.01 mg];XP6電子天平[梅特勒-托利多儀器(上海)有限公司,感量:0.001 mg];質譜儀API 4000(AB Sciex公司);LC-20AD 高效液相色譜儀,Shimadzu公司;Analyst?數據采集軟件(版本1.6.3);離心機5810R Eppendorf;藥動學分析軟件WinNonlin(Pharsight Corporation,Version 6.3),描述性統計分析采用SAS 軟件(9.4版本)。
2 方法與結果
2.1研究對象 本研究共入組中國健康受試者48例,空腹餐后各24例。空腹試驗入組24例,男、女各12例;年齡19~44歲;體質量45.0~75.0 kg;身高145.5~184.0 cm;體質量指數19.5~24.9 kg·(m2)-1。餐后試驗入組24例,其中男16例,女8例;年齡18~54歲;體質量50.0~85.5 kg;身高149.5~181.5 cm;體質量指數19.7~26.0 kg·(m2)-1。入組的受試者必須充分理解,并自愿簽署本研究的知情同意書;從簽署知情同意書開始至試驗結束后6個月內,受試者或其伴侶必須愿意使用醫學上可接受的避孕方法,且從簽署知情同意書開始至試驗結束受試者不能使用避孕藥物;受試者能夠與研究者作良好的溝通,并能夠依照方案規定完成研究。試驗開始前受試者均簽署書面知情同意書。
2.2給藥方案與血樣采集 本研究是一項空腹與餐后給藥,單中心、單劑量、兩制劑、兩周期、兩序列、隨機、開放、自身交叉的平均生物等效試驗,清洗期為7 d。
受試者在每周期給藥前1天(第1天和第7天)18:30前入住I期臨床試驗病房,統一生活管理,禁止統一飲食以外的任何食物和飲料。受試者于給藥前1天晚餐后,禁食不禁水。在每次入住臨床試驗中心前,均詢問受試者的健康狀況和用藥情況以及飲食、吸煙、飲酒、毒品等,并進行生命體征測量、煙檢、酒精檢測、藥物濫用篩查,女性受試者查血確認是否妊娠。餐后給藥要求受試者進食高脂肪、高熱量餐,30 min內進食完畢。
于試驗第1天、第8天約8:30,由經過培訓的研究人員按隨機表發放受試制劑或參比制劑,受試者空腹用藥(至少空腹10 h)/餐后試驗要求受試者進食高脂肪、高熱量餐,30 min內進食完畢,溫水240 mL送服。給藥前后1 h內禁止飲水(除服藥時給予的240 mL水),給藥后保持上身直立狀態2 h,給藥后4,10 h,分別進食午餐和晚餐。
空腹和餐后試驗分別在給藥前0 h(給藥前60 min內)和給藥后0.5,1,2,3,3.5,4,4.5,5,5.5,6,7,8,10,12,14,24 h,采集前臂靜脈血4 mL,置于含有肝素鋰抗凝劑的采血管中,離心(1500×g,2~8 ℃)10 min,分裝血漿樣本,并在-70 ℃儲存待測。從血樣采集至血漿凍存的時間不超過2 h。服藥后2 h內采血點均在預定時間±3 min內采集;服藥后3~12 h采血點均在預定時間±5 min內采集;服藥后14~24 h采血點均在預定時間±10 min內采集。于每周期入住時、給藥前0 h(給藥前60 min內)及給藥后1,3,5,12,24 h以及任何研究醫生認為有需要的時候,測量受試者的脈搏、血壓、呼吸頻率、腋下體溫。
2.3方法學考察與評價
2.3.1色譜條件 色譜柱:CAPCELL MG C18(50 mm×2.0 mm,5 μm),流動相A:1.00 mmol·L-1乙酸銨溶液,流動相B:1.00 mmol·L-1乙酸銨乙腈/水(95/5)梯度洗脫,進樣器溫度6 ℃,柱溫40 ℃,進樣量5.0 μL。
2.3.2質譜條件 離子源:ESI;離子化方式:負離子模式;掃描方式:MRM;MRM離子對:布洛芬(m/z)為205.4/161.3,布洛芬-d3(m/z)為208.5/164.4。見圖1。
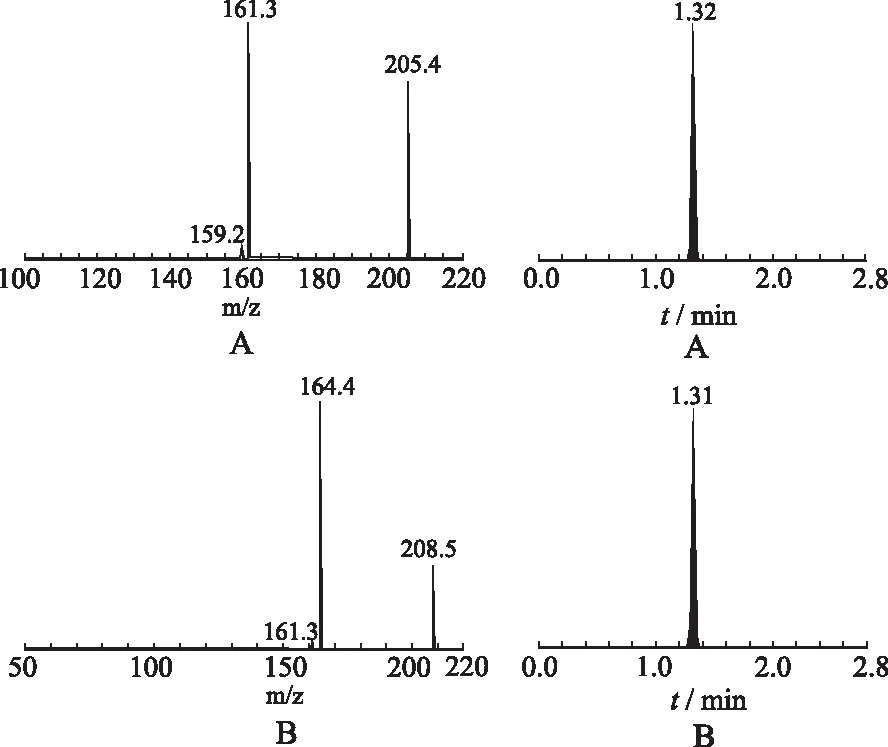
A.布洛芬;B.布洛芬-d3。
2.3.3布洛芬血漿樣品處理 精密轉移血漿樣品50.0 μL至96孔板中,加入300 ng·mL-1內標工作溶液50.0 μL,乙腈溶液400 μL,在搖板機上搖約5 min使充分混勻。在離心機中離心10 min(溫度4 ℃,3220×g);轉移上清液100 μL到一塊新的96孔板中,加入50%甲醇溶液100 μL,在搖板機上搖約5 min使充分混勻。在離心機中離心5 min(溫度4 ℃,3220×g),取5.0 μL進樣,進行LC-MS/MS分析,并記錄色譜圖。
2.3.4系統適用性 系統適用性評價樣品為6個系統適用性定量下限樣品,在每個分析批開始進樣前均進行系統適用性評價測試,以確認該儀器狀態。結果顯示分析物保留時間的RSD≤0.8%,內標保留時間的RSD≤0.9%,分析物與內標峰面積比的RSD≤6.5%,表明系統適用性良好。
2.3.5選擇性 不同來源的空白基質對分析物均無干擾;內標對分析物、分析物對內標的檢測無干擾,均符合接受標準。見圖2。
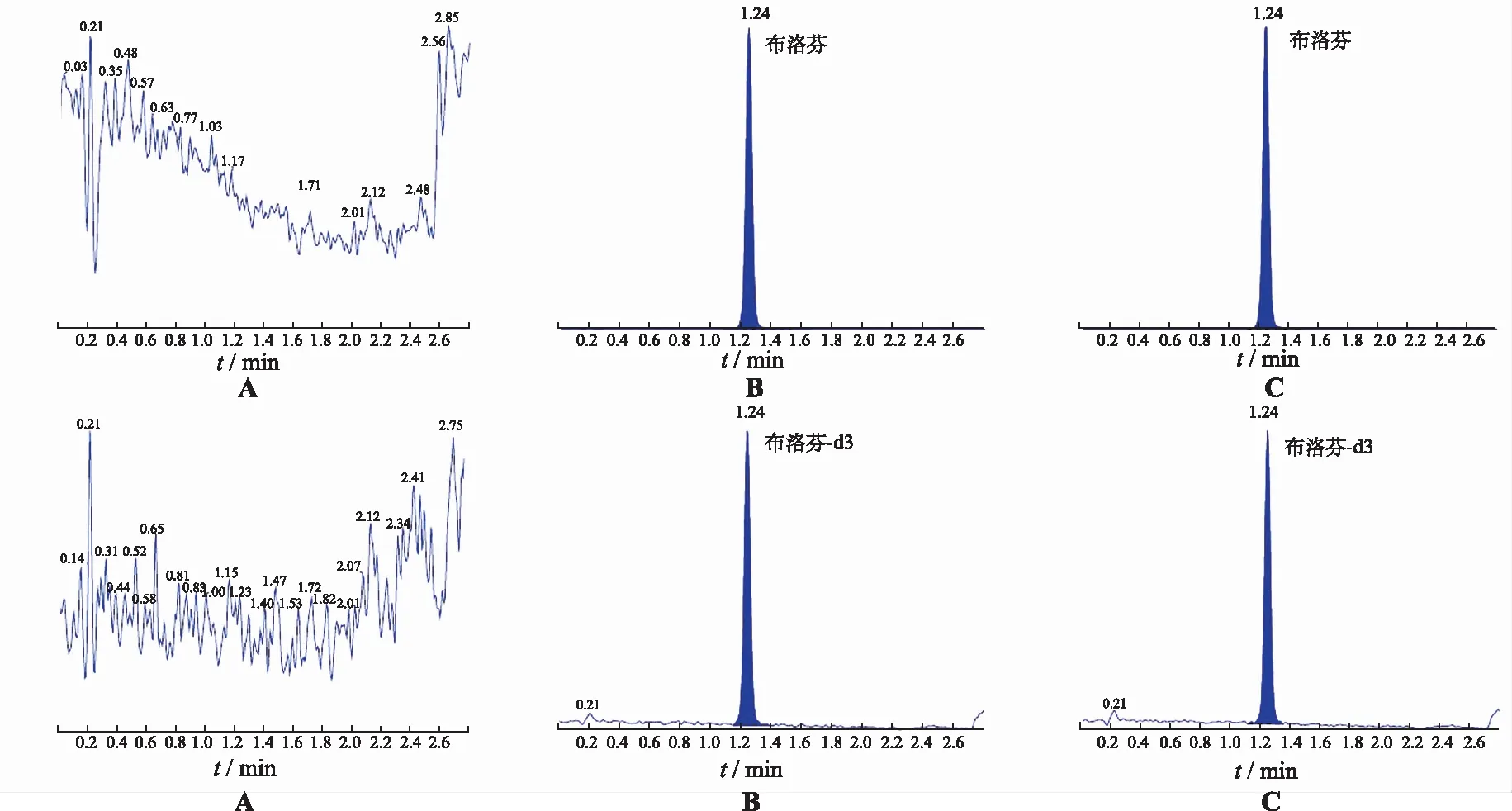
A.空白基質;B.標準樣品;C.受試者樣品。
2.3.6標準曲線與定量下限 在1.5 mL聚丙烯離心管中,用移液器加入適量空白人正常血漿。加入相應的源溶液,渦旋混勻(約30 s),配制成相應的校正標樣(濃度為50.0,100,400,2000,8000,16 000,20 000,25 000 ng·mL-1)。按樣本處理操作,以分析物(布洛芬)與內標(布洛芬-d3)的色譜峰面積比對分析物濃度(權重1/χ2)進行線性回歸,得回歸方程Y=0.002 452X+0.017 31,線性擬合度R2為0.995 1,線性范圍為50.0~25 000 ng·mL-1,定量下限50.0 ng·mL-1。
2.3.7殘留效應 在最高濃度的校正標樣后跟隨空白基質樣品來評價殘留效應。在分析物保留時間處干擾峰的響應均低于定量下限中分析物響應的20%,內標保留時間處干擾峰的響應均低于零濃度樣品中內標響應的5%。結果表明,最高濃度后面的空白基質樣品中布洛芬≤18.4%,布洛芬-d3≤1.0%,不影響定量。
2.3.8基質效應 在96孔板中加入空白單人血漿50.0 μL,按照血漿樣品處理過程處理,提取上清液后加入低、中、高濃度中間溶液(N-LQC,N-MQC,N-HQC)100 μL。中間溶液配制:精確量取LQC(150 ng·mL-1),MQC(12 500 ng·mL-1),HQC(22 500 ng·mL-1)工作液(精密稱取布洛芬10.40 mg,經質量校正后,溶于100%甲醇1020 μL,得到濃度為10.0 mg·mL-1的儲備液;分別量取適量儲備液,用50%甲醇稀釋得到相應濃度的工作液)20.0 μL和內標工作液混合400 μL,使用50%甲醇溶液3580 μL,分別稀釋獲得N-LQC,N-MQC,N-HQC中間溶液。使用生物基質相面積和溶劑相面積比較得到待測物和內標面積比,獲得歸一化基質效應因子。實驗結果顯示,布洛芬高、中、低3個濃度水平平均歸一化基質效應為1.00,1.01,1.00,表明無明顯基質效應。
2.3.9布洛芬精密度與準確度 配制定量下限、低、中和高4個濃度的質控樣品(分別為50.0,150,12 500,22 500 ng·mL-1),按血漿樣本處理操作,在3個分析批中,各濃度質控樣品均配制6個平行樣,評價本方法的精密度與準確度,結果見表1。
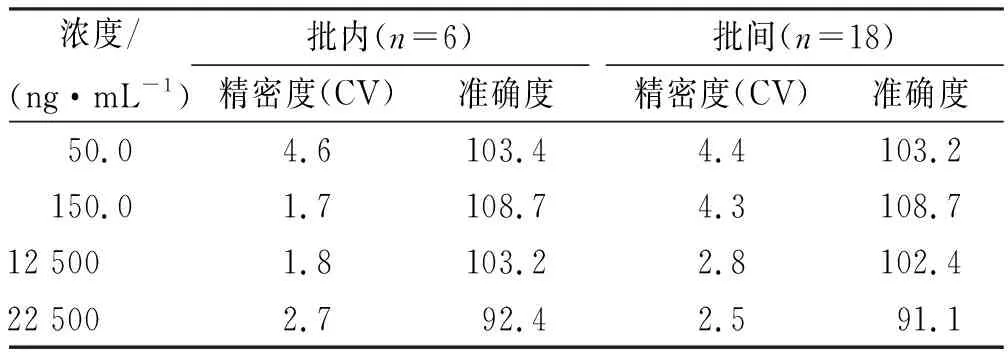
表1 布洛芬在人血漿中的精密度與準確度
2.3.10布洛芬的回收率 在96孔板中加入空白混合人血漿50.0 μL,按照樣品處理過程處理,提取上清液后,加入低、中、高中間溶液(N-LQC,N-MQC,N-HQC)100 μL和內標工作液400 μL混合,使用50%甲醇溶液3580 μL,分別稀釋獲得N-LQC,N-MQC,N-HQC中間溶液。使用提取后樣品峰面積和空白血漿提取的上清與中間溶液混合所得樣品的峰面積分別獲得待測物的回收率。結果顯示,低、中、高濃度的回收率分別為84.0%,84.2%,87.5%,表明回收率良好。
2.3.11穩定性 分別考察分析物儲備液在室溫條件下放置23.5 h穩定性(RSD≤2.8);分析物工作液在室溫條件下放置23.5 h穩定性(RSD≤4.3);全血中分析物在室溫(RSD≤4.3%)條件下放置2 h穩定性;血漿中分析物在室溫下放置26 h穩定性(RSD≤1.6%);處理過樣品在自動進樣器(6 ℃)下存儲26.7 h穩定性(RSD≤4.2%);血漿中分析物經過5次冷凍和融化循環后穩定性(RSD≤6.2%);血漿中分析物儲存在-20 ℃條件下107 d穩定性(RSD≤6.6%),在-80 ℃條件下107 d穩定性(RSD≤5.2%)。結果表明布洛芬的血漿樣品穩定性良好。
2.4生物樣本再分析ISR 本研究分析的樣品總數為1615個,其中177個樣品被選做已檢測樣品再分析(ISR),176樣品符合接受標準,通過率為99.4%。
2.5血藥濃度-時間曲線 空腹和餐后條件下各有24例健康受試者單劑量口服受試制劑和參比制劑,布洛芬血藥濃度-時間曲線見圖3。
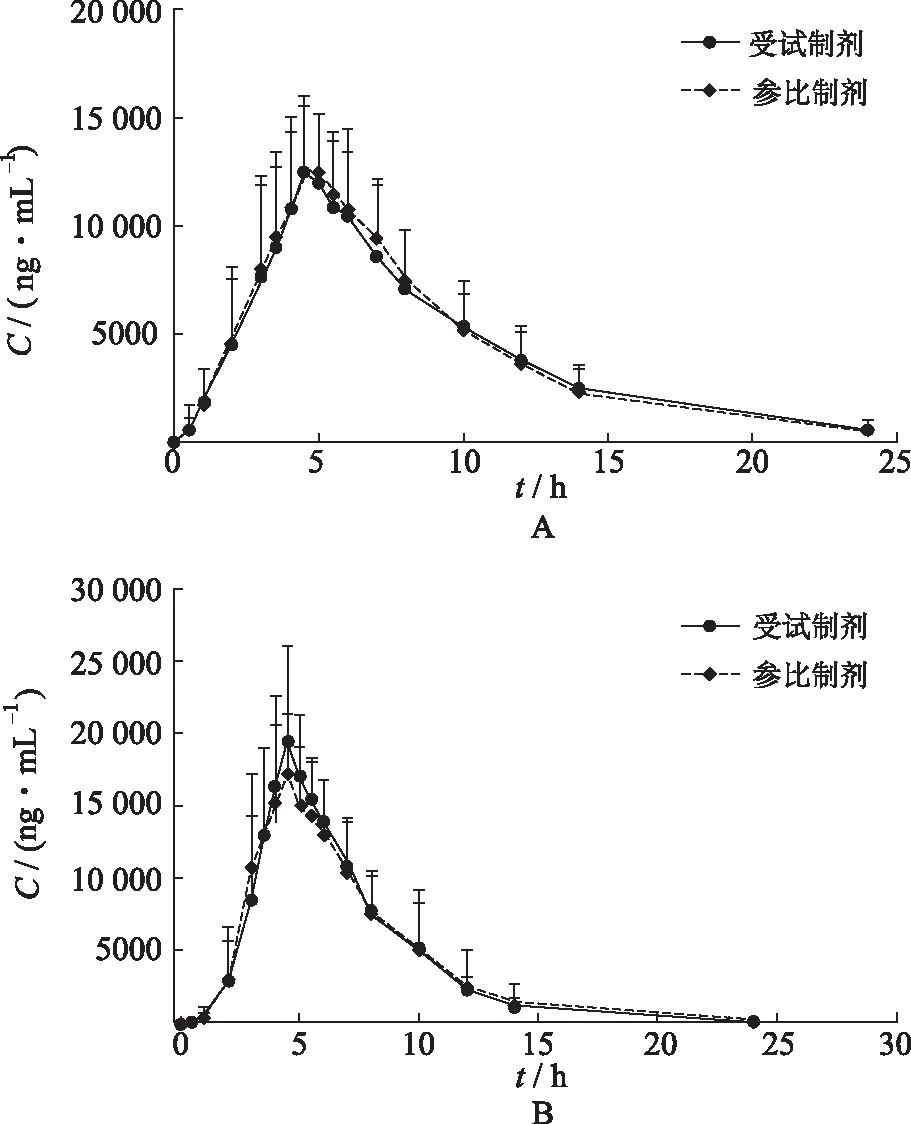
圖3 空腹(A)和餐后(B)口服受試制劑和參比制劑平均血藥濃度-時間曲線
2.6藥動學參數 健康受試者空腹或餐后口服受試制劑和參比制劑后的藥動學參數,見表2。

表2 健康受試者空腹和餐后條件下單次口服布洛芬緩釋膠囊后PK參數
2.7生物等效性評價 空腹狀態下,受試制劑和參比制劑給藥后平均血藥濃度-時間曲線高度相似,布洛芬tmax中位數均為4.5 h;在達到血藥濃度峰值后,藥物濃度下降,兩種制劑中布洛芬的t1/2基本一致,受試制劑中布洛芬t1/2為(4.32±1.92) h,參比制劑中布洛芬t1/2為(4.10±1.23) h;將對數轉換后的受試制劑和參比制劑的藥動學參數Cmax、AUC0-t、AUC0-∞進行方差分析,采用雙向單側t檢驗及(1-2α)置信區間法進行生物等效性評價。結果表明,空腹試驗中受試制劑與參比制劑主要藥動學參數Cmax、AUC0-t、AUC0-∞幾何均值比值的90%置信區間(CI)為(89.86%,102.08%),(94.05%,103.40%),(94.35%,104.72%)。
餐后狀態下,受試制劑和參比制劑給藥后平均血藥濃度-時間曲線高度相似,布洛芬tmax中位數均為4.5 h;在達到血藥濃度峰值之后,藥物濃度下降,兩種制劑中布洛芬的t1/2基本一致,受試制劑中布洛芬的t1/2為(2.97±0.34) h,參比制劑t1/2為(2.92±0.36) h;餐后試驗中受試制劑與參比制劑主要藥動學參數Cmax、AUC0-t、AUC0-∞幾何均值比值的90%CI為(97.43%,112.29%),(95.44%,103.59%),(95.32%,103.62%)。
在空腹與餐后條件下,受試制劑與參比制劑主要藥動學參數Cmax、AUC0-t、AUC0-∞幾何均數比值的90%CI均在(80.00%,125.00%),滿足生物等效性判定標準,表明健康成年受試者在空腹和餐后條件下單次口服受試制劑與參比制劑生物等效。
2.8安全性評價 空腹試驗中服用受試制劑階段發生不良事件6例次,受試者5例,發生率為20.8%(5/24),均為治療期間的不良事件;與研究藥物相關的不良事件6例次,受試者5例,發生率為20.8%(5/24);無導致退出試驗的不良事件發生;無嚴重不良事件發生。服用參比制劑階段不良事件發生11例次,受試者5例,發生率為20.8%(5/24),均為治療期間的不良事件;與研究藥物相關的不良事件6例次,受試者3例,發生率為12.5%(3/24);無導致退出試驗的不良事件發生;無嚴重不良事件發生。所有不良事件嚴重程度均為輕度,1例不良事件結局為緩解,其余均為消失。
餐后試驗中服用受試制劑階段不良事件4例次,受試者4例,發生率為17.4%(4/23),均為治療期間的不良事件;與研究藥物相關的不良事件2例次,受試者2例,發生率為8.7%(2/23);無導致退出試驗的不良事件發生;無嚴重不良事件發生。服用參比制劑階段不良事件3例次,受試者2例,發生率為8.3%(2/24),均為治療期間不良事件;與研究藥物相關的不良事件2例次,受試者2例,發生率為8.3%(2/24);無導致退出試驗的不良事件發生;無嚴重不良事件發生。所有不良事件嚴重程度均為輕度,所有不良事件的結局為消失。
3 討論
國內報道布洛芬的檢測方法多為HPLC法[3-4],服藥劑量多為每次600 mg,加大給藥劑量可能會增加胃腸道及其他不良反應的風險;本試驗受試者服藥劑量為300 mg,為臨床用藥提供可行的參考。本研究采用HPLC-MS/MS法測定人體血漿中布洛芬的濃度,該方法靈敏、準確可靠、快速簡便,適用于布洛芬的血藥濃度測定及其藥動學和生物利用度研究。布洛芬緩釋膠囊(芬必得?)藥動學參數已有較多報道,梁俊等[5]在健康男性受試者中開展生物等效性研究,給予芬必得?300 mg后藥動學參數分別為tmax:(4.9±1.1) h;Cmax:(13.6±5.8) μg·mL-1;AUC0-24:(95.9±45.2) μg·h·mL-1;AUC0-∞:(101.6±46.2) μg·h·mL-1。薛洪源等[6]開展單劑量及多劑量口服布洛芬緩釋膠囊的藥動學研究,給予芬必得?300 mg后藥動學參數分別為tmax:(4.85±0.67) h;Cmax:(16.86±4.30) μg·mL-1;AUC0-24:(109.11±21.79) μg·h·mL-1;AUC0-∞:(109.11±22.92) μg·h·mL-1。DAVIES等[7]在布洛芬的臨床藥動學中提出,受試者分別于空腹或餐后條件下服用布洛芬800 mg可溶性骨架緩釋片后,該制劑在藥時曲線中呈現多個峰濃度,第一個峰濃度從空腹時14 mg·L-1升高至餐后時20 mg·L-1,差異有統計學意義,但空腹及餐后AUC差異無統計學意義。考慮到布洛芬屬于BCSⅡ類藥物,水中溶解度較低,高脂食物可以促進藥物在胃腸道的溶解,因此藥物的吸收速度會加快。此外由于布洛芬的口服生物利用度較高,因此食物對于吸收程度(AUC)無明顯影響,試驗結果與文獻[5-7]報道較為一致。
安全性評價方面,口服受試制劑后不良事件為尿蛋白質定性弱陽性、總膽紅素偏高、大便潛血弱陽性等。口服參比制劑后不良事件為凝血酶原時間延長、總膽紅素偏高、大便潛血弱陽性、頭暈等。受試制劑與參比制劑均無嚴重不良事件發生,未發生因不良事件而中止試驗的情況。相較于既往文獻報道,無明顯差別[8]。本試驗安全性評價結果表明,給予布洛芬緩釋膠囊受試制劑與參比制劑300 mg后人體耐受性均良好,有較好的安全性,兩制劑的不良事件發生情況也類似。
綜上所述,布洛芬緩釋膠囊受試制劑與參比制劑具有生物等效性,本試驗結果可為我國布洛芬緩釋膠囊生物等效性和藥動學研究提供參考依據。

