丹參注射液與臨床常用輸液配伍的穩(wěn)定性研究
陳虹,郭昌貴,合雄,賴蕓,韓惟芳,孫榮飛,戴宇婷
1.云南省昭通市中醫(yī)醫(yī)院,云南昭通657000;2.云南省昭通市食品藥品檢驗(yàn)所,云南昭通657000
丹參注射液具有活血化瘀、通脈養(yǎng)心功效,主要用于治療冠心病心絞痛[1-2]、腦損傷[3-4]的治療,對肝損傷[5]、糖尿病[6]等也有一定的作用,是臨床上應(yīng)用較廣泛的中藥注射液之一。用法用量為肌內(nèi)注射,2~4 mL/次,1~2次/d;靜脈注射,4 mL/次,用50%葡萄糖注射液20 mL稀釋后使用,1~2次/d;靜脈滴注,10~20 mL/次,用5%葡萄糖注射液100~500 mL稀釋后使用,1次/d。隨著丹參注射液在臨床的廣泛應(yīng)用,不良反應(yīng)也隨之增加,有文章提到藥品不良反應(yīng)的發(fā)生可能與藥品使用不得當(dāng)有關(guān),其中就包括溶媒的選用[7]。因此該研究將考察丹參注射液與臨床常用輸液配伍后的穩(wěn)定性,分別從時(shí)間、溫度及光照對配伍液的外觀性狀、pH、不溶性微粒及對有效成分(丹參素鈉、原兒茶醛)含量的影響來探討丹參注射液的合理搭配與應(yīng)用,旨在為臨床安全、合理使用丹參注射液提供科學(xué)依據(jù)和用藥指導(dǎo)。現(xiàn)報(bào)道如下。
1 材料與方法
1.1 儀器
高效液相色譜儀(Agilent 1200型,安捷倫),電子天平(MS105 DU,瑞士梅特勒),超聲波清洗機(jī)(UC-7100S型,美瑞泰克),真空泵(AP-9925,天津奧特賽恩斯),雷磁pH計(jì)(PHS-3B型,上海精科),數(shù)顯鼓風(fēng)干燥箱(GZX-9246MBE型,上海博迅),冷藏展示柜(LG4-1000M3,廣州穗凌電器),微粒分析儀(GWF-8JA,天津天河醫(yī)療儀器),醫(yī)用凈化工作臺(YJ-1450DA,蘇州凈化設(shè)備廠)。
1.2 試藥
丹參注射液(四川升和藥業(yè),19021051,10 mL/支),丹參素鈉對照品(中國食品藥品檢定研究院,110855-201614,20 mg/支,含量以98.1%計(jì)),原兒茶醛對照品(中國食品藥品檢定研究院,110810-201608,20 mg/支,含量以99.3%計(jì)),5%GS(昆明南疆制藥,CD190205F,500 mL/瓶;AD190127C1,250 mL/瓶),0.9%NS(昆明南疆制藥,AD190208L2,250 mL/瓶),10%GS(昆 明 南 疆 制 藥,CD190203D,500 mL/瓶),5%GNS(昆 明 南 疆 制 藥,CD190407D,500 mL/瓶),轉(zhuǎn)化糖注射液(四川美大康佳樂藥業(yè),18091232,250 mL/袋),果糖注射液(江蘇正大豐海能,1711181,250 mL/瓶),乙腈(MERCK,JA070530,4 L/瓶),娃哈哈純凈水,其余試劑均為分析純。
1.3 方法
1.3.1 色譜條件 色譜柱:Agilent Eclipse Plus C-18色譜柱;流動相:乙腈-水-甲酸(12∶87∶1);流速:1.0 mL/min;柱溫:30℃;檢測波長:280 nm;進(jìn)樣量:10 μl。
1.3.2 系統(tǒng)適用性試驗(yàn) 在上述色譜條件下,注入丹參素鈉、原兒茶醛的混合對照品溶液10 μl,記錄色譜圖1,丹參素鈉、原兒茶醛對照品的保留時(shí)間分別為4.094、8.101 min,理論塔板數(shù)按原兒茶醛峰計(jì)算應(yīng)不低于3 000。
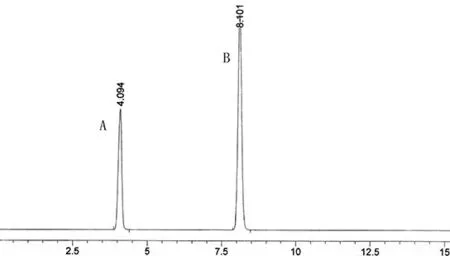
圖1 對照品色譜圖
1.3.3 對照品溶液的制備 精密稱取丹參素鈉、原兒茶醛對照品適量(41.59 mg,15.84 mg),分別置于50 mL容量瓶中,加流動相溶解稀釋至刻度,分別制得丹參素鈉對照品溶液(815.995 8 μg/mL)、原兒茶醛對照品溶液(314.582 4 μg/mL)。
1.3.4 供試品溶液的制備 精密量取丹參注射液5 mL,置于25 mL容量瓶中,加流動相稀釋并定容至刻度,用0.45 μm微孔濾膜過濾即得供試品溶液。
1.3.5 方法學(xué)驗(yàn)證①專屬性試驗(yàn)。分別取空白對照溶劑、對照品溶液及供試品溶液各10 μL,按照“2.1.1”項(xiàng)下色譜條件檢測,結(jié)果供試品溶液在相應(yīng)對照品溶液出峰處未見其他峰干擾,專屬性良好,結(jié)果見圖2、圖3、圖4。
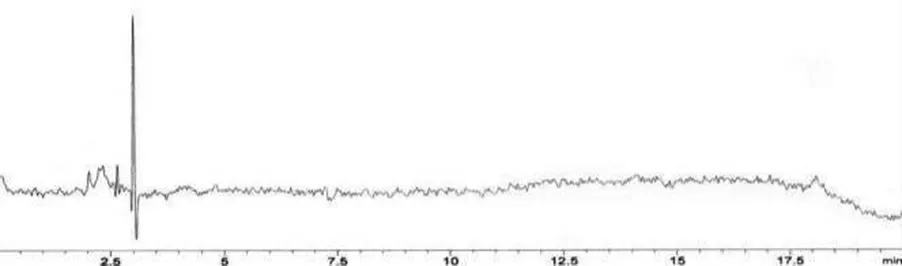
圖2 專屬性空白對照色譜圖
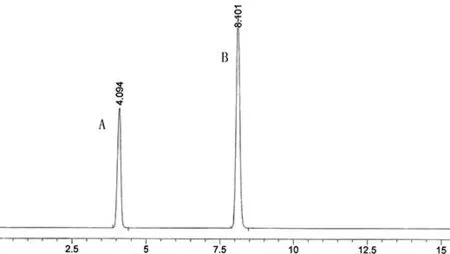
圖3 專屬性對照品色譜圖A為丹參素鈉B為原兒茶醛
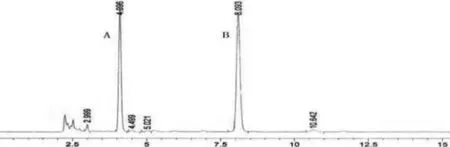
圖4 專屬性供試品色譜圖A丹參素鈉B原兒茶醛
②標(biāo)準(zhǔn)曲線的制備。分別精密量取丹參素鈉和原兒茶醛對照品溶液0.5、1、2、3、4、5 mL置于10 mL量瓶中,加流動相至刻度,搖勻,得系列質(zhì)量濃度的混合對照品溶液(丹參素鈉40.80、81.60、163.20、244.80、326.40、408.00 μg/mL、原兒茶醛15.73、31.46、62.92、94.38、125.84、157.30 μg/mL)。按“1.2.1”項(xiàng)下色譜條件,測定峰面積,以峰面積為縱坐標(biāo),質(zhì)量濃度為橫坐標(biāo),繪制標(biāo)準(zhǔn)曲線,得回歸方程丹參素鈉y=7.0792x-17.68(r=0.999 5),原兒茶醛y=34.24x+54.786(r=0.999 6)。結(jié)果表明,丹參素鈉、原兒茶醛分別在質(zhì)量濃度范圍40.80~408.00 μg/mL、15.73~157.30 μg/mL內(nèi),質(zhì)量濃度與峰面積線性關(guān)系良好。
③精密度試驗(yàn)。取“1.2.3”項(xiàng)下的混合對照品溶液10 μl,連續(xù)進(jìn)樣6次,記錄各色譜峰的峰面積,計(jì)算丹參素鈉、原兒茶醛峰面積的RSD分別為0.079%、0.156%,結(jié)果表明儀器精密度良好。
④重復(fù)性試驗(yàn)。取丹參注射液6支,各精密量取5 mL置于25 mL容量瓶中,加流動相稀釋定容至刻度,0.45 μm微孔濾膜過濾后,注入高效液相色譜儀測定并計(jì)算各成分含量,結(jié)果丹參素鈉、原兒茶醛的平均含量分別為975.96、277.45 μg/mL,RSD分別為0.723%、0.754%,結(jié)果表明該色譜條件下的含量測定方法重復(fù)性良好。
⑤回收率試驗(yàn)。精密量取已知含量的丹參注射液2.5 mL置于25 mL容量瓶中,分別加入丹參素鈉對照品溶液3 mL和原兒茶醛對照品溶液2.2 mL,加流動相定容至刻度,平行制備6份。按“1.2.1”項(xiàng)下色譜條件測定峰面積并計(jì)算丹參素鈉、原兒茶醛的平均回收率,分別為92.64%、89.60%,RSD分別為1.520%、1.470%。
1.4 成品輸液配伍穩(wěn)定性考察
模擬臨床用藥,參照說明書推薦溶媒和劑量,由同一操作人員在100級水平層流臺內(nèi),取丹參注射液加入5%GS中配成供臨床使用的最高濃度(20 mL→100 mL)和最低濃度(10 mL→500 mL)成品輸液,依次標(biāo)記為樣1、樣2。另分別取丹參注射液20 mL溶于非說明書推薦的溶媒(0.9%NS、10%GS、5%GNS、果糖注射液、轉(zhuǎn)化糖注射液)250 mL中,配成常規(guī)濃度的成品輸液,依次標(biāo)記為樣3、樣4、樣5、樣6和樣7。每份成品輸液分為6組,每組5份,分別編號并標(biāo)記為A1~A5,B1~B5,C1~C5,D1~D5,E1~E5,F(xiàn)1~F5。其中A、B、C組采取遮光措施,D、E、F組則在光照條件下,分別將A、D組置于常溫(10~30℃),B、E組置于高溫(35~37℃),C、F組置于低溫(4~8℃),于0、1、2、4、6、8 h觀察各組成品輸液外觀性狀,測定pH值及有效成分含量,于0、0.5、1、2、5、8 h進(jìn)行不溶性微粒檢測,并以隨行考察條件下相應(yīng)的輸液作空白對照。
2 結(jié)果
2.1 外觀與pH
分別取各組不同條件下的成品輸液適量,于0、1、2、4、6、8 h觀察上述成品輸液的澄明度、顏色及有無可見異物,并測定pH。結(jié)果顯示除5%GS高濃度配伍液的外觀呈棕色外,其余溶媒的成品輸液外觀呈淺棕色,溶液澄清,無可見異物。空白溶媒pH值:5%GS(250 mL)4.28、5%GS(500 mL)4.53、0.9%NS 5.76、10%GS 3.73、5%GNS 4.12、轉(zhuǎn)化糖注射液4.12、果糖注射液3.66。所有組別成品輸液8 h內(nèi)pH的RSD≤1%,說明時(shí)間、溫度及光照對丹參成品輸液pH的影響無明顯差別,具體pH變化范圍,見表1。
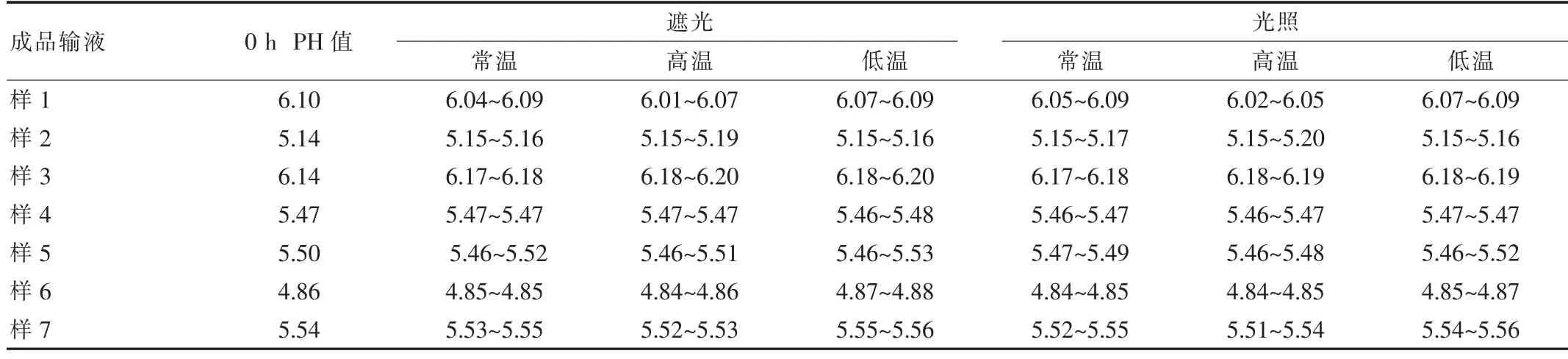
表1 丹參注射液與不同溶媒配伍后在不同條件下pH的變化范圍
2.2 不溶性微粒檢查
分別取各組不同考察條件下的成品輸液適量,于0、0.5、1、2、5、8 h時(shí),按中國藥典2015年版四部規(guī)定的不溶性微粒檢測法中的光阻法測定每毫升成品輸液中≥10 μm和≥25 μm的不溶性微粒數(shù),藥典規(guī)定標(biāo)示裝量為100 mL或100 mL以上的靜脈用注射液除另有規(guī)定外,每1 mL中含10 μm及10 μm以上的微粒數(shù)不得過25粒,含25 μm及25 μm以上的微粒數(shù)不得過3粒。結(jié)果顯示0 h時(shí)樣1~樣7中≥10 μm的微粒數(shù)分別為55.4、14.7、30.3、15.0、12.2、17.8、48.9;≥25 μm的不溶性微粒數(shù)分別為3.0、0.5、2.2、1.0、1.9、1.5、5.3。丹參注射液與5%GS的高濃度配伍液及與0.9%NS、轉(zhuǎn)化糖注射液的配伍液8 h內(nèi)的不溶性微粒均超標(biāo);與5%GS配伍的低濃度配伍液低溫光照2 h時(shí)不溶性微粒超標(biāo);與果糖的配伍液8 h內(nèi)的不溶性微粒均符合規(guī)定;與10%GS配伍的成品輸液常溫光照8 h的不溶性微粒超標(biāo);與5%GNS配伍的成品輸液,高溫光照下2 h后不溶性微粒超標(biāo),低溫條件下無論避光與否,0.5 h后不溶性微粒均超標(biāo)。雖然光照、溫度在不同溶媒中對成品輸液的影響無規(guī)律性,但實(shí)驗(yàn)結(jié)果表明在高溫、低溫條件下存放的成品輸液不溶性微粒更容易超出藥典規(guī)定。見表2。
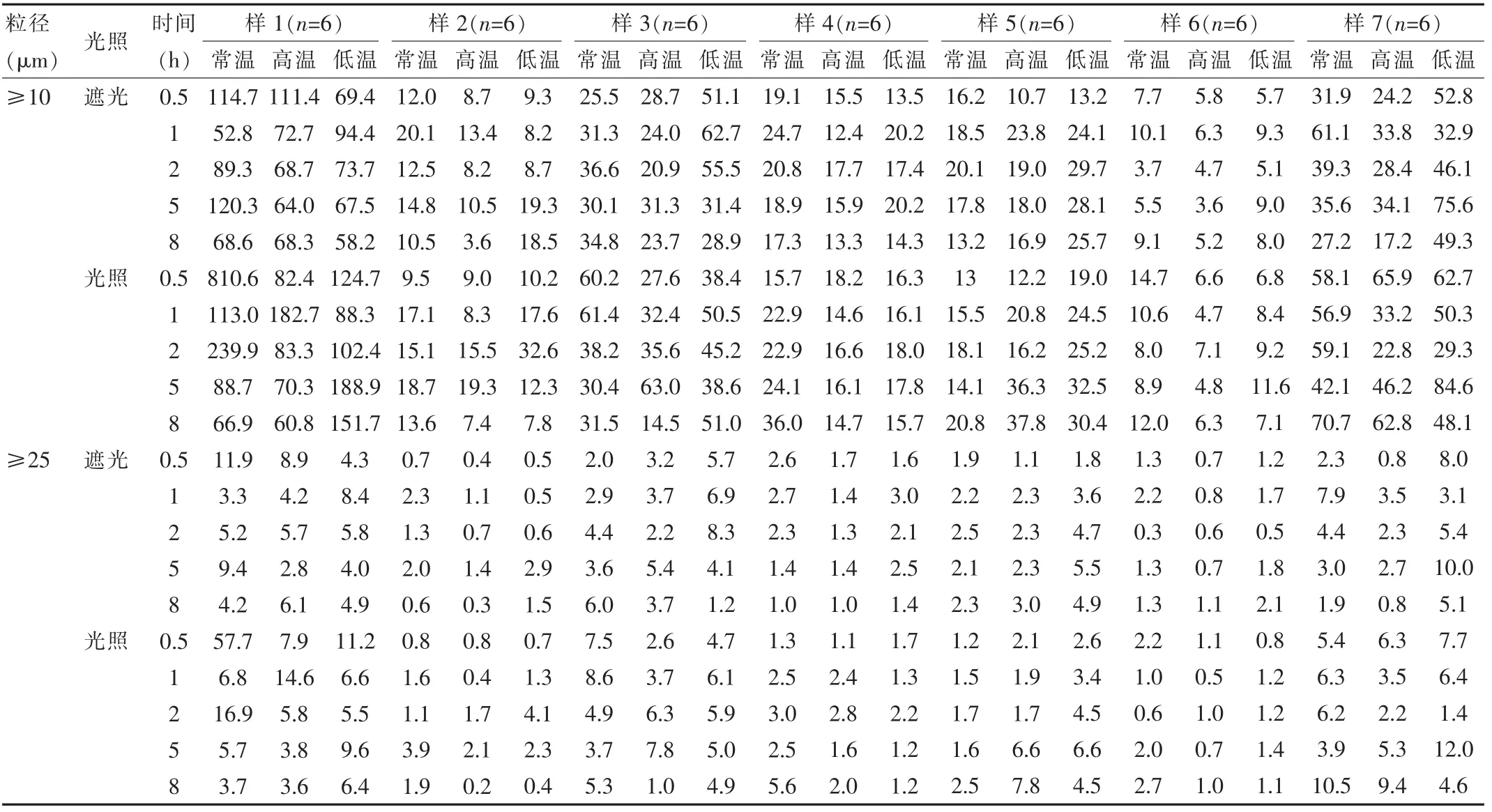
表2 丹參注射液與不同溶媒配伍后8 h內(nèi)不溶性微粒的變化(個/mL)
2.3 丹參素鈉與原兒茶醛在成品輸液中的含量變化
取“1.3”項(xiàng)下各組成品輸液于0、1、2、4、6、8 h按“1.2.1”項(xiàng)下色譜條件進(jìn)樣,測定丹參素鈉、原兒茶醛在各組成品輸液中的峰面積,分別以0 h的含量為100%換算其他時(shí)間點(diǎn)的含量。
結(jié)果表明:丹參注射液與6種溶媒配伍后8 h內(nèi)各條件下的丹參素鈉含量變化均較小,與5%GS配成的高濃度配伍液中原兒茶醛在常溫和高溫條件下含量下降較大,特別在高溫光照條件下8 h時(shí)原兒茶醛的含量下降了13.95%;低濃度丹參5%GS成品輸液及與其他溶媒配成的成品輸液8 h內(nèi)丹參素鈉、原兒茶醛的含量變化均在2%以內(nèi)。由此可推斷丹參注射液與5%GS的配伍液放置8 h,藥物濃度較高時(shí),溫度和光照可能會對有效成分含量產(chǎn)生一定影響,而藥物濃度較低時(shí)則無明顯影響,樣1、樣2結(jié)果,見表3。
3 討論
丹參注射液的說明書推薦溶媒為5%GS,有研究分析近年來國內(nèi)醫(yī)藥期刊公開發(fā)表的文獻(xiàn),總結(jié)發(fā)現(xiàn)丹參注射液可選10%GS、0.9%NS、5%GS做溶媒[8]。也有文獻(xiàn)稱丹參注射液合理配伍的條件為25℃、劑量20 mL與100 mL 0.9%NS配伍放置2 h,此條件下配伍液穩(wěn)定性較好,該實(shí)驗(yàn)中對丹參注射液與溶媒配伍后分別放置于4℃、25℃、35℃條件下4 h內(nèi)的有效成分含量進(jìn)行考察,發(fā)現(xiàn)4 h時(shí)6個樣品的丹參素鈉標(biāo)示百分含量之和分別為598.43、594.49和588.26(P<0.01),原兒茶醛含量分別為594.00、596.04和586.87(P<0.05),結(jié)果表明:導(dǎo)致丹參素鈉、原兒茶醛含量降低的是35℃以上溫度,25℃以下溫度對其幾乎無影響[9]。
該研究中丹參注射液20 mL與5%GS 100 mL配成高濃度的成品輸液后,不溶性微粒數(shù)超藥典標(biāo)準(zhǔn),而且在高溫光照條件下(36℃)放置時(shí),高溫光照組8 h原兒茶醛含量下降最大約14%,實(shí)驗(yàn)表明有效成分原兒茶醛的含量受高溫光照、常溫光照及低溫光照的影響由強(qiáng)至弱,而與其他溶媒的常規(guī)濃度、低濃度成品輸液中的原兒茶醛含量最大下降不超過3%,較穩(wěn)定,丹參素鈉含量幾乎無變化。由此可看出,高溫光照對丹參5%GS高濃度成品輸液有效成分含量有影響,推斷高溫和藥物濃度是影響丹參注射液中原兒茶醛含量的因素。對此,有研究對相關(guān)文獻(xiàn)進(jìn)行分析后建議在不影響療效的情況下,使用丹參注射液應(yīng)盡量選用0.048%(丹參藥材:g/mL)及以下的稀釋濃度,以免藥物濃度過大,發(fā)生不良反應(yīng)的風(fēng)險(xiǎn)增加[10]。
該研究中丹參注射液20 mL與250 mL 0.9%NS、轉(zhuǎn)化糖注射液配伍后不溶性微粒超過藥典標(biāo)準(zhǔn);丹參注射液20 mL與250 mL果糖注射液配伍后外觀和pH無明顯變化、不溶性微粒在藥典規(guī)定范圍內(nèi)、主要成分含量與0 h比較無明顯變化,配伍較穩(wěn)定。但有作者觀察到10 mL丹參注射液加入250 mL果糖注射液中,外觀、pH、不溶性微粒變化較小,而配伍2 h后紫外最大吸收波長變化顯著,穩(wěn)定性變差[11]。因此配伍時(shí),溶媒選擇應(yīng)慎重。最后,丹參注射液與5%GS配伍的低濃度成品輸液不溶性微粒在藥典范圍內(nèi),而高濃度成品輸液的不溶性微粒超標(biāo),說明不溶性微粒可能與丹參注射液的用量或藥物濃度有關(guān)。文中的實(shí)驗(yàn)結(jié)果與相關(guān)研究有相通之處,即藥物與溶媒配伍的不同濃度對不溶性微粒的變化有一定影響,藥物配伍不當(dāng)也會導(dǎo)致輸液中不溶性微粒的增加[12-14]。
綜上所述,在臨床實(shí)際應(yīng)用丹參注射液時(shí),不可隨意更改說明書推薦的溶媒或劑量,調(diào)配好的成品輸液應(yīng)盡量避免放置在高溫條件下,并應(yīng)注意遮光或避免日光直射,同時(shí)還應(yīng)注意避免因成品輸液藥物濃度過高、放置時(shí)間過長而導(dǎo)致成品輸液中的有效成分降低而無法達(dá)到預(yù)期療效或?qū)е滤幬锊涣挤磻?yīng)的發(fā)生。另外,成品輸液質(zhì)量中不溶性微粒是質(zhì)量評估的重要指標(biāo),不溶性微粒與調(diào)配環(huán)節(jié)中的輸液配伍、輸液操作、配置環(huán)境有關(guān),因此建議有條件的醫(yī)院將中藥注射劑等藥物在靜配中心集中調(diào)配后下送到臨床科室,以期輸液質(zhì)量能夠得到提升,保證患者用藥安全。

