高頻即時磁刺激對神經興奮性與 電壓門控鈉鉀離子通道的影響
朱海軍 尹曉楠 丁 沖 侯文濤 徐桂芝
(1. 省部共建電工裝備可靠性與智能化國家重點實驗室(河北工業大學) 天津 300130 2. 河北工業大學天津市生物電工與智能健康重點實驗室 天津 300130)
0 引言
經顱磁刺激(Transcranial Magnetic Stimulation, TMS)是一種非侵入性的無創腦刺激技術[1-2],其利用法拉第電磁感應定律的原理,通過線圈產生快速變化的脈沖磁場,磁場無衰減地穿透顱骨,在大腦皮層誘導產生感應電流[3-4]。因此,經顱磁刺激可以引起皮層神經興奮性的變化、重塑神經連接、誘導神經可塑性的改變等,實現神經調控的功能[5-6]。基于此,經顱磁刺激技術已經廣泛地應用于腦與認知神經方面的科學研究與臨床應用中,如阿爾茲海默癥、帕金森癥、抑郁癥等[7-8]。
TMS的作用效果取決于參數,如刺激強度、頻率、周期等[9-10]。一般研究規律表明,運動誘發電位的幅度隨著刺激強度與頻率的增加而增加[11-12],高頻(大于5Hz)TMS對大腦興奮起到促進作用,而低頻(小于或等于1Hz)則產生抑制作用[13]。臨床研究表明,90%閾值強度的長期高頻重復TMS可以提高輕至中度阿爾茲海默病患者的皮層興奮性,改善認知功能障礙[14]。長期高頻重復TMS可以增強健康成年個體皮層-海馬網絡區域的功能性連接,改善聯想記憶功能和認知過程[15]。動物實驗研究揭示,長期高頻TMS可有力激活神經可塑性關鍵分子通路,且在一定范圍內具有強度依賴性[16]。2.2T的長期高頻TMS可誘導或調節突觸可塑性[17]。1.26T的長期高頻TMS可以提高認知并調節海馬錐體神經元的興奮性[18]。盡管臨床應用與科學研究從不同方面對磁刺激的作用效果做了深入探究,但其激活或者抑制大腦興奮、調控神經的潛在機制尚不明確。
研究表明,鈉通道與鉀通道在調控神經興奮的過程中起著重要的作用,其中,電壓門控鈉通道(Voltage-Gated Sodium Channels, VGSCs)主要介導膜電位的去極化過程[19],電壓門控鉀通道(voltage- gated potassium channels, Kv)參與調控靜息電位[20]。本課題組前期的研究揭示了0.3T的長期高頻TMS可以顯著改善大腦老化過程中海馬齒狀回(Dentate Gyrus, DG)顆粒神經元興奮性的衰退[21],但缺乏對相關離子通道的潛在調控作用的研究。臨床報道經TMS作用后腦電波信號EEG發生即時性的跟隨改變,暗示TMS可以對神經活動進行瞬態調節[22]。同時也有動物實驗研究報道,神經元在即時磁刺激后神經活動發生改變。例如,急性大鼠腦切片在經過高頻磁刺激作用后,其皮層錐體神經元神經放電頻率增加,神經活動增強[23]。研究人員利用電壓敏感染料光學成像技術,記錄到即時高頻磁刺激改變了皮層神經元興奮與抑制的平衡狀態,且增加了皮層興奮性[24],離體坐骨神經元在磁刺激作用后,其神經放電幅值與興奮性增加[25],這些研究同樣暗示磁刺激具有即時效應。盡管如此,關于磁刺激即時效應的研究還很少,且對即時效應機制的探究并不充分[26]。結合前期的研究基礎、磁刺激對神經活動可能的瞬態調節作用以及其機制的不明確性,本文繼續采用高頻刺激,探究不同強度TMS在即時刺激的模式下,對急性小鼠腦切片DG顆粒神經元興奮性的影響,以及對電壓門控鈉鉀通道的潛在調控作用。探索TMS調控神經興奮的內在介導機制,并驗證TMS的調控作用是否具有強度依賴性。
1 材料與方法
1.1 急性腦切片的制備
所有動物實驗均獲得河北工業大學倫理委員會批準,且符合實驗動物使用規范。KM購自北京華阜康生物科技有限公司,動物飼養的環境溫度維持在(25±1)℃,濕度維持在50%~60%,食物與水供應充足,12h光照與黑暗交替循環。將小鼠用異氟烷深度麻醉后迅速斷頭取腦,將取出的大腦組織浸入氧飽和的低溫切片液中,冰浴2min后取出,用502膠水固定在切片槽中,使用德國徠卡VT1200S型號的振動切片機切成厚度為300μm的冠狀腦片。將腦片移入氧飽和的人工腦脊液中進行孵育,孵育溫度維持在30℃,時間為1h左右。切片液(mmol/L):KCl 2.5、CaCl21、MgCl26、NaH2PO21.625、NaHCO326、glucose 11、sucrose 220,NaOH調節pH至7.4。人工腦脊液(mmol/L):NaCl 124、KCl 3、CaCl22、MgCl22、NaH2PO41.625、NaHCO326、glucose 11、HEPES 5,NaOH調節pH至7.4。
1.2 腦片分組及磁刺激
實驗使用中國武漢依瑞德CCY-I型號的經顱磁刺激儀,線圈為Y064型號圓形動物刺激線圈,外徑56mm,內徑14mm。將腦片移置充滿氧飽外液的記錄槽(培養皿)中心,將線圈平行且緊貼記錄槽上方,線圈中心對準培養皿中心。每只小鼠的腦片依據有無刺激及刺激強度的不同分為對照組、0.3T刺激組、0.5T刺激組。施加的即時磁刺激頻率為20Hz,一個序列刺激的持續時間為5s,序列間隔為3s,序列個數5個,總刺激脈沖數500個。刺激完畢后立即對腦片進行膜片鉗實驗檢測,刺激方式如圖1所示。

圖1 腦片刺激示意圖 Fig.1 Schematic illustration of brain slice stimulation
1.3 膜片鉗電生理記錄
選取DG顆粒細胞作為目的神經元。采用全細胞電壓鉗模式,記錄激活、失活、恢復等不同過程下的電壓門控鈉電流INa(voltage-gated sodium current)、瞬時外向鉀電流IA(transient outward potassium current)、延遲整流鉀電流IK(delayed rectifier potassium current)。采用全細胞電流鉗模式,記錄靜息膜電位(Resting Membrane Potential, RMP)、80pA去極化電流下的單個誘發動作電位(Action Potential, AP)及500ms內AP長時程放電。
INa記錄外液(mmol/L):NaCl 130、KCl 3、CaCl22、MgCl22、glucose 10、HEPES 10、TEA-Cl 25、4-AP 3、CdCl20.2,KOH調節pH至7.4。INa記錄電極內液(mmol/L):CsCl 140、MgCl22、EGTA 10、HEPES 10、Mg-ATP 2,CsOH調節pH至7.2。鉀電流記錄外液(mmol/L):NaCl 130、KCl 5、CaCl22、MgCl21、glucose 10、HEPES 10、TTX 0.001、CdCl20.2,記錄IA時加入終濃度為25的TEA-Cl,記錄IK時加入終濃度為3的4-AP,NaOH調節pH至7.4。IA與IK記錄電極內液(mmol/L):KCl 140、MgCl22、EGTA 10、HEPES 10、Mg-ATP 2,KOH調節pH至7.2。AP記錄外液為人工腦脊液。AP記錄內液(mmol/L):K-gluconate 125、NaCl 15、MgCl22、CaCl21、EGTA 11、HEPES 10、Na-ATP 3、Na-GTP 0.3,KOH調節pH至7.2。
1.4 通道電流I-V、激活、失活及恢復曲線的繪制
I-V曲線:以不同電壓下的峰電流為縱坐標,以膜電位為橫坐標,繪制I-V曲線。激活曲線:首先利用式(1)將電流值轉化為電導值,以歸一化電導值(G/Gmax)為縱坐標,膜電位為橫坐標繪制激活散點圖;其次用式(2)Boltzmann方程對散點圖進行擬合,失活曲線:以歸一化的測試脈沖電流峰值(I/Imax)為縱坐標,膜電位為橫坐標繪制失活散點圖;然后用式(3)Boltzmann方程對散點圖進行擬合。恢復曲線:以測試脈沖記錄的峰電流與條件脈沖記錄的峰電流比值為縱坐標,以間隔時程為橫坐標繪制散點圖,所得散點圖用式(4)單指數方程進行擬合。

式中,G為電導;Vm為膜電位;Vr為反轉電位。
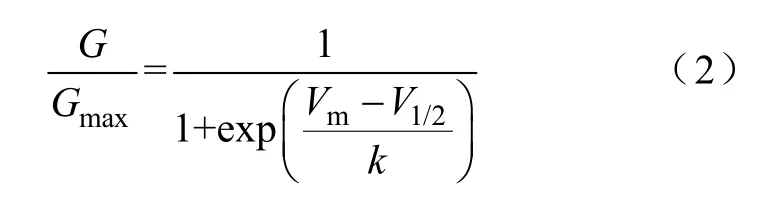
式中,V1/2為半數激活電壓;k為斜率因子。
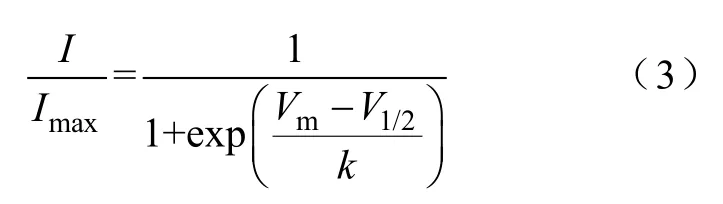
式中,I為每條測試脈沖下的電流峰值;Imax為所有電流峰值中的最大值。
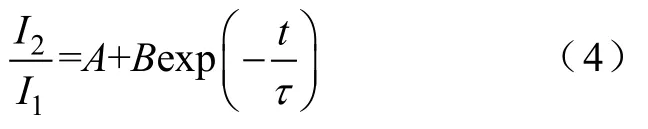
式中,I2為測試脈沖峰電流;I1為條件脈沖峰電流;A、B為常數;t為時間間隔;τ為恢復時間常數。
1.5 數據分析方法
數據分析采用單因素方差(one-way Analysis of Variance, one-way ANOVA)分析方法,強度為主因素。事后分析即組別之間的多重比較采用Turkey- test矯正下的成對t檢驗分析方法。數據分析軟件采用Origin 2017及GraphPad Prism 6。統計結果以mean±SEM呈現,檢驗水準為0.05。
2 數據分析結果
2.1 磁刺激對電壓門控鈉通道的影響
2.1.1 磁刺激對INa幅值的影響
不同強度磁刺激對INa幅值的影響如圖2所示。如圖2a所示,電壓鉗制在?70mV,給予細胞?80~+70mV的階梯去極化脈沖刺激,步階為10mV,波寬20ms,記錄到快速激活與快速失活的內向電流。繪制INa的I-V曲線如圖2b所示。統計分析結果表明,0.3T與0.5T強度的磁刺激均顯著增加了INa幅值,且0.5T磁刺激對INa的激活程度顯著高于0.3T。同時,從INa的I-V曲線中可以看出,相較于對照與0.3T的磁刺激,0.5T磁刺激改變了引出INa最大峰值的電壓,從?30mV變為?20mV,暗示不同強度磁刺激影響了電壓門控鈉通道激活狀態。
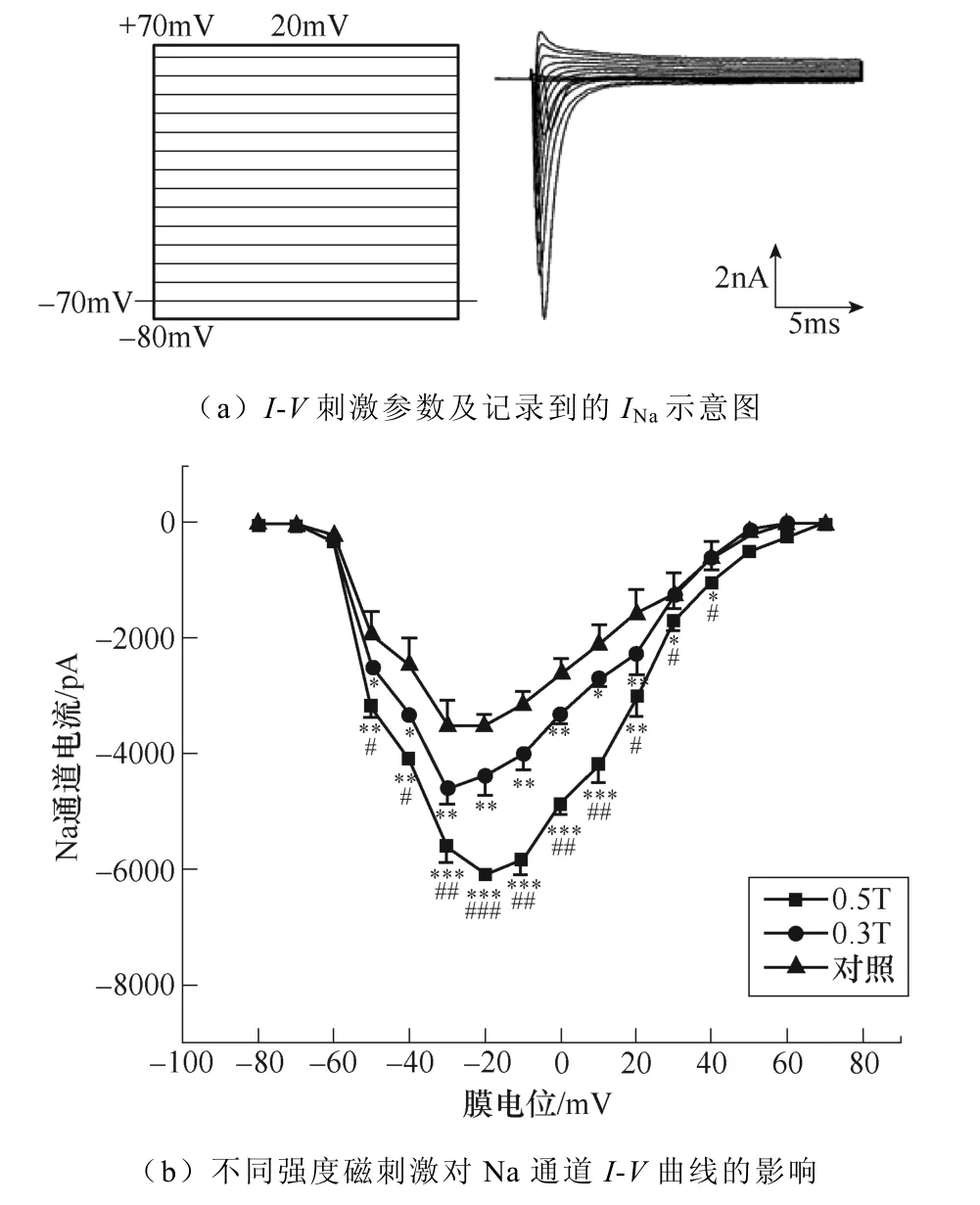
圖2 不同強度磁刺激對INa幅值的影響 (*P<0.05,**P<0.01,***P<0.001 vs對照;#P<0.05,##P<0.01,###P<0.001 vs 0.3T) Fig.2 The effect of different intensity magnetic stimulation on the amplitude of INa(*P<0.05, **P<0.01, ***P<0.001 vs control; #P<0.05,##P<0.01, ###P<0.001 vs 0.3T)
2.1.2 磁刺激對INa激活動力學的影響
不同強度磁刺激對INa激活過程的影響如圖3所示。如圖3a所示,電壓鉗制在?70mV,先施加?120mV波寬60ms的條件脈沖,隨后給予細胞?90~+10mV的階梯去極化測試脈沖刺激,步階為10mV波寬20ms,通過雙脈沖刺激記錄得到INa的穩態激活過程。繪制INa激活曲線如圖3b所示,隨著磁刺激強度的增加,INa激活曲線逐漸向左移動,同時V1/2發生了相應的改變,對照組為(?34.08± 0.39)mV,0.3T刺激組為(?36.64±0.57)mV,0.5T刺激組為(?43.39±0.60)mV(**P<0.01 vs對照;#P<0.05 vs 0.3T)。k值變化無顯著性差異。INa激活曲線詳細參數見表1。
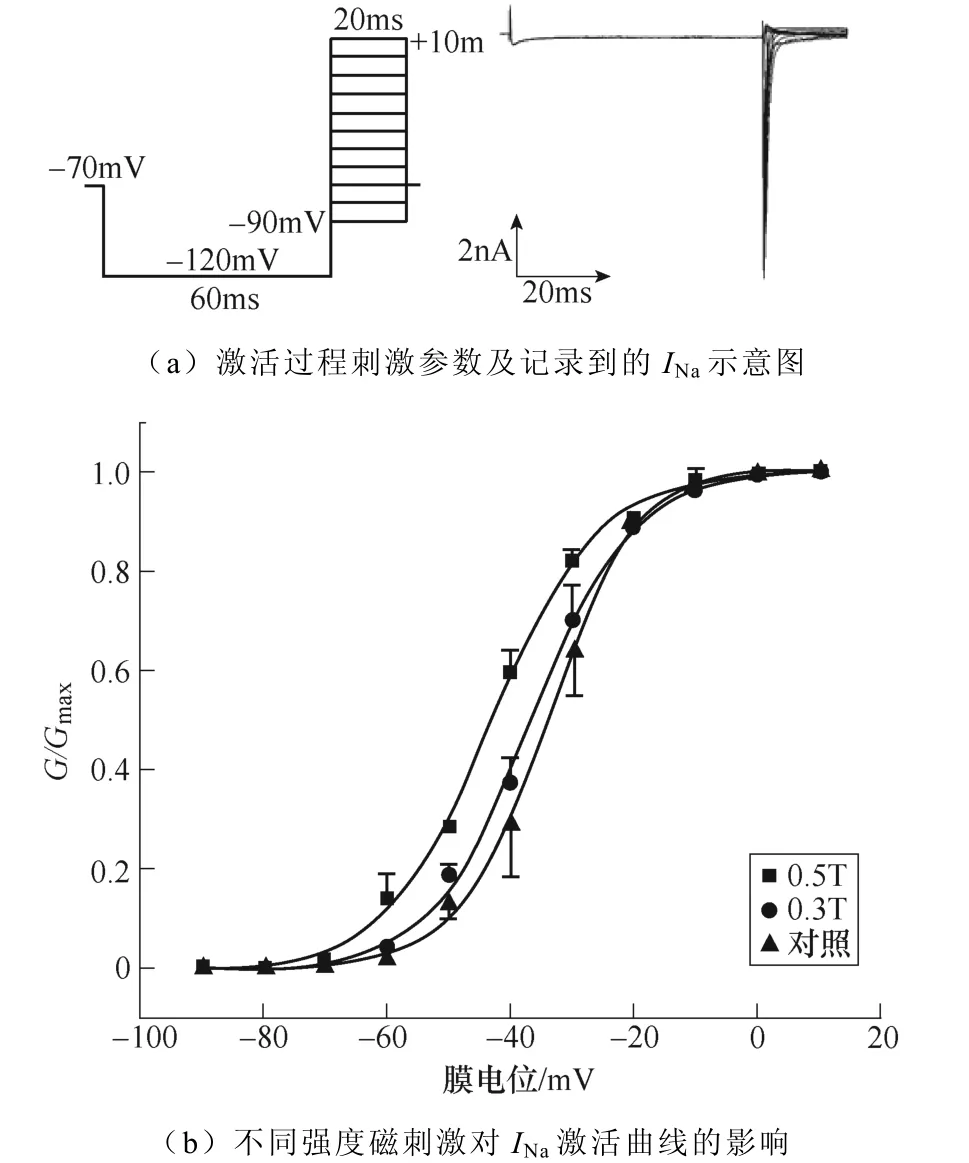
圖3 不同強度磁刺激對INa激活過程的影響 Fig.3 The effect of different intensity magnetic stimulation on the activation process of INa

表1 不同強度磁刺激對INa激活曲線參數的影響 (*P<0.05,**P<0.01 vs對照) Tab.1 The effect of different intensity magnetic stimulation on the activation parameters of INa(*P<0.05, **P<0.01 vs control)
2.1.3 磁刺激對INa失活動力學的影響
不同強度磁刺激對INa失活過程的影響如圖4所示。如圖4a所示,電壓鉗制在?70mV,先給予細胞?100~+10mV的階梯去極化條件脈沖,步階為10mV波寬100ms,隨后施加?30mV波寬20ms的測試脈沖,通過雙脈沖刺激記錄得到INa的穩態失活過程。繪制INa失活曲線如圖4b所示,INa失活曲線發生了磁刺激強度依賴性右移,同時V1/2發生了相應的改變,對照組為(?52.42±1.15)mV,0.3T刺激組為(?48.52±0.75)mV(*P<0.05 vs對照),0.5T刺激組為(?44.95±0.72)mV(**P<0.01 vs對照;#P<0.05 vs 0.3T)。0.5T刺激組的k值與對照組相比顯著降低(*P<0.05),k值降低表明,0.5T刺激組失活曲線的斜率增大,通道失活更快。INa失活曲線詳細參數見表2。
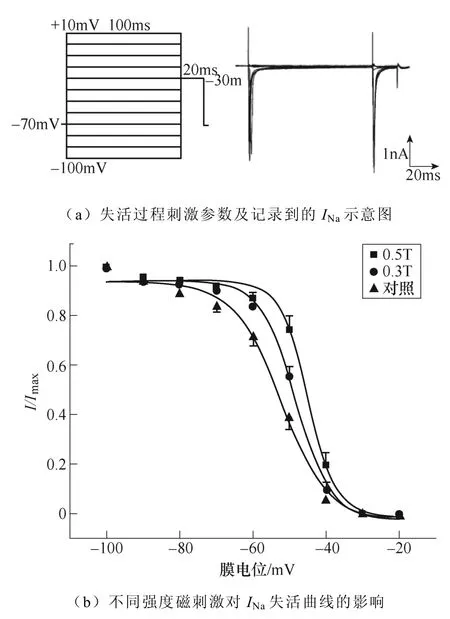
圖4 不同強度磁刺激對INa失活過程的影響 Fig.4 The effect of different intensity magnetic stimulation on the inactivation process of INa

表2 不同強度磁刺激對INa失活及恢復曲線參數的影響(*P<0.05,**P<0.01 vs對照;#P<0.05 vs 0.3T) Tab.2 The effect of different intensity magnetic stimulation on the inactivation and recovery parameters of INa (*P<0.05, **P<0.01 vs control; #P<0.05 vs 0.3T)
2.1.4 磁刺激對INa恢復動力學的影響
不同強度磁刺激對INa恢復過程的影響如圖5所示。如圖5a所示,電壓鉗制在?70mV,給予細胞?30mV波寬25ms的兩個相同的條件脈沖與測試脈沖。條件脈沖與測試脈沖兩個刺激間隔保持鉗制電位?70mV,間隔時程2~26ms,每2ms遞增,記錄得到INa失活后再恢復的過程。繪制INa恢復曲線如圖5b所示,INa恢復曲線發生了磁刺激強度依賴性左移,對曲線τ值的統計學分析表明,0.3T刺激組(**P<0.01)與0.5T刺激組(**P<0.01)的恢復時間相比對照組顯著縮短。INa恢復曲線詳細參數見表2。

圖5 不同強度磁刺激對INa恢復過程的影響 Fig.5 The effect of different intensity magnetic stimulation on the recovery process of INa
2.2 磁刺激對瞬時外向鉀通道的影響
2.2.1 磁刺激對IA幅值的影響
不同強度磁刺激對IA幅值的影響如圖6所示。如圖6a所示,電壓鉗制在?100mV,給予細胞?50~+90mV的階梯去極化脈沖刺激,步階為10mV,波寬200ms,記錄到外向電流。繪制IA的I-V曲線如圖6b所示,磁刺激強度依賴性地抑制了IA的峰電流。
2.2.2 磁刺激對IA激活動力學的影響
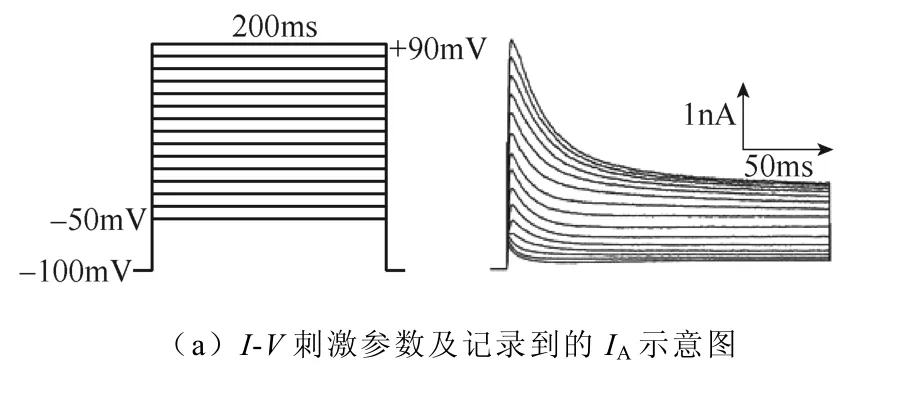
不同強度磁刺激對IA激活過程的影響如圖7所示。如圖7a所示,電壓鉗制在?100mV,先施加?110mV波寬400ms的條件脈沖,隨后給予細胞?50~+90mV的階梯去極化測試脈沖刺激,步階為 10mV波寬150ms,通過雙脈沖刺激記錄得到IA的穩態激活過程。繪制IA激活曲線如圖7b所示,激活曲線沒有發生偏移,對IA激活曲線參數的統計學分析表明,V1/2與k沒有顯著性差異。IA激活曲線詳細參數見表3。
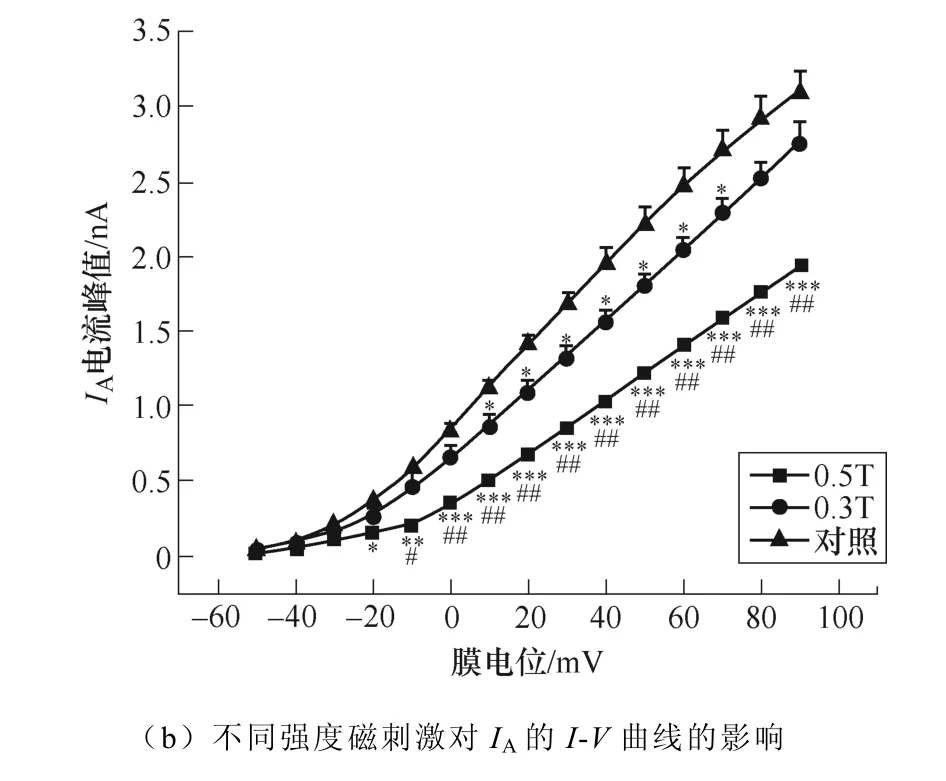
圖6 不同強度磁刺激對IA幅值的影響 (*P<0.05,**P<0.01,***P<0.001 vs對照;#P<0.05,##P<0.01 vs 0.3T) Fig.6 The effect of different intensity magnetic stimulation on the amplitude of IA (*P<0.05, **P<0.01, ***P<0.001 vs control; #P<0.05, ##P<0.01 vs 0.3T)

圖7 不同強度磁刺激對IA激活過程的影響 Fig.7 The effect of different intensity magnetic stimulation on the activation process of IA

表3 不同強度磁刺激對IA激活曲線參數的影響 Tab.3 The effect of different intensity magnetic stimulation on the activation parameters of IA
2.2.3 磁刺激對IA失活動力學的影響
不同強度磁刺激對IA失活過程的影響如圖8所示。如圖8a所示,電壓鉗制在?100mV,先給予細胞?110~+10mV的階梯去極化條件脈沖,步階為10mV波寬80ms,隨后施加+50mV波寬80ms的測試脈沖,通過雙脈沖刺激記錄得到IA的穩態失活過程。繪制IA失活曲線如圖8b所示,失活曲線發生了磁刺激強度依賴性左移,同時V1/2發生了相應的改變,對照組為(?44.44±0.47)mV,0.3T刺激組為(?49.41±0.33)mV(*P<0.05 vs對照),0.5T刺激組為(?55.66±0.34)mV(***P<0.001 vs對照;#P<0.05 vs 0.3T)。k值變化無顯著性差異。IA失活曲線詳細參數見表4。
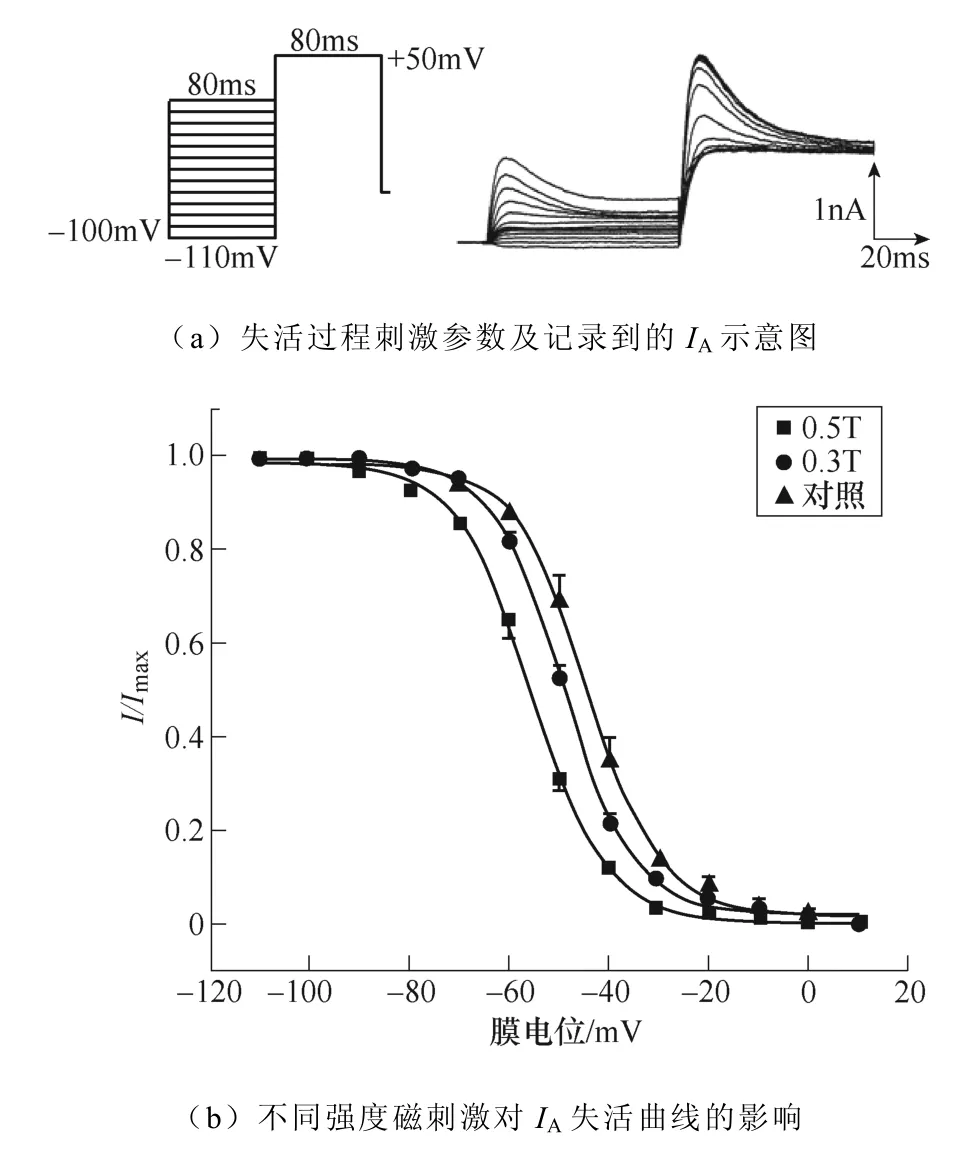
圖8 不同強度磁刺激對IA失活過程的影響 Fig.8 The effect of different intensity magnetic stimulation on the inactivation process of IA

表4 不同強度磁刺激對IA失活及恢復曲線參數的影響(*P<0.05,**P<0.01,**P<0.001 vs對照; #P<0.05 vs 0.3T) Tab.4 The effect of different intensity magnetic stimulation on the inactivation and recovery parameters of IA (*P<0.05, **P<0.01, ***P<0.001 vs control; #P<0.05 vs 0.3T)
2.2.4 磁刺激對IA恢復動力學的影響
不同強度磁刺激對IA恢復過程的影響如圖9所示。如圖9a所示,電壓鉗制在?100mV,給予細胞+50mV波寬80ms的兩個相同的條件脈沖與測試脈沖。條件脈沖與測試脈沖兩個刺激間隔保持鉗制電位?100mV,間隔時程1~256ms,記錄得到IA失活后再恢復的過程。繪制IA恢復曲線如圖9b所示,0.5T刺激組恢復曲線顯著右移,對曲線τ值的統計學分析表明,0.5T刺激組(**P<0.01 vs對照;#P<0.05 vs 0.3T)的恢復時間相比對照組和0.3T刺激組顯著延長。IA恢復曲線詳細參數見表4。
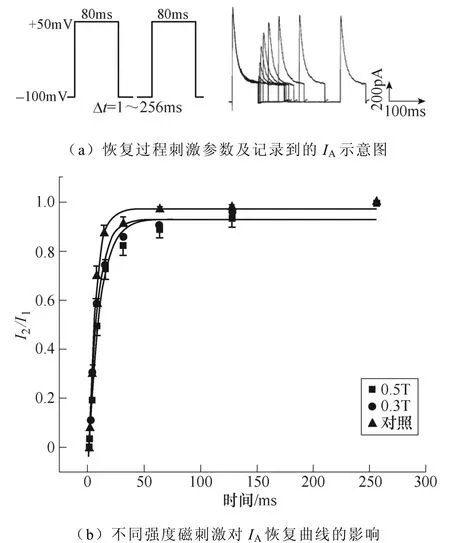
圖9 不同強度磁刺激對IA恢復過程的影響 Fig.9 The effect of different intensity magnetic stimulation on the recovery process of IA
2.3 磁刺激對延遲整流鉀通道的影響
2.3.1 磁刺激對IK幅值的影響
不同強度磁刺激對IK幅值的影響如圖10所示。如圖10a所示,電壓鉗制在?50mV,給予細胞?50~+90mV的階梯去極化脈沖刺激,步階為10mV,波寬300ms,記錄到外向電流。繪制IK的I-V曲線如圖10b所示,磁刺激強度依賴性地抑制了IK的峰電流。
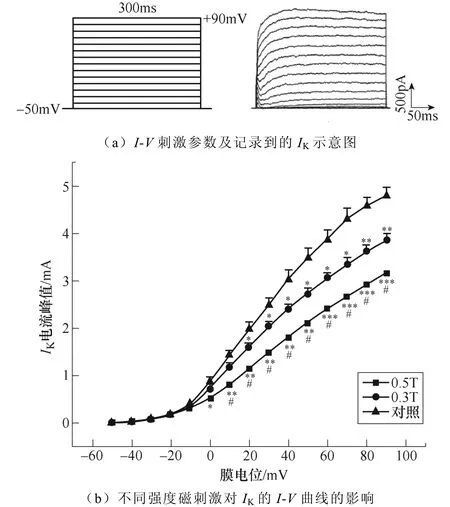
圖10 不同強度磁刺激對IK幅值的影響(*P<0.05, **P<0.01,***P<0.001 vs對照;#P<0.05 vs 0.3T) Fig.10 The effect of different intensity magnetic stimulation on the amplitude of IK (*P<0.05, **P<0.01, ***P<0.001 vs control; #P<0.05 vs 0.3T)
2.3.2 磁刺激對IK激活動力學的影響
不同強度磁刺激對IK激活過程的影響如圖11所示。如圖11a所示,電壓鉗制在?50mV,先施加?110mV波寬400ms的條件脈沖,隨后給予細胞?50~+90mV的階梯去極化測試脈沖刺激,步階為10mV波寬150ms,通過雙脈沖刺激記錄得到IK的穩態激活過程。繪制IK激活曲線如圖11b所示,0.5T刺激組激活曲線明顯左移,V1/2也發生了相應變化,對照組為(7.07±0.58)mV,0.3T刺激組為(5.12±0.59)mV,0.5T刺激組為(2.58±0.66)mV(*P<0.05 vs對照)。k值變化無顯著性差異。IK激活曲線詳細參數見表5。
2.4 磁刺激對DG顆粒細胞神經興奮性的影響
在全細胞電流鉗模式下,記錄了DG顆粒細胞的靜息膜電位、長時程放電、單個誘發AP,并對AP 相關特征指標進行分析,如AP發放閾值、峰值、達峰時間、上升支最大斜率、半波寬、后超極化幅度。
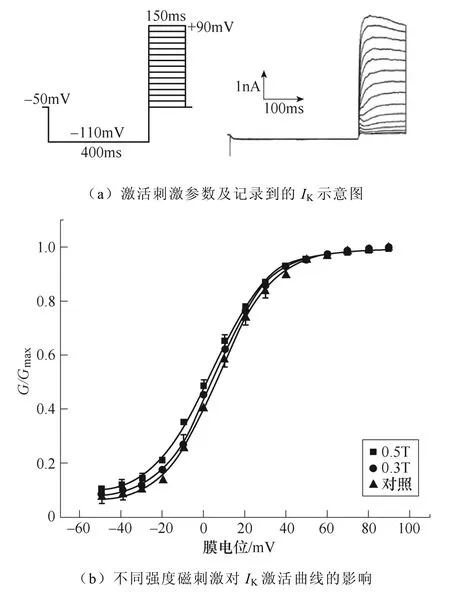
圖11 不同強度磁刺激對IK激活過程的影響 Fig.11 The effect of different intensity magnetic stimulation on the activation process of IK

表5 不同強度磁刺激對IK激活曲線參數的影響 (*P<0.05 vs對照) Tab.5 The effect of different intensity magnetic stimulation on the activation parameters of IK(*P<0.05 vs control)
不同強度磁刺激對膜電位及動作電位的影響如圖12所示。如圖12a所示,0.3T(**P<0.01)與0.5T(***P<0.001)刺激組靜息膜電位顯著高于對照組,0.5T刺激組顯著高于0.3T刺激組(*P<0.05)。如圖12b所示,對神經元500ms內長時程放電的分析表明,0.3T(**P<0.01)與0.5T(***P<0.001)刺激組放電個數顯著高于對照組,0.5T刺激組顯著高于0.3T刺激組(*P<0.05)。如圖12c所示,與對照組相比,0.3T(**P<0.01)與0.5T(***P<0.001)磁刺激顯著降低了AP發放的閾值電位,且0.5T刺激組的閾值電位比0.3T刺激組更低(*P<0.05)。如圖12d所示,0.3T(**P<0.01)刺激組與0.5T(***P<0.001)刺激組的AP峰值顯著高于對照組,且0.5T刺激組顯著高于0.3T刺激組(**P<0.01)。如圖12e所示,與對照組相比,0.3T(**P<0.01)與0.5T(***P<0.001)磁刺激顯著縮短了AP達峰時間。如圖12f所示,與對照組相比,0.3T(*P<0.05)與0.5T(***P<0.001)磁刺激顯著增加了AP最大上升斜率。如圖12g所示,0.3T(**P<0.01)與0.5T(***P<0.001)刺激組的半波寬與對照組相比顯著縮短,且0.5T刺激組比0.3T刺激組更短(***P<0.001)。如圖12h所示,與對照組相比,0.3T(***P<0.001)與0.5T(***P<0.001)磁刺激顯著降低了AP的后超極化幅度。

圖12 不同強度磁刺激對膜電位及動作電位的影響 (*P<0.05,**P<0.01,***P<0.001) Fig.12 The effect of different intensity magnetic stimulation on the membrane potential and action potential (*P<0.05, **P<0.01, ***P<0.01)
3 討論
本研究采用即時刺激的方式將不同強度的高頻磁刺激施加于小鼠急性大腦切片,分析了VGSCs與Kv通道激活、失活、恢復不同過程下的通道電流與DG顆粒細胞神經興奮性的變化。
諸多證據表明,VGSCs介導AP的去極化相位與神經興奮性,Kv參與設置靜息膜電位及調控細胞興奮性[19-20,27-33]。實驗結果顯示,在TMS對VGSCs影響的分析中,INa的半數激活電壓V1/2由大變小,激活曲線明顯左移,即VGSCs的激活可以發生在膜電位更低處。INa半數失活電壓V1/2在TMS作用下由小變大,失活曲線明顯右移,VGSCs失活向著膜電位去極化的方向移動,整個激活過程更持久。同時,INa的恢復曲線明顯左移,恢復時間常數τ顯著縮短。VGSCs通道動力學特征的這些變化加速了Na+內流激活了INa,且TMS對VGSCs的調控作用隨著刺激強度的增強而增強。在TMS對Kv影響的分析中,結果顯示IK的半數激活電壓V1/2在TMS作用下由大變小,激活曲線明顯左移。IA激活曲線無顯著變化,IA半數失活電壓V1/2在TMS作用下由大變小,失活曲線明顯左移。Kv通道較早且快速的失活說明TMS阻止了膜電位向著超極化方向移動,提升了膜電位靜息態水平。同時,IA的恢復曲線明顯右移,恢復時間常數τ顯著延長。Kv通道動力學特征的這些變化阻止了K+外流,抑制了IA與IK,且TMS對Kv的調控作用隨著刺激強度的增強而增強。INa的激活、IA與IK的抑制共同促進了神經興奮性的增強。同樣,有研究發現TMS可以提高CA1椎體神經元興奮性,同時激活了INa抑制了IA[34]。皮層神經元在高頻TMS的即時刺激下,可瞬時打開VGSCs并增加INa幅值[23]。這些研究與本課題組的結果都揭示了TMS可通過調控VGSCs與Kv介導神經興奮性的變化。
神經興奮性是神經元受到刺激后產生動作電位的能力,是神經元在放電狀態和靜息狀態之間轉換的基本和重要的動力學機制[35]。AP是哺乳動物中樞神經系統中可興奮細胞的基本特征,它遵循VGSCs與Kv的開啟與關閉[36]。在對靜息電位及AP相關特征的分析中,實驗結果顯示:在TMS作用下,顆粒細胞的靜息膜電位顯著升高;長時程放電頻數顯著增加;誘發AP的閾值電位顯著降低;AP的峰值電位及上升支最大斜率均顯著增加;AP達峰時間、半波寬、后超極化幅度顯著減小。這些 特征的變化揭示了TMS的調控作用使得神經元的靜息狀態向著去極化方向移動,在同樣的刺激脈沖下更容易達到其放電閾值,達峰時間、半波寬的縮短與最大上升斜率的增加印證了INa激活曲線的右移及膜電位更快的去極化速度,后超極化幅度的降低揭示了TMS對K+外流的抑制。這些變化都說明了神經興奮性的顯著增強,同時這種增強效應隨著刺激強度的增加而增加,即高頻即時TMS對顆粒細胞神經興奮性的提升表現出了強度依賴性。已有文獻報道高頻TMS可以提高CA1錐體神經元的靜息電位水平和神經放電頻率、降低后超極化電位幅度,增強神經興奮性[18]。高頻TMS對腦片進行即時刺激后,皮層神經元的活動增強,增加神經放電頻率[23]。這些研究與本課題組當前及先前[21,37]的結果相似。
本課題組的研究結果證明了TMS對神經元具有瞬態調節作用,展示了TMS對神經興奮性、VGSCs和Kv通道強度依賴性的即時調節潛力。引言中提及的部分研究也報道了相似的結果,例如急性大鼠腦切片在高頻磁刺激作用下增強神經元反應的同時,其VGSCs通道被瞬間打開并增加了穩態鈉電流[23],除此之外,該研究也表明,在神經活動增強這一過程中伴隨神經胞內鈣離子聚集的現象,這提示在今后的研究中對電壓門控鈣離子通道的檢測同樣重要。磁刺激增強離體坐骨神經節神經元的興奮性,這種即時的調控作用與鈉通道密切相關[25]。因此,這些研究或可揭示磁刺激對于神經活動的調控作用,至少部分上是通過與電壓門控相關離子通道的相互作用介導的。
研究表明,內在神經興奮性的可塑性促進了學習與記憶,這一過程的異常調節與相關神經退行性疾病認知障礙等癥狀的發展有關,如老化、阿爾茲海默癥、抑郁等[38]。TMS可通過調節神經興奮性改善認知功能障礙[18,21]。研究表明,離子通道作為主要病因或中介參與了多種疾病的發生,因此,離子通道成為眾多疾病診斷和治療的理想靶點[39]。有關VGSCs及Kv通道的功能及區域表達的研究表明,它們是包括心血管和神經疾病、癌癥與免疫性疾病在內的多種疾病的靶點。例如,VGSCs的異常表達與內在神經元興奮性的改變有關,是包括癲癇和偏頭痛在內的幾種神經系統疾病的神經紊亂的基礎[40]。免疫系統可以利用VGSCs通道來選擇強大的T細胞,當身體制造T細胞時,它依賴神經和心肌中常見的VGSCs通道確保強大的T細胞具備攻擊性,同時也會消除過度活躍能夠攻擊自身導致自身免疫疾病的T細胞[41]。Kv4.2通道的下調與慢性癲癇和其他以神經元過度興奮為表型的中樞神經系統疾病有關[42]。Kv1.3通道位于人類免疫細胞中主要的Kv通道之下,其通道活性在人類T淋巴細胞中表現得最為明顯,它在免疫和炎癥事件期間的增殖和分泌反應中發揮重要作用[43]。CCR7效應記憶T淋巴細胞參與T細胞介導的自身免疫性疾病的發病機理中,而Kv1.3通道電流是控制CCR7效應記憶T淋巴細胞膜電位的主要鉀電流[44]。因此,TMS在調控神經興奮性進而改善神經退行性疾病的認知障礙,在調控相關離子通道進而調節神經及免疫性應答等方面有巨大的研究空間和應用前景,是今后TMS科學研究與臨床應用的一個重要方向。本課題組的研究亦提供了相關的理論基礎,但仍需在后續工作中進一步深入探索。
4 結論
TMS強度依賴性地左移了INa激活曲線,右移了INa失活曲線,加速了INa失活后再復活的速度,激活了INa電流峰值;TMS強度依賴性地左移了IA失活曲線與IK激活曲線,延緩了IA失活后再復活的速度,抑制了IA與IK電流峰值;TMS強度依賴性地提高了DG顆粒細胞神經興奮性。因此,TMS改變了VGSCs與Kv部分通道動力學特性、激活INa抑制IA與IK,是TMS提高海馬DG顆粒細胞神經興奮性潛在的內在介導機制之一,且TMS的神經調控作用具有強度依賴性。

