齊墩果酸對酒精誘導的大鼠胃壁氧化損傷的保護作用
李宏偉,孔德欽,于衛華,吳昊,王釗,劉瑞,海春旭,王欣,劉江正,,李文麗,
(1.空軍軍醫大學軍事預防醫學系軍事毒理學與防化醫學教研室,陜西省自由基生物學與醫學重點實驗室,教育部特殊作業環境危害評估與防治重點實驗室,陜西西安710032;2.63710部隊醫院,山西忻州036301)
伴隨著我國經濟高速發展和人民生活水平的不斷提高,酒精類飲品的消費量呈現逐年提高的趨勢,部分人群有酗酒習慣,已經成為嚴重危害身心健康的公共衛生問題。長期或者大量攝入酒精可以導致胃壁的急性或慢性損傷,臨床較為常見的是急慢性胃炎或者潰瘍。酒精作為一種有機溶劑,極易通過生物膜,胃壁是重要的吸收途徑之一,胃壁上皮細胞接觸的酒精濃度往往較高,反復高劑量暴露容易導致胃壁損傷。針對酒精誘導胃壁損傷目前還缺乏有效的防治藥物,從中醫藥中尋找安全有效的化學單體是解決這一難題的新思路與新途徑。
酒精誘導胃壁損傷的發病機制較為復雜,可能與胃壁保護性和侵襲性因素之間的平衡紊亂有關,胃壁屏障功能降低、血管結構和功能紊亂、氧化應激損傷、過度炎癥反應、胃酸分泌等可能參與了酒精性胃壁損傷的發生和發展過程。其中,酒精在代謝過程中通過細胞色素P450家族成員2E1(CYP2E1)等途徑可以產生大量活性氧(reactive oxygen species,ROS)和自由基,氧化應激損傷被認為是核心機制之一。酒精暴露還能激活胃壁組織內炎癥細胞和免疫細胞等,激活炎癥通路,導致炎癥損傷級聯反應,誘導炎癥性損傷,進而損傷胃壁。針對酒精誘導胃壁損傷的氧化應激與炎癥機制,采用合理的抗氧化和抗炎藥物干預可能對于減輕酒精誘導胃壁損傷具有良好保護作用。
齊墩果酸(oleanolic acid,OA)是一種廣泛分布于植物體內的五環三萜類天然化合物(圖1),是多種中藥有效成分之一,同時也是人類飲食中不可缺少的組成部分。OA常溫下為白色結晶性粉末,密度是1.1 g/cm,幾乎不溶于水,可溶于酒精。OA已被證明具有較好的抗炎、抗氧化和免疫調節作用。但OA對酒精誘導胃壁損傷是否具有保護作用還未見報道。本研究旨在探討OA對酒精誘導胃壁損傷的保護作用,并明確抗氧化和抗炎是否參與了上述保護作用,為臨床上酒精性胃壁損傷的防治提供新的途徑和思路。
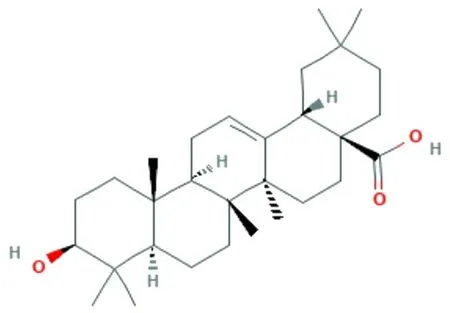
圖1 齊墩果酸(C30H48O3)的化學結構式
1 材料與方法
1.1 實驗動物
雄性清潔級SD大鼠24只,體質量(180±20)g,購于空軍軍醫大學動物實驗中心,飼養于本教研室SPF級動物房內,自由攝入水和普通飼料,適應性喂養一周。動物房內環境相對濕度(50±10)%,溫度(25±2)℃,12 h/12 h交替晝夜循環,每日觀察動物一般情況。
1.2 試劑與儀器
1.2.1 主要試劑
齊墩果酸(CAS號508-02-1)購于國藥集團化學試劑有限公司,乙醇(CAS號64-17-5)購于美國Sigma公司。丙二醛(malondialdehyde,MDA)含量檢測試劑盒、氧化型谷胱甘肽(oxidized glutathione,GSSG)和還原型谷胱甘肽(glutathione,GSH)含量檢測試劑盒、蛋白提取試劑盒均購于南京建成生物技術研究所。RNA反轉錄試劑盒、SYBR Green一步法RTPCR試劑盒購于中國TIANGEN公司。BCA蛋白定量試劑盒購于美國Thermo Scientific公司。NF-E2相關因子(nuclear erythroid 2-related factor 2,Nrf-2)抗體、TNF-a抗體、IL-6抗體均購于美國Abcam公司。β-actin一抗購自美國Cell Signaling Technology公司。所有其他化學品均為化學純以上級別。1.2.2 主要儀器
TE2000倒置顯微鏡系統購于日本Nikon公司;SCIENTZ-48高通量組織研磨器購于新芝公司;全自動高速冷凍離心機購于美國Sigma公司;Infinite M200 Pro全波段酶標儀購于瑞士Tecan公司;Mini-PROTEAN電泳系統、蛋白半干轉裝置及凝膠成像與分析系統均為美國Bio-Rad公司產品。1.3 方法
1.3.1 動物分組和處理
隨機數表法將24只SD大鼠隨機分為對照組、酒精暴露組、OA干預組共3組,每組8只。對照組,每天灌胃同等熱量葡萄糖溶液,持續30 d;酒精暴露組,采取灌胃方式給予酒精(4 g/kg,50%,V/V
),持續30 d;OA干預組,采取灌胃方式給予溶解了10 mg/kg OA的酒精(4 g/kg,50%,V/V
)溶液中,持續30 d。末次處理6 h后,使用5%苯巴比妥鈉腹腔注射麻醉大鼠,腹主動脈取血,然后取出胃,使用眼科剪小心剪開胃壁,展開后數碼相機拍照。取部分胃中部組織于4%多聚甲醛溶液中,HE染色觀察。其余胃組織用冰冷的生理鹽水沖洗血水,取一部分胃組織在預冷生理鹽水中制備5%的胃組織勻漿液,所有步驟均在冰浴條件下進行。剩余胃組織于-80℃條件下保存。
1.3.2 組織病理學檢測
胃組織用4%多聚甲醛固定。將組織塊包埋于石蠟中,并切成5 μm厚。蘇木精-伊紅(HE)染色后,使用倒置顯微鏡觀察組織病理學改變。1.3.3 氧化損傷及抗氧化指標檢測
用眼科剪將100 mg胃壁組織剪碎,置于4 mL EP管中,加入1.9 mL預冷的生理鹽水,SCIENTZ-48高通量組織研磨器振蕩勻漿(30 Hz頻率,運行10 s,停止20 s,重復5次),制備成5%胃組織勻漿,以測定胃組織氧化損傷指標。嚴格按照MDA、GSSG和GSH含量檢測試劑盒的說明書操作步驟完成。1.3.4 RT-PCR檢測
使用Trizol試劑(TaKaRa)從大鼠胃壁組織中提取總RNA。收集RNA溶解在無DNase/RNase的水中。使用NanoDrop 2000分光光度計(Thermo,美國)分析RNA的濃度和純度。使用EasyScript First-Strand cDNA合成超級混合試劑盒(Thermo Fisher SCIENTIFIC)對提取的總RNA(1 μg)進行反轉錄。反應條件如下:42℃、60 min,70℃、5 min。使 用QuantStudio 7 Flex實 時PCR系 統(Thermo Fisher SCIENTIFIC,美國)和SYBR premix Ex Taq試劑盒(TaKaRa)進行基因擴增,循環條件為95℃、15 s,60℃、20 s,72℃、20 s。cDNA引物(5′-3′)為:TNF-a(F:GCGTGTTCATCCGTTCTCTACC;R:TACTTCAGCGTCTCGTGTGTTTCT)。IL-6(F:CCC ACCAGGAACGAAAGTCA,R:GCGGAGAGAAACTT CATAGCTGTT。Nrf-2(F:GCTGATACTACCGCTGTTC;R:GTGGAGAGGATGCTGCTGA)。mRNA的相對定量值使用2方法,β-actin
基因作為內參基因。1.3.5 Western blot檢測
通過組織蛋白提取試劑盒提取胃壁組織總蛋白質。使用BCA蛋白定量試劑盒定量樣品蛋白,取30 μg蛋白在12.5% SDS-PAGE上分離(恒壓120 V,電泳時間約1.5 h),半干轉到PVDF膜上(甲醇浸泡),并在37℃下在5%脫脂奶粉中封閉2 h。TNF-a、IL-6、Nrf-2、Tubulin(1∶1 000)一抗4℃下孵育過夜,然后TBST清洗4次。二抗(1∶5 000)37℃下孵育1 h,使用Bio-Rad Quantity One軟件對條帶進行定量分析,采用Tubulin作為內參蛋白。1.4 統計學方法
實驗數據采用x
ˉ±s
表示,運用Graphpad Prism分析軟件進行統計分析,應用LSDt
檢驗進行組間的兩兩比較,以α
=0.05為檢驗水準。2 結果
2.1 OA干預對酒精誘導胃組織病理學損傷的影響
采用HE染色檢查胃組織病理學變化,結果見圖2。對照組表現為正常的胃壁顏色和結構。與對照組相比,酒精暴露組的胃壁顏色較深,HE染色可見胃壁表面黏液層受損,部分胃小凹消失,黏膜下層可見大量紅細胞。OA干預組顯著減輕了酒精導致的胃壁損傷性改變。以上結果表明,酒精暴露能夠誘導大鼠胃壁組織結構發生損傷,OA干預具有保護作用。
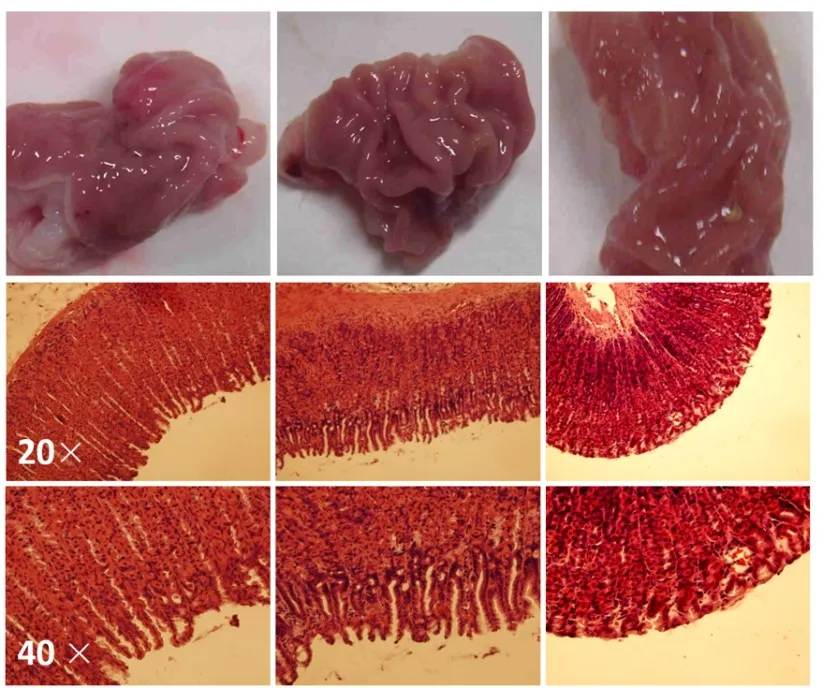
圖2 OA干預對酒精誘導胃壁組織病理學損傷的影響
2.2 OA干預對酒精誘導大鼠胃壁組織氧化應激損傷的影響
MDA和GSSG檢測結果見圖3,可見與對照組比較,酒精暴露能夠導致胃壁組織MDA和GSSG水平顯著上升(P
<0.05),而與酒精暴露組相比,OA干預能夠顯著抑制酒精誘導的MDA和GSSG水平升高(P<
0.05)
。以上結果表明OA干預能夠顯著地減輕酒精誘導的胃壁組織氧化應激損傷。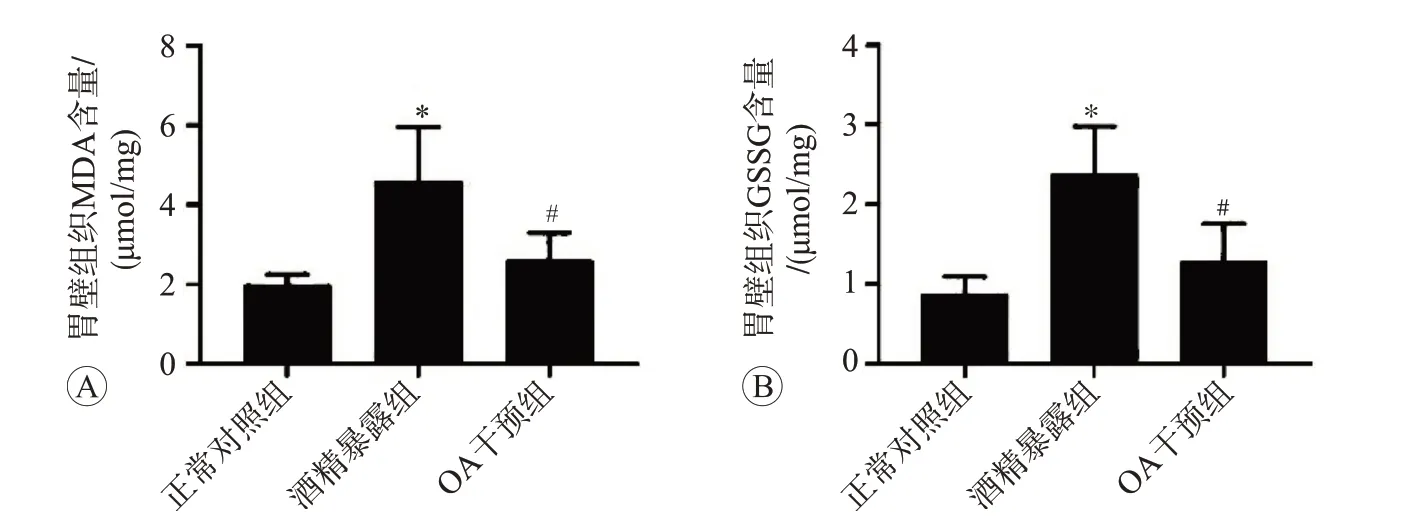
圖3 OA干預對酒精誘導大鼠胃壁組織氧化應激損傷的影響
2.3 OA干預對酒精暴露后大鼠胃壁組織抗氧化功能影響
結果如圖4所示。與對照組相比,酒精暴露組大鼠胃壁組織GSH水平和GSH/GSSG比值顯著降低(P
<0.05),而與酒精暴露組比較,OA干預明顯抑制了酒精誘導的GSH水平和GSH/GSSG比值的降低(P
<0.05)。為了進一步研究抗氧化酶的調控機制,我們檢測了Nrf-2的mRNA和蛋白表達狀況。RT-PCR和Western blot檢測結果表明,與陰性對照組相比,酒精暴露導致Nrf-2的mRNA和蛋白表達均升高(P
<0.05)。與酒精暴露組相比,OA干預進一步增加了Nrf-2的mRNA和蛋白表達(P
<0.05)。以上結果提示,以Nrf-2為核心的抗氧化防御體系功能增強可能參與了OA處理對酒精誘導胃壁損傷的保護作用。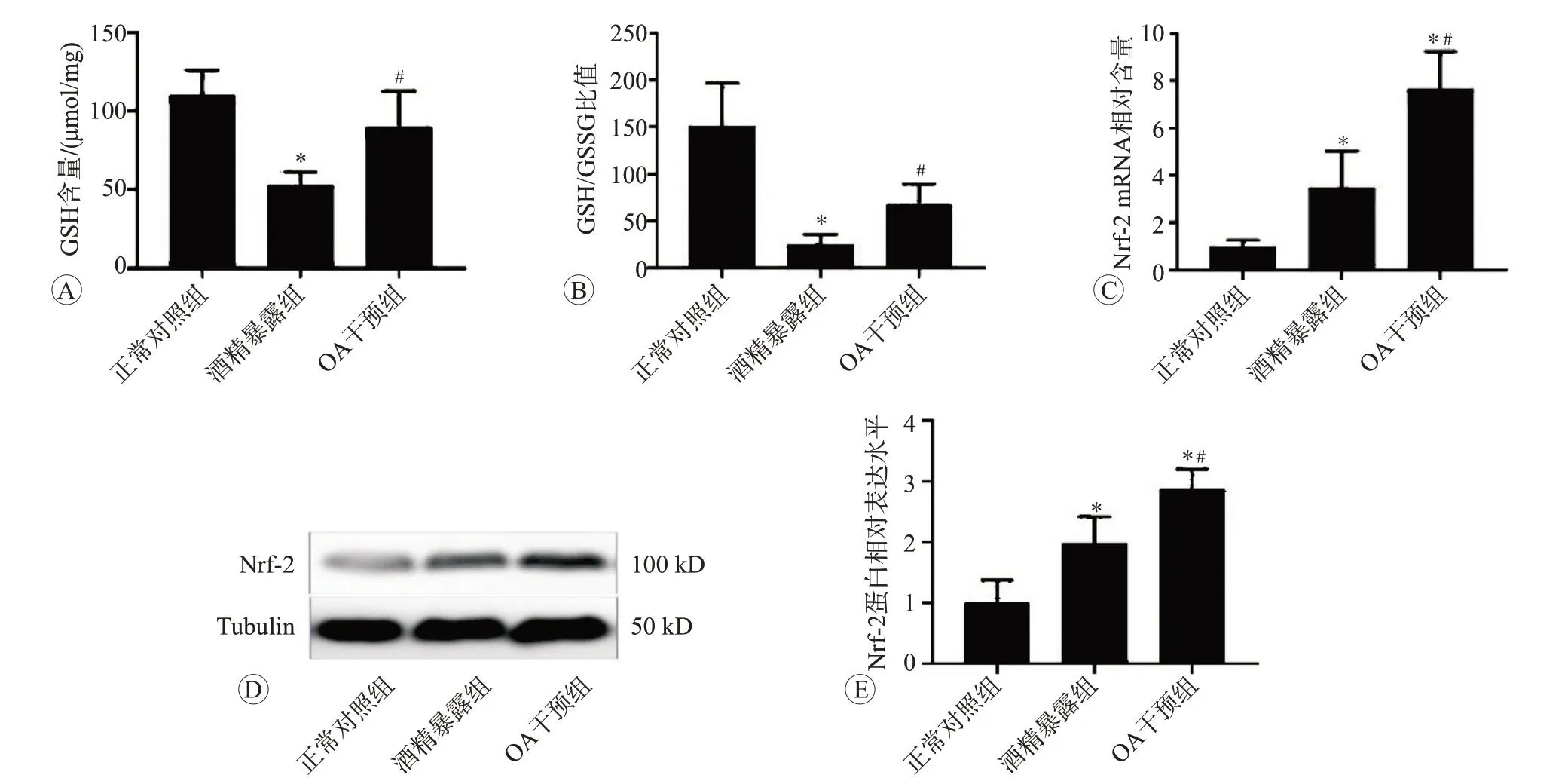
圖4 OA干預處理對酒精暴露后大鼠胃壁組織抗氧化功能的影響
2.4 OA干預對酒精誘導大鼠胃壁組織炎癥反應的影響
結果見圖5。和正常對照組相比,酒精暴露導致大鼠胃壁組織TNF-α和IL-6的mRNA和蛋白水平均顯著升高(P
<0.05)。而OA干預后,上述基因和蛋白表達受到顯著抑制。這些結果表明OA可以通過抗炎通路抑制酒精誘導的胃壁損傷。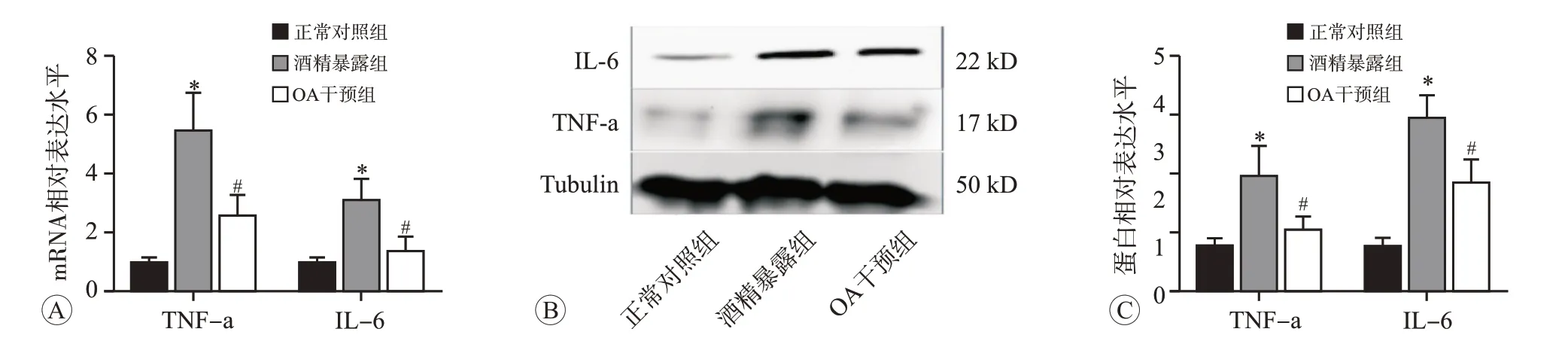
圖5 OA共處理對酒精誘導大鼠胃組織炎癥反應的影響(n=3)
3 討論
本文通過給予大鼠經口灌胃高濃度酒精(4 g/kg,50%,V/V
)方式成功建立酒精性胃壁損傷模型,研究了OA干預后對大鼠胃壁損傷的改善作用。結果顯示,OA降低大鼠胃壁表面黏液層受損狀況,黏膜下層紅細胞明顯減少,降低炎癥反應和脂質過氧化水平,具有顯著的抗酒精性氧化應激損傷和抗炎作用。氧化應激是酒精性胃壁損傷的關鍵機制之一。過量酒精在體內不能及時代謝,會誘導大量超氧化物、羥基陰離子和過氧化氫等活性氧的產生,引起脂質過氧化反應,損害細胞結構,進一步造成機體功能障礙。MDA、GSH和氧化型谷胱甘肽(GSSG)在胃壁組織中的濃度以及MDA的血漿濃度被用作氧化應激的生化標志物。MDA是細胞脂質過氧化反應的終產物之一,引起蛋白質、核酸等生命大分子的交聯聚合,具有細胞毒性。當DNA的雙螺旋被交聯而不能打開,致使細胞死亡,同樣蛋白質被交聯后形成沉淀物,蛋白質被破壞,細胞功能受到影響。機體正常狀態時,ROS處于低水平,當ROS產生過量時可以使GSH轉變為GSSG,發揮抑制ROS清除的作用。文獻[8]報道Nrf-2是機體調節抗氧化應激反應的重要轉錄因子,可以從細胞質轉移到細胞核,與抗氧化反應元件結合,正向調節II相解毒酶和抗氧化酶等靶基因的表達,從而有效改善氧化反應。在本研究中,OA干預能夠顯著降低MDA和GSSG水平,增加Nrf-2的表達水平,提示OA可以通過調節機體氧化應激作用來改善胃損傷。
眾多研究表明,TNF-α、IL-6等多種炎癥因子對急性胃潰瘍發揮關鍵作用,TNF-α能引導中性粒細胞向胃壁組織浸潤,IL-6通過STAT途徑介導激活NF-κB信號通路,導致上皮細胞黏附分子、中性粒細胞的表達。本實驗結果表明OA降低大鼠TNF-α、IL-6的表達水平,進而改善胃壁損傷。
綜上所述,本研究表明OA對酒精誘導的大鼠胃壁損傷具有顯著的保護作用,其保護機制可能與OA的抗氧化活性和抗炎作用有關。本研究提示OA可能是一種臨床上緩解酒精中毒導致胃損傷的有效藥物。OA治療酒精誘導胃壁氧化損傷和炎癥反應的機制研究尚處于初級認識階段,以轉錄組學、代謝組學等高、新、尖的科研技術為研究手段,探索其作用機制任重道遠。

