蝦青素預處理通過調控Sirt1/miR-134信號通路改善腦缺血再灌注大鼠認知功能*
古春青, 張運克, 楊廣華, 武繼濤
(河南中醫藥大學第一附屬醫院腦病科,河南鄭州 450000)
缺血性中風是指由于腦血管閉塞引起的腦缺血,具有很高的發病率、致殘率、致死率和復發率,近年來,其發病呈年輕化趨勢,已成為醫學界和社會關注的重大問題[1]。缺血再灌注(ischemia/reperfusion,I/R)損傷在缺血性中風的發生中起重要作用,據報道,血管再通后恢復到缺血區域的血流會在一定程度上加重缺血性腦損傷,從而加重病情,這種病理過程被稱為腦缺血再灌注(cerebral ischemia/reperfusion,CI/R)[2]。CI/R 可引起神經元損傷,導致認知功能障礙,甚至導致“血管性癡呆”,嚴重影響患者的生活質量,增加中風的死亡率和復發風險[3-4。因此,有必要進一步探索其潛在的信號傳導機制,并探索新穎的有希望的干預措施以減輕中風引起的認知功能障礙。
蝦青素(ataxanthin,ATX)是一種類胡蘿卜素,具有強大的抗氧化劑和抗炎活性。最近,ATX 因其預防或治療包括阿爾茨海默病和帕金森病在內的神經退行性疾病的作用而受到關注[5]。ATX 對大腦具有很強的保護作用,其獨特的化學結構使其可以輕松穿越血腦屏障,可減少I/R 損傷引起的神經元缺陷[6];還可通過抑制炎癥反應和氧化應激,減輕阿霉素誘導的認知障礙[7]及血管性癡呆小鼠的認知障礙和海馬神經元損傷[8]。然而,目前尚無研究報道ATX能否減輕CI/R所致認知功能障礙。腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)參與神經元的存活、生長和新神經元的分化[9],與神經元損傷密切相關,是治療中風的重要靶點[10];其表達受環磷酸腺苷反應元件結合蛋白(cAMP response element binding protein,CREB)的調控,而且在多種神經退行性疾病中CREB/BDNF 信號通路的活化與認知功能的改善緊密相關[11]。沉默信息調節因子1(silent information regulator 1,Sirt1)是一種NAD+依賴的脫乙酰酶,在大腦中具有多方面的作用,與神經可塑性密切相關,而Sirt1 的缺失可通過miR-134 介導的轉錄后機制減弱CREB 活性,導致BDNF 的表達下調,從而削弱突觸可塑性,損害大腦的認知功能[12]。以上研究提示Sirt1/miR-134 信號通路可能介導CREB/BDNF 信號通路的活化,從而參與大腦認知功能的調節,故本研究擬通過建立CI/R大鼠模型,探究ATX 對CI/R 大鼠認知功能的影響及可能的作用機制。
材 料 和 方 法
1 動物
從北京維通利華動物中心購入7~8 周齡SPF 級雄性SD 大鼠60 只,體重(300±20)g,許可證為SCXK(京)2019-0009。將大鼠飼養在可控的環境[溫度(22±2)℃,濕度(55±5)%,12 h明/暗交替]中,所有大鼠可自由飲水和攝食。研究遵循《實驗動物的護理和使用指南》,按實驗動物使用的3R 原則給予人道的關懷,并由機構動物護理和使用委員會批準。
2 主要試劑與儀器
ATX(HPLC≥97%)購自Sigma-Aldrich;線栓購自北京西濃科技有限公司;EX527(Sirt1 抑制劑)購自ApexBi;HE 染色試劑、RIPA 裂解液和BCA 試劑盒購自碧云天生物科技公司;TUNEL 原位細胞凋亡檢測試劑盒購自武漢博士德公司;Trizol RNA 分離試劑、PrimeScript?RT 試劑盒和SYBR?Premix Ex Taq?II試劑盒購自TaKaRa;兔抗大鼠Sirt1、BDNF、CREB、p-CREB 和β-actin 抗體及山羊抗兔IgG H&L 均購自Abcam;RT-qPCR 引物由GenePharma 公司合成,序列見表1。Morris水迷宮實驗裝置(WMT-100S)購自成都泰盟軟件有限公司;熒光定量PCR 系統(Prism?7300)購自ABI;倒置熒光顯微鏡(IX73)購自Olympus;蛋白轉膜裝置購自Bio-Rad。

表1 RT-qPCR引物序列Table 1. Sequences of the primers for RT-qPCR
3 主要方法
3.1 實驗分組 SD 大鼠60 只隨機分為假手術組(sham 組)、模型組(CI/R 組)、ATX 低劑量(50 mg/kg[13])組(ATX-L 組)、ATX 高 劑 量(100 mg/kg[13])組(ATX-H 組)和ATX(100 mg/kg)+Sirt1 抑制劑EX527(10 mg/kg[14])組(ATX+EX527 組),每組12 只。分組完成后各ATX 組給予相應濃度的ATX 溶液(ATX 溶解于5%羧甲基纖維素鈉中)灌胃;ATX+EX527 組在灌胃100 mg/kg ATX 的同時,腹腔注射10 mg/kg 的EX527(DMSO 溶解稀釋);sham 組和CI/R 組給予等體積的5%羧甲基纖維素鈉灌胃和DMSO 腹腔注射,每天1次,連續給藥3 d。
3.2 模型制備 末次給藥1 h 后,采用線栓法構建CI/R 大鼠模型[6]:用戊巴比妥鈉(50 mg/kg)腹腔注射麻醉大鼠,沿中線切開頸部皮膚;然后,仔細解剖右頸總動脈(common carotid artery,CCA)、頸外動脈(external carotid artery,ECA)和頸內動脈(internal carotid artery,ICA);在CCA 和ECA 的近端結扎后,將一根線栓從CCA 插入右ICA,直到感覺到輕度的阻力,表明大腦中動脈(middle cerebral artery,MCA)閉塞(MCA occlusion,MCAO),導致MCA 提供的區域血流暫時停止;MCAO 2 h 后,取出線栓以使血液通過右ICA 回流(實現再灌注);隨后,用4-0 絲線縫合皮膚,在整個過程中,保持大鼠的體溫在(37±0.5)℃。sham 組大鼠進行相同的手術程序,不同之處在于不將線栓插入ICA阻塞血管。
3.3 神經功能缺損評分 再灌注24 h 后,由對實驗組不知情的研究人員進行神經學評估。參照Longa評分標準:0 分,無缺損;1 分,提尾時不能充分伸展對側前肢;2 分,行走時向對側輕度旋轉;3 分,行走時向對側傾斜;4 分,不能自發行走或伴意識障礙。分數越高表示神經功能缺損越嚴重。
3.4 Morris水迷宮實驗 包括定位航行實驗和空間探索實驗兩個部分。將一水池(直徑120 cm,高50 cm)平均分為Ⅰ、Ⅱ、Ⅲ和Ⅳ象限,在第Ⅳ象限中央距水平1 cm 處放置一圓形隱藏平臺。水中倒入墨水,保持水溫21~23℃。通過計算機視頻跟蹤系統記錄實驗中的逃逸潛伏期和觀察并記錄在目標象限(象限Ⅳ)中停留的時間(時間百分比)及平臺穿越的次數。(1)定位航行實驗:每次從不同象限將大鼠放入池中,逃避潛伏期記錄為大鼠從起點到目標平臺的游泳時間;若大鼠120 s 內未找到平臺,則潛伏期記為120 s,并將其引入平臺停留10 s;每天訓練4 次,每次間隔30 min,連續4 d,記錄每天逃避潛伏期的平均值。(2)空間探索實驗:定位航行實驗第5 天,撤掉平臺,將大鼠從第Ⅰ象限放入水中,記錄大鼠60 s內在目標象限中停留時間的百分比和平臺穿越次數。逃避潛伏期越長,在目標象限中停留的時間越短,穿越平臺的次數越少,表示實驗大鼠的認知功能越差。
3.5 HE 染色觀察海馬神經元損傷 行為學檢測完成后,大鼠麻醉、經心灌注后,通過斷頭迅速處死大鼠并取出腦組織。隨機選取6 只大鼠的腦組織,在室溫下用4%多聚甲醛固定7 d 后,梯度乙醇溶液脫水,石蠟包埋,將組織切成4 μm 切片。切片用蘇木精染色2 min,并用伊紅染色30 s。光學顯微鏡下觀察海馬組織的病理學變化。
3.6 TUNEL 染色檢測海馬神經元凋亡 取方法3.5 制備的腦組織切片,去石蠟并重新水化。用0.1 mol/L PBS 洗滌2 次后,將切片與10 mg/L 蛋白酶K 工作溶液(pH 7.5~8.0)在37 ℃孵育15 min。然后,再次用PBS 沖洗,在室溫下用綠色熒光素標記的dUTP溶液染色10 min。DAPI染核。使用熒光顯微鏡檢測呈綠色熒光顆粒的TUNEL 陽性細胞。選擇3個隨機視野,計算TUNEL 陽性凋亡神經元占DAPI 染色神經元總數的百分比,表示凋亡率。
3.7 免疫組化法檢測海馬組織BDNF 的表達 取方法3.5 制備的切片,二甲苯脫蠟,PBS 清洗3 次,微波修復15 min,加入3% H2O2孵育10 min,再次清洗后,用10%山羊血清封閉30 min,加Ⅰ抗(兔抗大鼠BDNF 抗體,1∶500),4 ℃孵育過夜,然后在室溫下加Ⅱ抗(1∶2 000)孵育1 h,DAB顯色,蘇木素復染,常規脫水、透明、中性樹脂封片,顯微鏡下觀察到胞質內呈棕黃色為BDNF 陽性細胞。每張切片隨機選擇不重疊的3 個視野,Image-Pro Plus 6.0 對圖像進行分析,計算BDNF 陽性表達的平均吸光度(mean absorbance)。
3.8 RT-qPCR 檢測海馬組織miR-134 表達及Sirt1、CREB 和BDNF 的mRNA 表達 每組剩余6 只大鼠,處死后分離海馬組織,使用Trizol 試劑提取總RNA。分光光度計測量總RNA 的濃度。使用PrimeScript?RT試劑盒將RNA反轉錄為互補DNA(cDNA)。根據擴增試劑盒的說明,進行RT-qPCR。反應體系(20 μL):SYBR?Premix Ex TaqTM(2×)10 μL,上、下游引物各0.8 μL,cDNA(200 μg/L)2 μL,ddH2O 6.4 μL。反應條件:95 ℃預變性1 min;95 ℃變性18 s,60℃持續55 s,最后72 ℃延伸2 min,進行40 個循環。所有反應均重復3次。將RNA 的表達量采用2-ΔΔCt方法計算,并相對于內參照U6或β-actin進行標準化。
3.9 Western blot 檢 測 海 馬 組 織Sirt1、CREB 和BDNF的蛋白表達 取海馬組織,在含有蛋白酶抑制劑(PMSF)和磷酸酶抑制劑的RIPA 裂解液中勻漿,12 000 r/min離心15 min,取上清,BCA 法進行蛋白定量,RIPA 裂解液平衡蛋白濃度,變性后取等量蛋白質樣品上樣(30 μg),SDS-PAGE 分離,濕轉法轉膜,5%脫脂奶粉封閉,加入Ⅰ抗(Sirt1、CREB、p-CREB和BDNF 抗體,1∶1 000;β-actin 抗體,1∶2 000),4 ℃下孵育過夜,加Ⅱ抗(1∶5 000)室溫孵育1 h,ECL 顯色,以β-actin 為內參照,通過與內參的灰度比,得出目的條帶的相對表達水平。
4 統計學處理
所得數據采用SPSS Statistics 22.0 和Image-Pro Plus 6.0 軟件進行分析。數據分布的正態性和方差齊性分別通過Kolmogorov-Smirnov 檢驗和Levene 檢驗進行分析。數據以均數±標準差(mean±SD)表示。多組間均數比較采用單因素方差分析,并使用Bonferroni 進行兩兩比較。以P<0.05 為差異有統計學意義。
結 果
1 各組大鼠神經功能缺損評分
MCAO 術后,造模大鼠表現出明顯的神經功能缺損,與sham 組相比,CI/R 組大鼠神經功能缺損評分顯著升高(P<0.05);與CI/R 組相比,ATX-L 和ATX-H 組大鼠神經功能缺損評分顯著降低(P<0.05),且ATX-H 組的效果優于ATX-L 組;與ATX-H組相比,ATX+EX527 組大鼠神經功能缺損評分顯著升高(P<0.05),見表2。
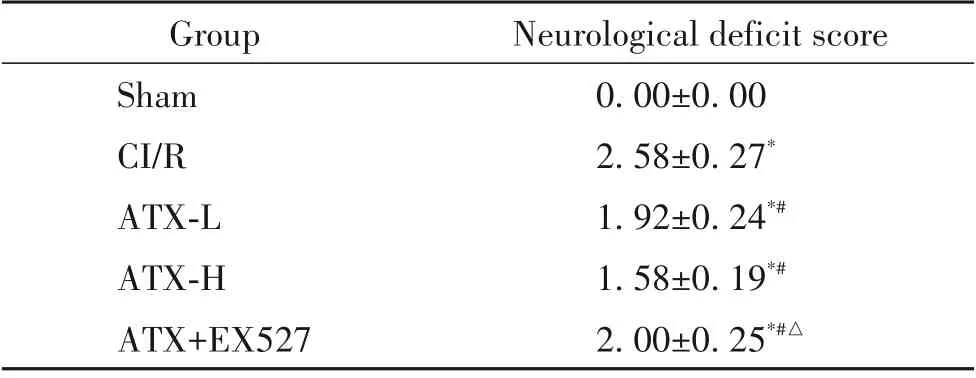
表2 各組大鼠神經功能缺損評分Table 2. Neurological deficit scores of the rats in each group(Mean±SD. n=12)
2 各組大鼠學習及認知能力
與sham 組相比,CI/R 組大鼠在MCAO 術后第2~4 天,在定位航行實驗中的逃避潛伏期顯著延長(P<0.05),并且在空間探索實驗中目標象限停留時間和穿越平臺次數顯著減少(P<0.05);與CI/R 組相比,ATX-L 和ATX-H 組大鼠的逃避潛伏期顯著縮短(P<0.05),目標象限停留時間和穿越平臺次數顯著增加(P<0.05),且ATX-H 組的效果優于ATX-L 組;與ATX-H 組相比,ATX+EX527 組大鼠的逃避潛伏期顯著延長(P<0.05),目標象限停留時間和穿越平臺次數顯著減少(P<0.05),見表3、4。

表3 定位航行實驗中逃避潛伏期Table 3. Escape latency in positioning navigation experiment(s. Mean±SD. n=12)
3 各組大鼠海馬組織病理學變化
HE 染色結果顯示,sham 組海馬組織學正常,神經元淡染,細胞核圓形;與sham 組相比,CI/R 組呈現核固縮、神經元數量減少和神經元萎縮等組織病理學變化;與CI/R組相比,ATX-L和ATX-H組大鼠海馬神經元數量增加,神經元萎縮得到緩解,且ATX-H組海馬組織病理損傷較輕;而ATX+EX527 組海馬神經元數量較ATX-H 組明顯減少,病理損傷加重,見圖1。
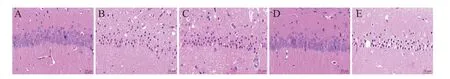
Figure 1. HE staining results of hippocampal CA1 region of the rats in each group. A:sham group;B:CI/R group;C:ATX-L group;D:ATX-H group;E:ATX+EX527 group. The scale bar=20 μm.圖1 各組大鼠海馬CA1區HE染色結果
4 各組大鼠海馬神經元凋亡情況
與sham 組相比,CI/R 組海馬神經元凋亡率顯著升高(P<0.05);與CI/R 組相比,ATX-L 和ATX-H 組海馬神經元凋亡率顯著降低(P<0.05);與ATX-H 組相比,ATX+EX527 組海馬神經元凋亡率現在升高(P<0.05),見圖2、表5。
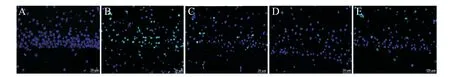
Figure 2. TUNEL(green)staining results of hippocampal tissues of the rats in each group. A:sham group;B:CI/R group;C:ATXL group;D:ATX-H group;E:ATX+EX527 group. The scale bar=20 μm.圖2 各組大鼠海馬組織TUNEL染色結果
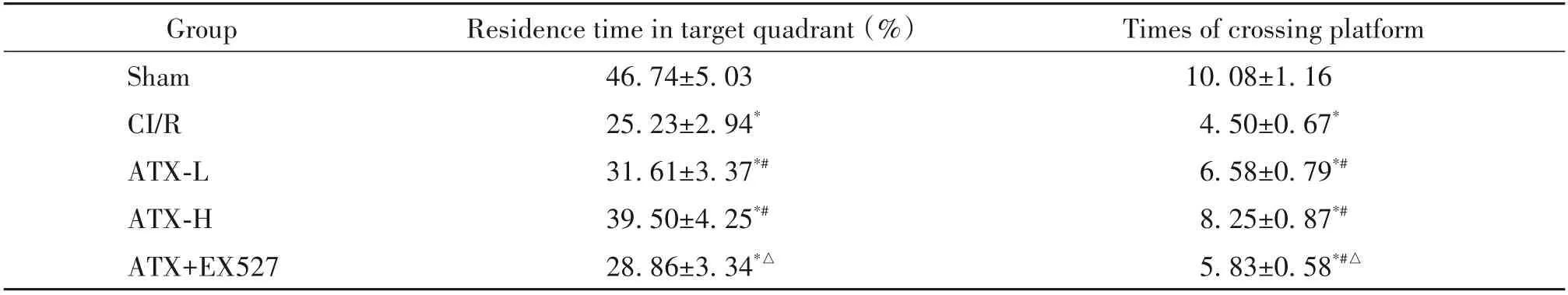
表4 空間探索實驗中目標象限停留時間和穿越平臺次數Table 4. Residence time in target quadrant and times of crossing platform in space exploration experiment(Mean±SD. n=12)
5 各組大鼠海馬組織BDNF的表達
與sham 組相比,CI/R 組大鼠海馬組織BDNF 陽性表達顯著降低(P<0.05);與CI/R組相比,ATX-L和ATX-H 組大鼠海馬BDNF 陽性表達顯著升高(P<0.05);與ATX-H 組相比,ATX+EX527 組大鼠海馬BDNF陽性表達顯著降低(P<0.05),見圖3、表5。

表5 各組大鼠海馬神經元凋亡和BDNF的表達Table 5. Neuronal apoptosis and BDNF expression in the hippocampus of rats in each group(Mean±SD. n=6)

Figure 3. Immunohistochemical staining results of BDNF in hippocampal CA1 region of the rats in each group. A:sham group;B:CI/R group;C:ATX-L group;D:ATX-H group;E:ATX+EX527 group. The scale bar=50 μm.圖3 各組大鼠海馬CA1區BDNF免疫組化染色結果
6 各組大鼠海馬組織miR-134 表達及Sirt1、CREB和BDNF的mRNA表達水平
與sham 組相比,CI/R 組大鼠海馬組織miR-134表達水平顯著升高(P<0.05),Sirt1、CREB 和BDNF的mRNA 表達水平顯著降低(P<0.05);與CI/R 組相比,ATX-L 和ATX-H 組大鼠海馬組織Sirt1、CREB 和BDNF 的mRNA 表達水平顯著升高(P<0.05),miR-134 表達水平顯著降低(P<0.05);與ATX-H 組相比,ATX+EX527組大鼠海馬組織miR-134表達水平顯著升高(P<0.05),Sirt1、CREB 和BDNF 的mRNA 表達水平顯著降低(P<0.05),見表6。
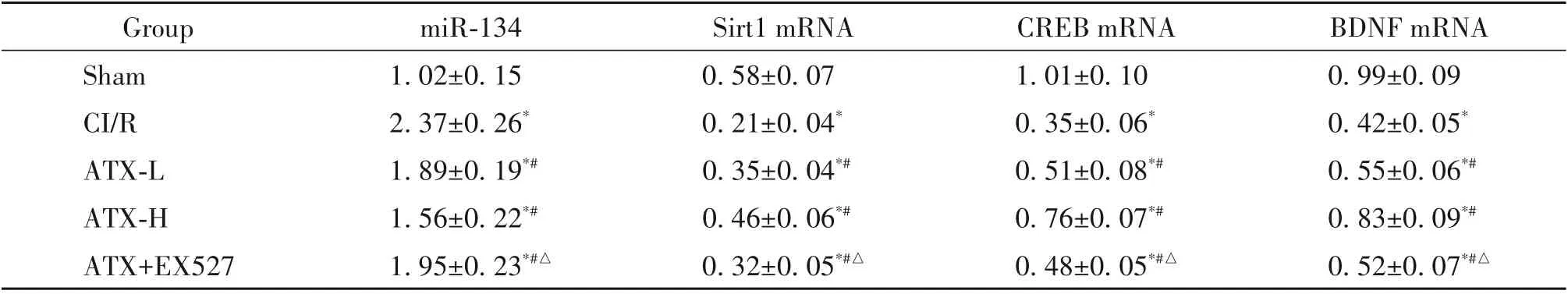
表6 各組大鼠海馬組織miR-134表達及Sirt1、CREB和BDNF的mRNA表達Table 6. The expression of miR-134,and the mRNA expression of Sirt1,CREB and BDNF in hippocampal tissues of the rats in each group(Mean±SD. n=6)
7 各組大鼠海馬組織Sirt1、CREB、p-CREB 和BDNF的蛋白水平
與sham 組相比,CI/R 組大鼠海馬組織Sirt1 和BDNF 蛋白表達及p-CREB/CREB 比值顯著降低(P<0.05);與CI/R 組相比,ATX-L 和ATX-H 組大鼠海馬Sirt1和BDNF 蛋白表達及p-CREB/CREB 比值顯著升高(P<0.05);與ATX-H 組相比,ATX+EX527 組大鼠海馬Sirt1 和BDNF 蛋白表達及p-CREB/CREB 比值顯著降低(P<0.05),見圖4。
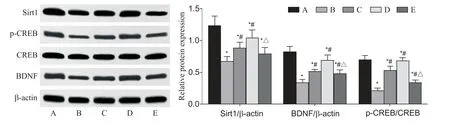
Figure 4. Protein levels of Sirt1,CREB,p-CREB and BDNF in hippocampal tissues of the rats in each group. A:sham group;B:CI/R group;C:ATX-L group;D:ATX-H group;E:ATX+EX527 group. Mean±SD. n=6.*P<0.05 vs sham group;#P<0.05 vs CI/R group;△P<0.05 vs ATX-H group.圖4 各組大鼠海馬組織Sirt1、CREB、p-CREB和BDNF蛋白水平
討 論
ATX 是一種具有高抗炎和抗氧化活性的天然類胡蘿卜素,廣泛分布于藻類、蟹、蝦、鮭魚和甲殼類動物中,被認為是一種潛在的神經保護藥物,可減輕I/R 所致的腦損傷[6];其預處理可呈劑量依賴性地抑制急性腦梗死后的氧化應激,并上調神經營養因子(如BDNF、NGF)的表達,減輕神經損傷[13];可促進創傷性腦損傷小鼠恢復認知功能[15]。研究顯示,單次或多次攝入ATX后會積聚在大鼠大腦的海馬和大腦皮層中,有利于認知功能的維持和改善[16-17]。在本研究中,ATX 表現出類似的神經保護作用,可抑制海馬神經元凋亡,極大地促進了I/R 大鼠的認知功能恢復。說明ATX可改善CI/R后認知功能障礙。
BDNF在海馬組織中廣泛表達,在突觸的正常生長、發育和可塑性中起重要作用[9]。CREB 家族是BDNF 轉錄的主要調節劑,敲減CREB將降低BDNF的轉錄[18];而CREB/BDNF 通路的激活可減輕海馬神經元損傷,改善認知功能[11]。在本研究中,I/R 大鼠海馬組織中p-CREB/CREB 比值和BDNF 表達顯著低于假手術大鼠,即CREB 磷酸化被抑制。因此,我們猜想ATX 對認知功能的改善作用可能與CREB/BDNF通路的激活有關。研究結果也證實了此猜想,經ATX 干預的大鼠海馬組織中p-CREB/CREB 比值和BDNF 表達明顯升高,說明ATX 可激活CREB/BDNF 通路。此結果提示ATX 可能通過激活CREB/BDNF 通路減輕CI/R 后認知功能障礙,但是尚不清楚介導CREB/BDNF表達的上游信號傳導通路。
隨著分子技術的發展,研究者發現miRNA 參與海馬突觸可塑性,在學習和記憶形成中具有顯著潛力。許多miRNA 已經從神經系統中分離,據報道,miR-134 在缺血性中風中其表達明顯增加,對CREB的翻譯有限制作用,可通過參與樹突棘大小變化、神經元可塑性等過程來影響腦發育[19];抑制其表達可保護缺血性中風小鼠的大腦和神經元免受缺氧損傷[20];并可通過靶向促進CREB mRNA 翻譯,從而上調BDNF 的表達[21]。因此,miR-134 可能是CREB/BDNF 通路的上游調節因子。此外,有研究發現miR-134 在海馬的過度表達,與Sirt1缺失的效果非常相似,Sirt1缺失可通過miR-134 減弱CREB 活性,下調BDNF 的表達,損害大腦的認知功能[12]。白藜蘆醇可通過Sirt1/miR-134 信號通路在體內和體外調節海馬中的CREB/BDNF 表達,預防慢性不可預測的輕度應激引起的認知功能障礙[22]。本研究結果顯示,在I/R 大鼠海馬組織中Sirt1 的表達減少,而miR-134 呈高表達,與以上研究結果一致;由此可見,Sirt1/miR-134 通路可能是CREB/BDNF 通路的上游信號傳導通路。最近的研究數據表明,ATX 可以調控Sirt1蛋白表達[23],它通過激活Sirt1,減輕小鼠顱腦損傷后的氧化應激和神經元凋亡[24];還可上調BDNF和海馬突觸蛋白的表達,從而改善衰老模型小鼠的學習、認知和記憶能力[25]。在本研究中,可觀察到經ATX 干預的大鼠海馬中Sirt1 mRNA 和蛋白表達明顯高于I/R模型大鼠,miR-134表達也降低了,故我們推測ATX 對CI/R 后CREB/BDNF 通路的調控作用可能與Sirt1/miR-134 信號通路有關。為了驗證此推測,我們使用Sirt1 特異性抑制劑EX527 與ATX 共同干預大鼠,結果顯示ATX 對CI/R 后認知功能的改善作用和對CREB/BDNF 通路的激活作用明顯被減弱,提示ATX 可能通過激活Sirt1 下調miR-134 的表達,進而激活CREB/BDNF 通路,然后對大鼠CI/R后認知功能發揮保護作用。
綜上所述,ATX 預處理可能通過調控Sirt1/miR-134 通路而激活CREB/BDNF 通路,進而減輕大鼠CI/R 后的認知功能障礙。本研究僅從動物水平上進行了初步探究,下一步將采用體外細胞實驗對此結論進行深入驗證。

