Li2MnSiO4/C鋰電池復合電極材料制備及電化學性能研究
華 麗,曾建華,胡慶蘭,歐小文,朱玉涵,劉俊逸,邵玉嬌,汪云凡
(1湖北第二師范學院 化學與生命科學學院,武漢 430205;2華中科技大學 材料科學與工程學院,武漢 430074)
鋰離子電池具有電壓高、比能量大、循環壽命長、放電性能穩定、安全性好、工作溫度范圍寬和環境友好等優點,成為新一代能源材料。但鋰電池的電極材料發展相對較為緩慢,是制約其商業應用的重要因素,因此,研究性能優異的電極材料十分重要。Li2MnSiO4作為鋰電池正極材料,具有充放電電壓區間較寬(1.5-4.8V),且當充電電壓達到4.8V,原則上可以使2個鋰離子完全脫出,理論比容量高達330mAh·g-1,[1]快接近于商業化石墨電極材料((372mAh·g-1),成為較大發展前途的電極材料之一。
目前制約著Li2MnSiO4正極材料進一步發展主要問題體現在單純的Li2MnSiO4電極材料導電率低,循環性能差等缺陷。[2]-[4]為了解決這些問題,一些改進方法如納米化、碳包覆、離子摻雜等被發展。[5]-[7]本文選用成本低且反應條件溫和、可以分子水平均勻混合的溶膠-凝膠法來制備碳摻雜的Li2MnSiO4/C納米化復合電極材料,并研究其電化學性能,以期獲得有用數據。
1 實驗
1.1 儀器和試劑
儀器:參考相關文獻[8]中報道:集熱式恒溫加熱磁力攪拌機(DF-101型,上海秋佐儀器設備有限公司);JJ-1精密定時電動攪拌器(江蘇省金壇市榮華儀器制造有限公司);80-2 離心機(湖南力辰儀器科技有限公司);數顯恒溫水浴箱(上海助藍儀器科技有限公司);真空干燥箱 ( 紹興市蘇珀儀器有限公司) ; ESEM 環境掃描電鏡(Quanta 200,FEI公司);X-射線衍射儀(XRD,/X'Pert PRO荷蘭帕納科公司 PANalytical B.V.);真空手套箱(上海卓的儀器設備有限公司);粒度分析儀(SACP3,英國馬爾文儀器公司);程序控溫的管式爐( 上海秋佐儀器設備有限公司) ;Land CT2001A電池檢測設備(武漢藍電電子有限公司);CS350 型電化學工作站(武漢科思特儀器有限公司),三口玻璃反應瓶(500mL),氮氣鋼瓶,精確值到±0.01 g的電子分析天平。
試劑:醋酸鋰(CH3COOLi·2H2O)、醋酸錳(Mn(CH3COO)2·4H2O)、檸檬酸均為晶體粉末(AR級),電解液為1MLiPF6的碳酸乙烯酯( EC) /碳酸二乙酯( DEC) ( 體積比為1∶1) 有機溶液( 張家港翔達電池材料有限責任公司) ,負極材料為制備活性Li2MnSiO4/C納 米 粒 子,正 極 為 高 純 金 屬 鋰 片 ( 純 度 >99.9%,惠州市拓普金屬材料有限公司),電池隔膜為微孔聚丙烯膜( Ceigad 2400)。氮甲基吡咯烷酮( NMP,CR,上海國藥試劑有限公司) ,導電乙炔黑(工業級,市售) ,無水乙二醇 ( AR級,國藥集團化學試劑公司);氨水(質量比,30%,國藥集團化學試劑公司),聚乙烯吡咯烷酮(PVP,K-30,粵東精細化工有限公司) 。聚偏氟乙烯(PVDF,分析純,浙江巨化股份有限公司氟聚廠)。
1.2 實驗步驟
1.2.1 Li2MnSiO4/C電極材料的制備
參考文獻,[9]采用溶膠-凝膠法合成Li2MnSiO4/C鋰電池正極材料,將一定量的SiO2氣凝膠溶于去離子水中,并在180W功率下,邊攪拌邊超聲水浴1 h后備用。同時配制摩爾比為1∶2的檸檬酸和乙二醇溶液作為絡合劑和碳源,緩慢滴加至超聲水浴后的SiO2溶液中,攪拌成均相溶液。將上述混合溶液在同樣的條件速度下滴加至按一定化學計量比的醋酸鋰(CH3COOLi·2H2O)、醋酸錳(Mn(CH3COO)2·4H2O)混合溶液中,攪拌均勻后用氨水調節pH值,并將所得溶液置于數顯恒溫水浴箱中80 ℃水浴至形成凝膠體,再將凝膠體于真空干燥箱中于60 ℃條件下干燥24 h形成干凝膠。取出冷卻至室溫后研細,然后置于通N2保護的管式爐中于400-500℃條件下(程序升溫,升溫速率為1℃/min))鍛燒數小時,冷卻后研細即為Li2MnSiO4/C材料以備用。為了對比,采用固相法結合高溫鍛燒法制備Li2MnSiO4電極材料。
1.2.2 電池組裝及電化學性能測試
方法見文獻[10],將制備的Li2MnSiO4/C樣品作為鋰電池正極材料即活性物質,然后將活性物質、乙炔黑和 PVDF 以 80∶10∶10的質量比混合均勻,加入適量的氮甲基吡咯烷酮(NMP)調成漿狀,均勻涂在鋁箔上,PVDF作為粘結劑,用紅外燈烘干,壓制成直徑0.8cm的圓形極片,并在120℃下真空干燥24h。以活性復合物電極為研究電極,1mol/L LiPF6/EC∶DEC (體積比= 1∶1)為電解液,金屬鋰片為對電極,在手套箱中裝配成模擬CR-2032型紐扣電池。并以50mA·g-1的電流密度在0.01~4.5V電壓范圍內用Land CT2001A電池程控測試儀進行恒電流充放電性能測試。為了研究其循環穩定性問題,采用不同倍率(0.2C,0.5C,1C,2C)條件下進行放電測試,測試的具體電流以所稱量電極片質量為準,充放電循環程序自己編寫。
交流阻抗測試(EIS):采用CS350 型電化學工作站(武漢科思特儀器有限公司)測試交流阻抗譜(EIS),在平衡態下測試電池阻抗的實部和虛部等參數,由此計算電極上發生電化學過程的各個參數,交流電壓信號的振幅為 5mV,測試頻率范圍為 1mHz~1MHz,測試采用扣式電池體系。
1.2.3 性能表征
用XRD和SEM分別表征樣品的晶體結構和表面形貌。XRD掃描范圍為5~80°。通過掃描電子顯微鏡(SEM)觀察樣品的微觀形貌。恒流充放電測試:主要通過以下幾個方面衡量制備的正極材料性能的優劣:電池的比容量,首次庫侖效率,容量保持率,倍率性能,電池阻抗等。電池的充放電性能測試使用Land CT2001A電池檢測設備,設定一定的充放電電壓區間和充放電電流,充放電循環程序自己編寫。
2 結果與討論
2.1 ESEM電鏡圖
圖1為Li2MnSiO4/C復合材料ESEM電鏡圖(其中a:17884X;b:4531X;c:32000X;d:103099X),從中可知,Li2MnSiO4/C復合材料呈納米顆粒狀,粒徑約30-50nm,顆粒比較均勻一致,相互之間沒有粘結,單分散性好。

圖1 Li2MnSiO4/C復合材料ESEM電鏡圖(其中a: 17884X;b: 4531X;c: 32000X;d: 103099X)
2.2 XRD分析
在合成材料時,選擇反應溫度為450℃進行鍛燒,得到Li2MnSiO4/C復合材料的XRD圖譜(見圖2)。進一步分析合成的Li2MnSiO4/C復合材料的XRD圖譜,圖中標出各個衍射峰對應的晶面,其中[010]、[011]、[200]、[210]、[002]晶面對應的衍射角與Li2MnSiO4晶體完全一致,也與Ghosh、[11]Hwang[12]等人報道的Li2MnSiO4晶體一致,屬于正交晶系Pmn21空間群。未發現碳的衍射峰,可能碳主要以無定形的形式出現的,當然也有極少量雜質峰如Li2SiO3的衍射峰。這可能與鍛燒溫度有關。
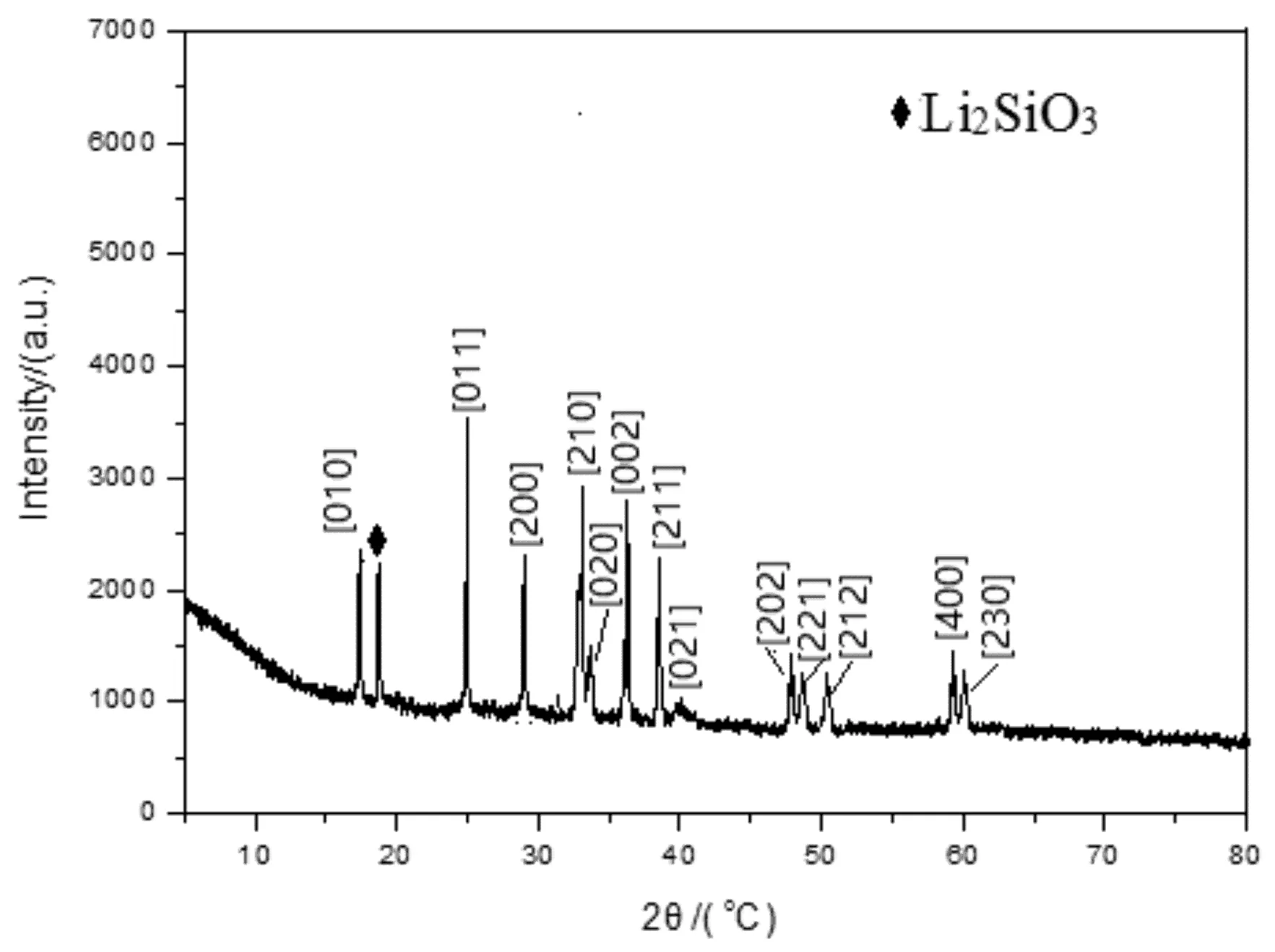
圖2 Li2MnSiO4/C復合材料的XRD圖譜
2.3 恒電流下充放電測試
圖3為恒電流條件下Li2MnSiO4/C正極的充放電曲線(電流密度為50mA/g=0.2C)。從中可知,樣品的充放電曲線及變化都與文獻報道相似[13],電極在3.0-4.0V處有較穩定的充放電平臺。經過第一次循環過后,放電曲線明顯變陡,向高電位移動,原因是Mn2+向Mn3+轉化,其反應可以表示為:Li2MnSiO4→LiMnSiO4+ Li++e,第一個Li+脫出;當然也存在第二個Li+脫出(Mn3+向Mn4+轉化LiMnSiO4→MnSiO4+Li++e),但第二個Li+在更高電壓如4.5V-4.8V之間更易脫出,為了控制第二個Li+氧化脫出和電解液在高電壓范圍內不穩定,充放電電壓控制在4.5V以下。從圖3中可知,首次充放電比容量分別為153.6和144mAh/g,50次循環后充放電比容量分別為140和134mAh/g,100次循環后充放電比容量分別為131和125mAh/g;經過200次充放電循環后比容量依然保持在61和60mAh/g。
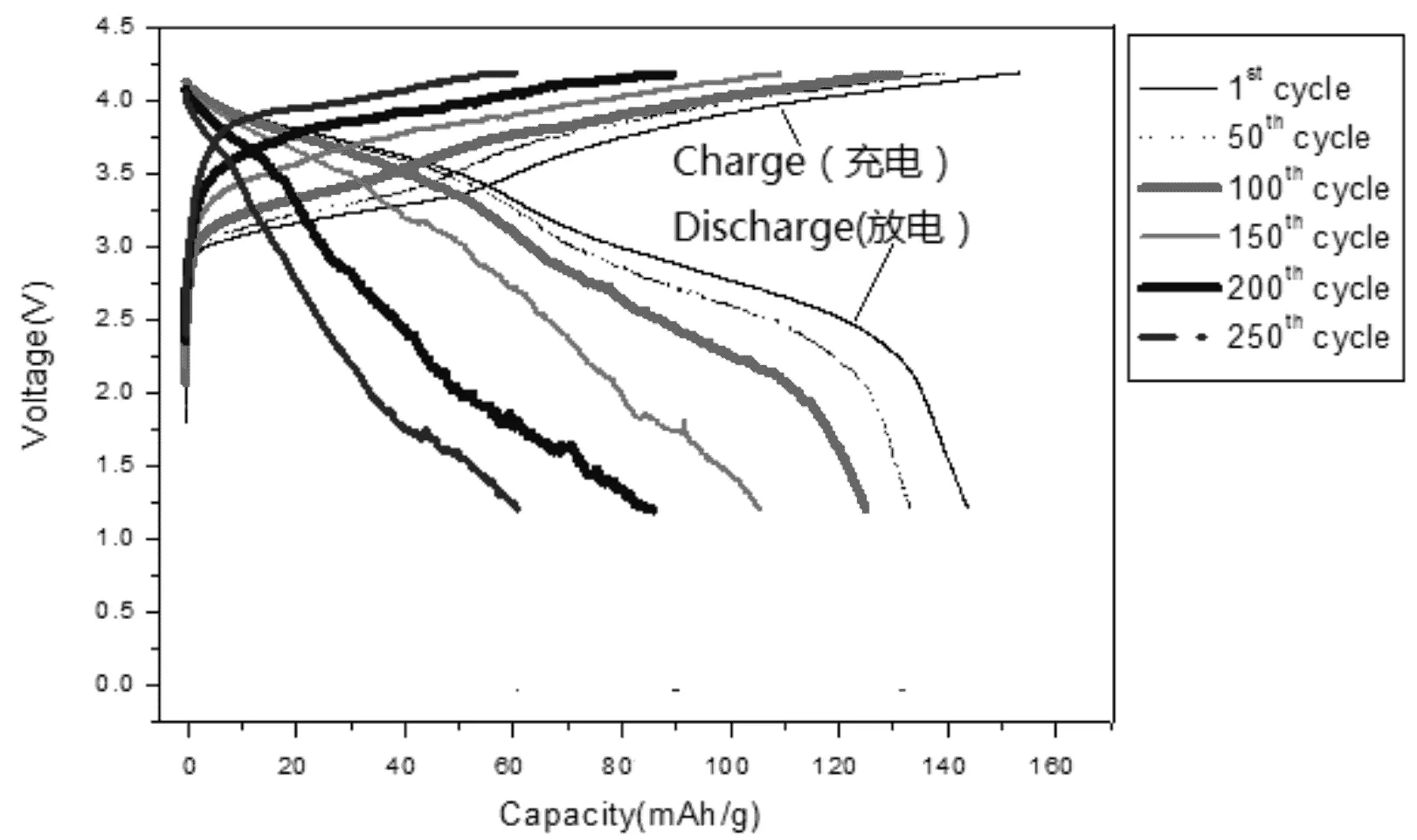
圖3 恒電流條件下Li2MnSiO4/C正極的充放電曲線(電流密度為50mA/g=0.2C)
2.4 不同倍率下循環穩定性測試
圖4為不同倍率下Li2MnSiO4/C電極材料的循環性能測試曲線圖。實驗采用在0.2C、0.5C、1C、2C高和低倍率0.2C下,對Li2MnSiO4/C電極材料組裝成的扣式鋰電池進行循環性能測試,每組循環次數為30次,比較其放電平臺的比容量。從中可知0.2C,在0.2C(0.2C=50mA/g,依此進行計算)倍率下,其放電比容量基本穩定在144-141mAh/g之間;在0.5C倍率下,其不夠穩定,在142-134mAh/g之間波動,波動輻度為8mAh/g;在1C倍率下,相對更不穩定,在130-110mAh/g左右波動,且波動幅度較0.5C條件下大;在2C倍率下,相對更不穩定,在105-71mAh/g左右波動,且波動幅度更大;經過了四種不同倍率的循環后,再回到0.2C倍率下測試,同樣能保持放電比容量基本穩定在144-140mAh/g之間,且比高倍率2C條件下穩定得多。因此,可以得出結論,經過多次循環后,Li2MnSiO4/C復合電極材料在低電流密度下充放電相對較為穩定,高倍率下電流密度越大充放電越不穩定,可能與電極材料出現粉化導致電極表面極化電阻增大所致。
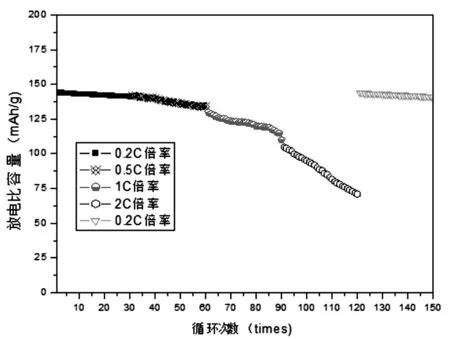
圖4 不同倍率下Li2MnSiO4/C電極材料的循環性能測試曲線
2.5 交流阻抗(EIS)曲線
圖5為Li2MnSiO4和Li2MnSiO4/C電極材料在0.2C倍率下首次放電后的交流阻抗譜圖(EIS)(其中a為Nyquist 圖,b為Bode 圖,c為等效電路圖)。通過圖形可以知道高頻區的半圓和低頻區的直線組成了兩條譜圖。圖5c中的等效電路模擬可以表示兩條阻抗曲線,擬合數據見
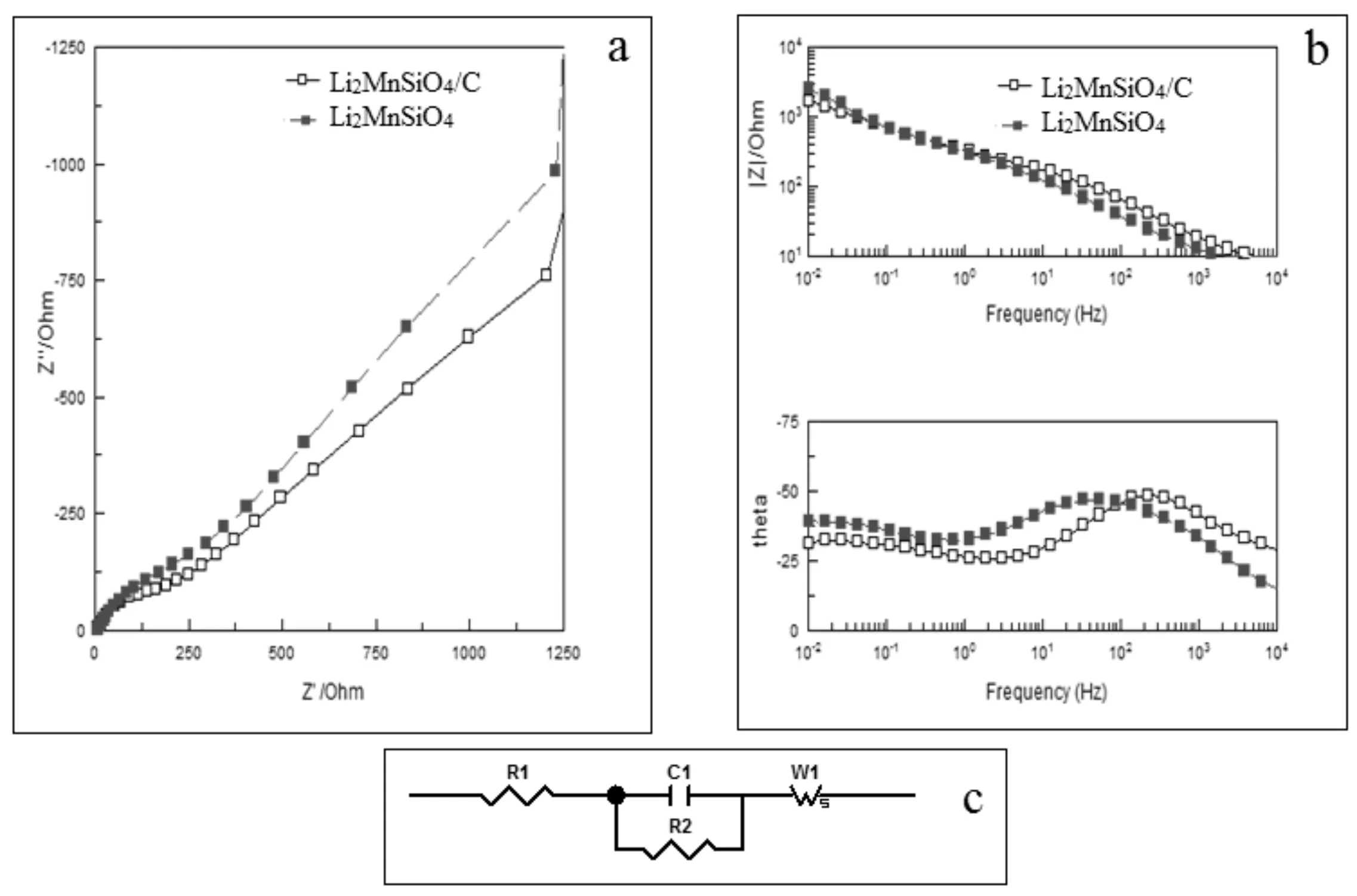
圖5 Li2MnSiO4和Li2MnSiO4/C電極材料在0.2C倍率下首次放電后的交流阻抗譜圖(EIS)(其中a為Nyquist 圖, b為Bode 圖, c為等效電路圖)
表1所示。等效電路圖中的電化學參數涵義如下:高頻半圓與阻抗實軸Z’的截距為接觸電阻R1(電解液電阻和電極接觸電阻);電極表面電化學反應的電荷轉移電阻R2是高頻區的半圓部分;C1為雙電層電容;因為Li+在電解液中半無限擴散所以出現了低頻區直線,代表半無限邊界條件下的Wurburg擴散阻抗Ws(包括Ws-T和Ws-p)。從表1結果可以看出其Li2MnSiO4/C電極材料的接觸電阻R1、電極表面電荷轉移電阻R2、和擴散阻抗Ws均比Li2MnSiO4電極材料要小,主要原因是碳具有較好的導電性,提高了其Li2MnSiO4/C電極表面電導率,減小了鋰離子Li+脫嵌時綜合電阻。由此可見,碳摻雜是有利于提高Li2MnSiO4電極材料的電化學性能。

表1 Li2MnSiO4和Li2MnSiO4/C電極材料等效電路擬合結果
3 結論
用檸檬酸和乙二醇溶液作為碳源,以醋酸鋰和醋酸錳分別提供鋰離子和錳離子,通過溶膠凝膠法制備Li2MnSiO4/C復合正極材料。其XRD圖譜表明Li2MnSiO4為正交結構,且碳主要以無定性形式存在。進行恒流充放電性能測試結果表明,該材料在電壓控制4.5V以下,經過200次充放電循環后比容量依然保持在61和60mAh/g。在不同倍率下循環穩定性測試結果表明,高倍率下電流密度越大充放電越不穩定。交流阻抗測試結果顯示:對比Li2MnSiO4,Li2MnSiO4/C電極材料的接觸電阻R1、電極表面電荷轉移電阻R2和擴散阻抗Ws均要小,表明碳復合有利于提高Li2MnSiO4電極材料的電化學性能。

