結合空洞卷積的多尺度腦腫瘤分割算法
顏丙寶,曹秒,李夢媛
(長春理工大學 生命科學技術學院,長春 130022)
腦膠質瘤是腦組織中異常生長的細胞[1],被認為是最常見的原發性惡性腦腫瘤。2016年,全球共確診神經系統腫瘤約33萬例,死亡22.7萬例[2]。核磁共振成像(MRI)對軟組織具有高成像分辨率的優點,可以更清晰地顯示腦腫瘤的細節特征,已經成為腦腫瘤檢測的標準方法[3]。
目前,臨床上主要依靠專家對腦腫瘤的手動分割,這會耗費大量時間,并且對醫生的專業經驗要求較高[4],所以腦腫瘤的自動分割方法成為必然趨勢。Pereira等人[5]使用3×3卷積核和塊訓練的方法進行網絡的訓練,用于腦腫瘤的分割,實驗證明在相同感受野的情況下,小卷積核可以減少網絡的參數。Havaei M[6]同時使用局部信息和全局信息進行深度神經網絡的訓練。U-Net[7]網絡的編解碼結構提高了全卷積神經網絡對生物醫學圖像分割的準確率。劉璐[8]通過數據增強方法提高模型的泛化能力。
本文提出了一種結合空洞卷積的多尺度特征提取的腦腫瘤圖像自動分割算法(Automatic Segmentation of Brain Tumor Image Based on Multiscale Feature Extraction Combined with Dilate Con‐volution,MD-unet),采用端到端的訓練方法,解決了塊訓練方式忽略圖像空間信息的問題,并選擇T1ce、T2和flair三種模態進行訓練。MD-unet網絡對完整腫瘤的DSC系數為0.86,優于U-Net方法。
1 多尺度特征提取模塊
全卷積神經網絡[9]主要包含卷積層、激活函數、池化層、連接層和反卷積層。通過卷積層提取特征;激活函數的作用是引入非線性因素;池化層通過降低特征圖的尺寸來增大感受野,提高單個像素包含的信息;反卷積層用來恢復特征圖的分辨率;連接層可以將下采樣過程獲得信息傳遞到上采樣過程,提高淺層信息的利用率。
1.1 空洞卷積
池化操作是2×2卷積核,步長為2的卷積過程,該過程可以通過降低分辨率的方法獲得較大的感受野。而空洞卷積可以通過調整膨脹率(r)的值來控制感受野的大小,不改變特征圖的分辨率。空洞卷積的計算如下:

式中,yi是空洞卷積輸出;r為空洞卷積的膨脹率;k代表的是卷積的權重。當r=1時,感受野為3×3,是標準卷積;當r=2時,感受野達到了5×5;當r=3時,該卷積核的感受野達到了7×7。
1.2 多尺度特征提取模塊
通過1.1節可知,空洞卷積的感受野隨著r的增長呈指數增加,如果使用空洞卷積進行特征提取,相同數量的參數可以獲得更大的感受野。本文設計了如圖1所示的多尺度特征提取模塊。卷積后的特征圖經過三次不同感受野的空洞卷積(空洞卷積的膨脹率分別為1,3,5),將每次空洞卷積獲得特征圖堆疊在一個列表中,然后通過一次卷積操作進行特征融合。MD模塊在設計上充分利用了每次空洞卷積的結果,又達到了多尺度提取特征的要求。
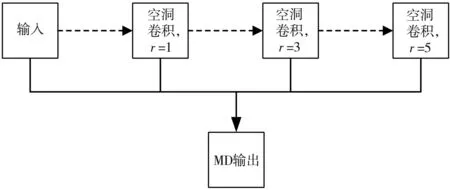
圖1 多尺度特征提取模塊
2 多尺度特征提取的全卷積神經網絡
圖2所示的是MD-unet,左側是下采樣過程,每個特征提取層包含兩個3×3標準卷積和一個MD模塊,右側表示的是上采樣過程。卷積操作1_2表示的是網絡中第一層的第二次3×3卷積核進行特征提取的過程,其中64代表的是該操作的卷積核的數量;MD模塊用于提取不同感受野的特征;通過池化操作后,特征圖的分辨率會降低一半,通道數增加一倍;上采樣過程采用雙線性插值的方法來恢復圖像的分辨率,由于池化操作會丟失圖像的一些像素點,所以在上采樣后,通過copy and crop層與下采樣過程中相對應的特征圖進行拼接,然后經過3×3卷積操作進行特征融合,提高了淺層特征的利用率;最終經過一個1×1的卷積層輸出,分類函數采用的是softmax函數。MD-unet采用非線性修正函數(ReLU)作為激活函數,并且對每次卷積結果進行歸一化操作,解決了梯度消失的問題。

圖2 多尺度特征提取的全卷積神經網絡
在網絡的訓練過程中,真值標簽大部分為背景區域,容易引起類別不平衡問題。本文首先對labels進行邊緣提取,將邊緣作為系數與交叉熵損失函數相乘,得到新的損失函數L,提高損失函數中腫瘤區域的權重,有利于收斂。

式中,li代表的是真值標簽;EG(x,y)代表真值標簽的邊緣特征;L(x,y)代表交叉熵損失函數。通過提高邊緣權重可以有效解決類別不平衡的問題。
3 MD-unet腦腫瘤分割及結果評價
本文使用的深度學習框架為google開發的tensorflow框架。使用Adam optimizer優化器對網絡進行優化。網絡參數設置如表1所示,學習率設置為0.000 1,訓練和測試的最小批為14,訓練次數為80。

表1 網絡參數設置
3.1 MD-unet腦腫瘤分割流程
如圖3所示為本文工作的流程圖。首先對數據進行預處理操作,該過程包括偏場矯正和數據歸一化操作,預處理過程采用python第三方庫相應的函數進行,然后對其進行數據增強操作,最后進行網絡的訓練和驗證。
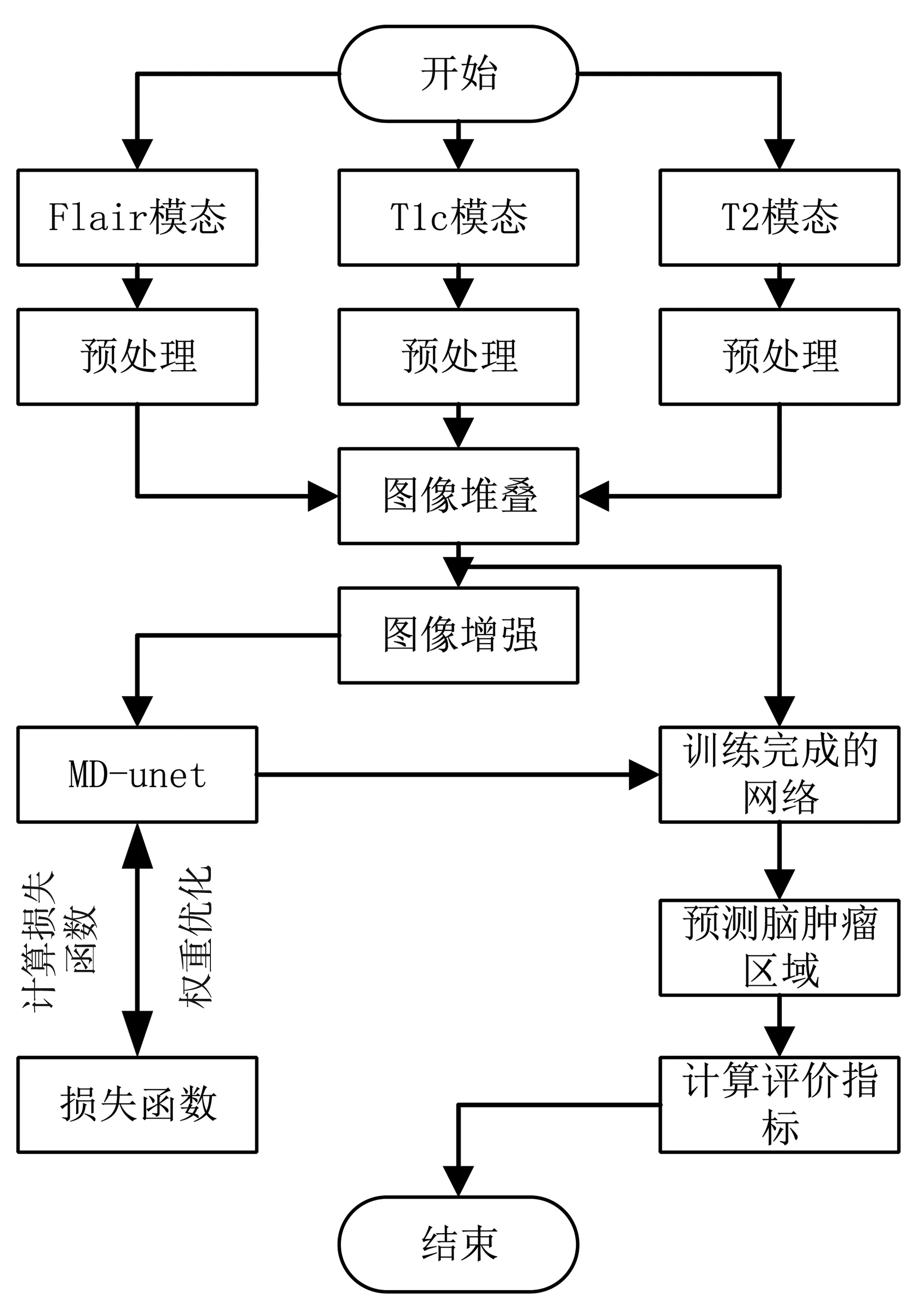
圖3 本文工作流程圖
3.2 腦腫瘤數據庫
MD-unet網絡在BraTS’17數據集進行了有效性驗證。該數據集是由醫學圖像計算和計算機輔助干預會議舉辦的多模態腦腫瘤分割挑戰賽提供,共包含285個腦腫瘤患者的病例,其中高級別膠質瘤(HGG)210例,低級別膠質瘤(LGG)75例。專家手工分割真值標簽包含3種labels:1代表壞死區和非增強區,2代表的是水腫區,4代表的是增強區,0代表的是背景區域。
實驗將數據集分為訓練集和測試集。訓練集用作網絡的訓練,包含160幅HGG和55幅LGG。測試集用作網絡分割能力的評估。
3.3 MD-unet分割結果及評價
本文采用的評價指標是Dice相似性系數(Dice Similarity Cofficient,DSC)。DSC通過計算分割結果與真值標簽之間的重合度來反映分割結果與真值標簽的相似程度,DSC的取值范圍是[0,1],取值越接近1,代表分割結果越準確,定義如下:
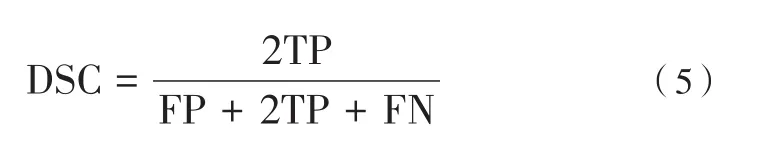
其中,TP、FP、FN代表預測結果中的真陽性、假陽性、假陰性。
表2是兩種方法對腦腫瘤不同區域的分割結果的DSC數值,第一行代表的是U-Net網絡的分割結果,第二行是本文算法分割的結果。從表2可以看出,MD-unet網絡在完整腫瘤、核心區、增強區DSC系數比U-Net網絡分別高3%、12%、10%。由于核心區與增強區的灰度值與周圍組織相近,所以導致分割精度較低,但是相對于U-Net網絡,MD-unet模塊表現出較好的特征提取能力。
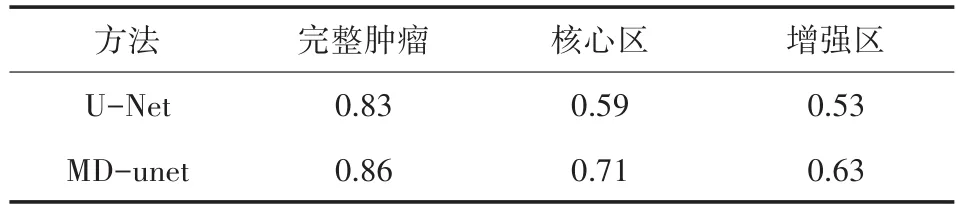
表2 MD-unet和U-net網絡對不同區域的分割結果的平均DSC系數
圖4是MD-unet網絡對LGG的分割結果,圖中a代表的是Flair模態,b為T1ce模態,c代表的是T2模態,d為專家手工分割的真值標簽,e是本文算法的預測結果。從圖4可以看出,MD-unet可以完整地分割出腫瘤區域并保留了細節特征。從e和a看到腫瘤區域的右下角是有一個彎鉤狀的區域,雖然在真值標簽中沒有體現,但是本文算法也準確地分割出來。

圖4 本文算法對LGG的分割
圖5為本文算法對HGG的分割,HGG的邊界比較模糊,伴隨有水腫區域,對周圍組織的浸潤比較嚴重等因素的存在導致HGG的分割一直是一個難題。但是本文算法可以清晰完整地分割出HGG的邊界,并且對腫瘤的一些較小區域也進行了準確的識別。
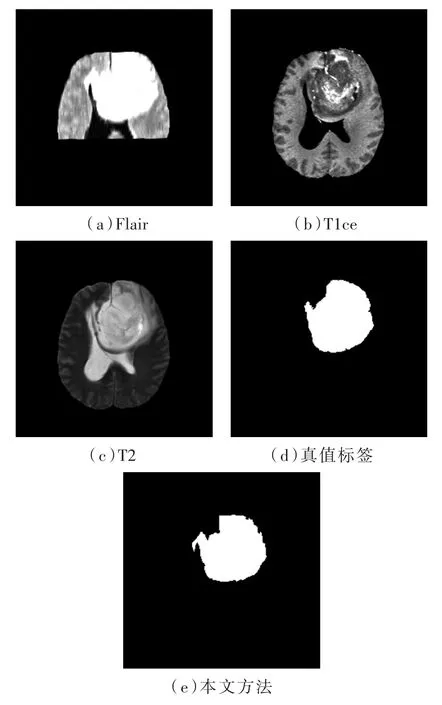
圖5 本文算法對HGG的分割
4 結論
本文提出了一種結合空洞卷積的多尺度特征提取的腦腫瘤自動分割方法。其編解碼結構和連接層的使用,可以充分的利用淺層信息。通過多尺度特征提取模塊實現了多感受野的特征提取,輸出結果不僅包含全局信息,也包含了3×3感受野的局部特征。通過在BraTS’17數據庫的驗證,MD-unet網絡在三種不同位置的分割結果均優于U-Net網絡。

