安羅替尼聯(lián)合多西他賽二線治療晚期肺鱗癌的臨床研究(ChiCTR1900020917)
謝王踢 翁潔 文芳 沈二棟 羅盤

【摘要】目的 探討安羅替尼聯(lián)合多西他賽二線治療晚期肺鱗癌的療效及安全性。方法 選取2019年1月至2020年6月本院收治的晚期肺鱗癌患者30例,隨機(jī)分為聯(lián)用組(n=15)和單藥組(n=15)。聯(lián)用組給予安羅替尼(12mg·d-1,第1天至第14天,21天為一個周期)聯(lián)合多西他賽(60 mg·m-2,靜脈滴注,第1日)治療。單藥組給予多西他賽單藥(60 mg·m-2,靜脈滴注,第1日)治療,直至疾病進(jìn)展(PD)或不良反應(yīng)不可耐受。分析兩組患者的總有效率、疾病控制率(DCR)、不良事件發(fā)生率、無進(jìn)展生存期(PFS)。結(jié)果 中位隨訪時間16.6個月,聯(lián)用組和單藥組的DCR分別為82.35%和31.15%,兩組相比有 顯著差異(P=0.005);聯(lián)用組最常見的Ⅲ~Ⅳ級不良事件為粒細(xì)胞減少(6.67%),與單藥組(6.67%)比較差異無顯著意義(P=0.701)。聯(lián)用組和單藥組的中位PFS 分別為7.2個月(95%CI:6.5~14.2)和 2.4個月(95%CI:1.4~3.4),兩者相比,差異有顯著意義(P=0.005)。結(jié)論 ?安羅替尼聯(lián)合多西他賽二線治療晚期肺鱗癌療效顯著,不良反應(yīng)可控,值得臨床推廣。
【關(guān)鍵詞】多西他賽;安羅替尼;肺鱗癌;二線治療
基金項目:岳陽市科技局一般項目(2019YY0065)
[中圖分類號] ?R734.2 ? ? ? ? ?[文獻(xiàn)標(biāo)志碼] ? A
肺癌是全球目前發(fā)病率及死亡率最高的惡性腫瘤,其中約80%以上為非小細(xì)胞肺癌(non-small cell lung cancer,NSCLC),大部分患者一經(jīng)確診已為晚期,治療難度非常大。國內(nèi)外臨床上治療驅(qū)動基因陽性晚期肺鱗癌一線治療首選靶向治療,無驅(qū)動基因的晚期肺鱗癌一線首選免疫治療或/和含鉑雙藥聯(lián)合化療,但大部分晚期肺鱗癌患者因缺乏明確驅(qū)動基因的靶向治療,另外免疫治療費用太高,而選擇含鉑雙藥聯(lián)合化療后會因先后出現(xiàn)耐藥而最終復(fù)發(fā)或轉(zhuǎn)移。多西他賽(docetaxel)單藥為晚期肺鱗癌標(biāo)準(zhǔn)的二線化療方案之一,其有效率只有10%左右。如何提高晚期肺鱗癌二線治療的療效是目前的研究方向與熱點,其中抗血管生成治療聯(lián)合化療是目前臨床研究的熱點之一,安羅替尼(anlotinib)作為我國自主研發(fā)的新型小分子抗血管生成靶向藥物,具有很強(qiáng)的抗血管生成活性及口服給藥方便等特點,已在晚期肺腺癌中顯示出良好療效。本研究旨在探索安羅替尼聯(lián)合多西他賽作為二線治療方案在晚期肺鱗癌中的療效及安全性。
1 資料與方法
1.1研究對象 ? 選擇本院腫瘤科2019年1月至2020年6月收治的晚期肺鱗癌患者。納入標(biāo)準(zhǔn):(1)病理及細(xì)胞學(xué)檢查明確為外周型肺鱗癌;(2)年齡≥18 歲;(3)一線治療后進(jìn)展;(4)化療前血常規(guī)、血生化及心電圖等檢查無異常;(5)卡氏評分(KPS評分)≥60分;(6)預(yù)計生存期>3個月。排除標(biāo)準(zhǔn):(1)一線治療已行包含多西他賽藥物化療;(2)依從性差;(3)有嚴(yán)重的基礎(chǔ)疾病者(包括高血壓及糖尿病未控,有出血傾向或正接受抗凝治療者);(4)近期曾有超過2 mL出血史。經(jīng)篩選后共納入30例患者,經(jīng)本院腫瘤科病例隨訪系統(tǒng)隨機(jī)分組:分為多西他賽單藥治療組(單藥組)15例和安羅替尼聯(lián)合多西他賽治療組(聯(lián)用組)15例。
1.2分組及給藥 ?本研究方案經(jīng)岳陽市一人民醫(yī)院醫(yī)學(xué)倫理委員會審查批準(zhǔn),所有患者治療前均被告知目前標(biāo)準(zhǔn)治療方案及替代治療方案并簽署知情同意書。采用電腦隨機(jī)分組,分為聯(lián)用組(n=15)及單藥組(n=15),聯(lián)用組給予安羅替尼12 mg·d-1治療(生產(chǎn)廠家:正大天晴制藥,批號:國藥準(zhǔn)字H20180004,規(guī)格:12mg*7片,po,第1日至第14日,21 d為1個周期)。多西他賽75 mg·m-2 (生產(chǎn)廠家:江蘇恒瑞制藥,批號:國藥準(zhǔn)字H20020543,規(guī)格:20mg*1支,靜脈滴注,第1日)聯(lián)合單藥組給予多西他賽(60 mg·m-2,靜脈滴注,第1日)單藥治療,直到疾病進(jìn)展或出現(xiàn)不可耐受的不良反應(yīng)。出現(xiàn)Ⅳ級骨髓抑制者下個周期化療藥物劑量降低25%。如出現(xiàn)Ⅲ~Ⅳ級安羅替尼相關(guān)不良事件,則安羅替尼依次減量至每日10 mg/8mg。
1.3觀察指標(biāo) ?本研究的主要觀察指標(biāo)為無進(jìn)展生存期(PFS),次要觀察指標(biāo)為總緩解率(ORR)、疾病控制率(DCR)及不良反應(yīng)。
1.4評定標(biāo)準(zhǔn) ?療效評價參照RECIST 1.1版,其中療效評價包括完全緩解(CR)、部分緩解(PR)、疾病穩(wěn)定(SD)和疾病進(jìn)展(PD); ORR= (CR+PR)/總例數(shù)×100%;DCR=(CR+PR+SD)/總例數(shù)×100%,每2個周期化療后復(fù)查頭部MRI及頸胸腹部CT進(jìn)行療效評價。不良反應(yīng)參照國家癌癥研究所(NCI)指定的CTCAE 4.0版關(guān)于不良反應(yīng)的評價標(biāo)準(zhǔn)。我科為國家臨床藥物試驗基地之一,患者數(shù)據(jù)根據(jù)我科登記隨訪系統(tǒng)進(jìn)行統(tǒng)計。所有患者采用返院復(fù)查或電話方式隨訪,主要針對日間化療患者。
1.5統(tǒng)計學(xué)分析 ?所有數(shù)據(jù)采用 SPSS22.0分析處理,定性資料采用卡方檢驗,定量資料組間比較采用t檢驗,生存分析采用Kaplan-Meier法,生存期組間比較采用Log-rank法,均以P<0.05 為差異有顯著意義。
2 結(jié) ?果
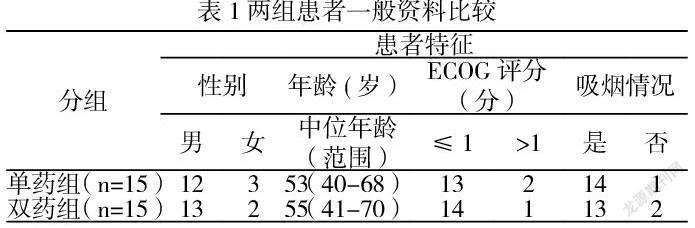
2.1一般資料 ?本研究共納入33例晚期肺鱗癌患者,其中3例患者因治療期間使用其他抗腫瘤治療而退組,共納入研究30例患者,電腦隨機(jī)分為兩組,其中聯(lián)用組15例,男性13例,女性2例,中位年齡55歲;單藥組15例,男性12例,女性3例,中位年齡53歲,兩組各項資料均具有可比性,無顯著差異(P>0.05),見表1。
2.2療效分析 ?聯(lián)用組中位化療8.4(4~20)個周期,單藥組中位化療2.8(2~10)個周期。兩組均無患者達(dá)到CR。聯(lián)用組和單藥組的ORR分別為28.67%和10.62%,兩組相比差異有統(tǒng)計學(xué)意義(P=0.03);聯(lián)用組和單藥組的DCR分別為82.35%和31.15%,兩組相比差異有顯著意義(P=0.005)。
2.3不良事件及安全性分析 ?聯(lián)用組最常見的不良反應(yīng)為Ⅲ-Ⅳ級粒細(xì)胞減少。聯(lián)用組和單藥組Ⅲ~Ⅳ級粒細(xì)胞減少發(fā)生率分別為6.67% 和6.67%,兩者相比差異無顯著意義(P=0.701)。聯(lián)用組中手足綜合癥1例、蛋白尿1例、咯血1例、高血壓1例,靜脈血栓2例,均為Ⅰ~Ⅱ級,見表3。
2.4隨訪及PFS ?本研究隨訪至2021年3月,中位隨訪16.6個月。聯(lián)用組3例患者需化療劑量減量,1例患者安羅替尼減量至每日8mg(咯血患者),沒有治療相關(guān)性死亡。聯(lián)用組和單藥組的中位PFS 分別為7.2個月(95%CI:6.5~14.2)和 2.4 個月(95%CI:1.4~3.4),兩者相比差異有顯著意義(P=0.005),見圖1。
3 討 ?論
肺鱗癌為非小細(xì)胞肺癌常見病理類型,其發(fā)病率約占非小細(xì)胞肺癌的40%左右。絕大多數(shù)晚期肺鱗癌患者驅(qū)動基因陰性缺乏靶向治療,含鉑雙藥化療是晚期肺鱗癌的標(biāo)準(zhǔn)一線治療方案。除了化療外,PD-1/PD-L1抑制劑免疫治療也成為晚期肺鱗癌的一線標(biāo)準(zhǔn)治療方案,KEYNOTE-042研究結(jié)果顯示帕博利珠單抗單藥較化療能顯著延長PFS(中位10.3個月 vs. 6.0個月)且不良反應(yīng)發(fā)生率低于化療組。KEYNOTE-407研究結(jié)果顯示帕博利珠單抗單藥聯(lián)合化療較單純化療能顯著延長PFS(中位6.4個月 vs. 4.8個月)且不良反應(yīng)未顯著增加。然而,大多數(shù)患者經(jīng)歷一線化療后10個月內(nèi)會出現(xiàn)疾病進(jìn)展。既往的Ⅲ期多中心隨機(jī)對照試驗證實單藥多西他賽或吉西他濱是晚期肺鱗癌標(biāo)準(zhǔn)的二線治療方案,然而近年來OAK研究及KEYNOTE-010研究結(jié)果均顯示免疫治療較單純化療在晚期肺鱗癌患者二線治療中均有OS獲益,PD-1/PD-L1抑制劑免疫治療也已成為晚期肺鱗癌的二線治療新標(biāo)準(zhǔn)。
安羅替尼是一種新型小分子多靶點酪氨酸激酶抑制劑, 能有效地抑制血管內(nèi)皮細(xì)胞生長因子受體( Vascular endothelial growth factor receptor,VEGFR) 、血小板衍生生長因子受體(Platelet-derived growth factor receptors,PDGFR)、成纖維生長因子受體和干細(xì)胞生長因子受體等激酶的活性,進(jìn)而發(fā)揮抗腫瘤血管生成和抑制腫瘤生長的作用。ALTER0303研究中病理類型亞組分析結(jié)果顯示,肺腺癌和肺鱗癌患者均可從鹽酸安羅替尼治療中獲益,目前CSCO肺癌指南推薦三線應(yīng)用安羅替尼治療晚期肺腺癌。
本研究結(jié)果顯示,聯(lián)用組在晚期肺腺癌的二線治療中顯示出良好療效。其中聯(lián)用組和單藥組的中位PFS 分別為7.2個月和2.4個月,兩組的ORR分別為28.67%和10.62%,DCR分別為82.35%和31.15%,兩組比較差異均具有統(tǒng)計學(xué)意義。
安羅替尼常見的不良反應(yīng)包括粒細(xì)胞減少、血小板減少、高血壓、蛋白尿和手足綜合征等,本研究中聯(lián)用組的不良反應(yīng)均有所提高,其中主要為Ⅲ-Ⅳ級粒細(xì)胞減少,為化療減量的主要原因。1例患者出現(xiàn)咯血,為安羅替尼減量的主要原因。安羅替尼相關(guān)的其他不良反應(yīng)如手足綜合征、高血壓、蛋白尿、靜脈血栓形成均為Ⅰ~Ⅱ級。結(jié)果顯示聯(lián)合治療的不良反應(yīng)總體可控。
綜上所述,聯(lián)用組與單藥組相比,可顯著提高晚期肺鱗癌二線治療的ORR、DCR及中位PFS;另外,安羅替尼聯(lián)合多西他賽治療的不良反應(yīng)可控,值得臨床推廣。然而本研究樣本較少,結(jié)論的可靠性還有待于前瞻性的多中心隨機(jī)對照研究進(jìn)一步證實。
參考文獻(xiàn):
[1] Bray F, Ferlay J, Soerjomataram I,et al. Erratum: Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2020,70(4):313.
[2] Weihua Li , Lei Guo , Yutao Liu,et al. Potential Unreliability of Uncommon ALK, ROS1, and RET Genomic Breakpoints in Predicting the Efficacy of Targeted Therapy in NSCLC[J]. J Thorac Oncol, 2021, 16(3):404-418.
[3] Evgeny N Imyanitov, Aglaya G Iyevleva, Evgeny V Levchenko. Molecular testing and targeted therapy for non-small cell lung cancer: Current status and perspectives[J]. Crit Rev Oncol Hematol, 2021, 157:103194.
[4]Mok T, Wu YL, Kudaba I, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEY-NOTE-042) : a randomised, open-label, controlled, phase 3 trial[J]. Lancet , 2019, 393 (10183) : 1819-1830.
[5]Wu Y, Zhang L, Fan Y, et al. KEYNOTE-042 China Study: first-line pembrolizumab vs chemotherapy in Chinese patients with advanced NSCLC with PD-L1 TPS >= 1%[J]. J Thorac Oncol, 2019, 14 (10) : S290-S291.
[6]Paz-Aresl, Lufl A, Vicente D, et al. Pembrolizumab plus chemotherapy for squamous non-small-cell lung cancer[J]. N Engl J Med, 2018, 379 (21) : 2040-2051.
[7] Schiller JH, Harrington D, Belani CP, et al. Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer[J]. N Engl J Med, 2002, 346 (2) : 92-98.
[8]Scahliotti GV, Parikh P, Vonpawel J, et al. Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer[J]. J Clin Oncol, 2008, 26 (21) : 3543-3551.
[9] Fossella FV, Devore R, Kerr RN, et al. Randomized phase III trial of docetaxel versus vinorelbine or ifosfamide in patients with advanced non-small-cell lung cancer previously treated
with platinum-containing chemotherapy regimens. The TAX 320 Non-Small Cell Lung Cancer Study Group[J]. J Clin Oncol, 2000, 18 (12) : 2354-2362.
[10] Han B, Li K, Wang Q, et al. Effect of anlotinib as a third-line or further treatment on overall survival of patients with advanced non-small cell lung cancer: The ALTER 0303 Phase 3 Randomized Clinical Trial[J]. JAMA oncol, 2018, 4 (11) : 1569-1575.
[11]劉艷華,張有為,李勁松,等.安羅替尼治療無敏感突變型 晚期肺鱗癌一例[J].中華腫瘤雜志,2019,41(6):447-448.
[12]Tony SK Mok , Yi-Long Wu , Iveta Kudaba, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial[J]. Lancet, 2019 ,393(10183):1819-1830.
[13]Luis Paz-Ares, David Vicente, Ali Tafreshi, et al. A Randomized, Placebo-Controlled Trial of Pembrolizumab Plus Chemotherapy in Patients With Metastatic Squamous NSCLC: Protocol-Specified Final Analysis of KEYNOTE-407[J]. J Thorac Oncol, 2020, 15(10):1657-1669.
[14]Brodowicz T, Krzakowski M, Zwitter M, et al. Cisplatin and gemcitabine first-line chemotherapy followed by maintenance gemcitabine or best supportive care in advanced non
-small cell lung cancer: a phase III trial[J]. Lung Cancer, 2006, 52 (2) : 155-163.
[15]Rittmeyer A, Barlesi F, Waterkamp D, et al. Atezolizumab versus docetaxel in patients
with previously treated non-small-cell lung cancer (OAK) : a phase 3, open-label, multicentre randomised controlled trial[J]. Lancet, 2017, 389 (10066) : 255-265.
[16]Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1 positive, advanced non-small-cell lung cancer (KEYNOTE-010) : a randomised controlled trial[J]. Lancet, 2016, 387 (10027) : 1540-1550.
[17] Binyan Lin, Xiuming Song, Dawei Yang, et al. Anlotinib inhibits angiogenesis via suppressing the activation of VEGFR2, PDGFRβ and FGFR1[J]. Gene, 2018, 654:77-86.
[18]Chengying Xie, Xiaozhe Wan, Haitian Quan, et al. Preclinical characterization of anlotinib, a highly potent and selective vascular endothelial growth factor receptor-2 inhibitor[J]. Cancer Sci, 2018, 109(4):1207-1219.
[19]中國臨床腫瘤學(xué)會指南工作委員會. 中國臨床腫瘤學(xué)會(CSCO)原發(fā)性肺癌診療指南[M]. 北京:人民衛(wèi)生出版社,2020:89.
[20]石凱遠(yuǎn). 鹽酸安羅替尼治療晚期肺癌中國專家共識(2020版)[J]. 中華腫瘤雜志, 2020,42(10):807-816.
作者簡介:謝王踢(1985-),男,湖南岳陽市人,碩士研究生,主要從事惡性腫瘤綜合治療研究。
*通訊作者:翁潔

