乳腺癌中長鏈非編碼RNA H19可變剪接體的鑒定
王喜周,李凌云,周 武
(1.麗水學院職業技術學院,浙江麗水 323000;2.麗水市人民醫院,浙江麗水 323000;3.嘉興學院醫學院,浙江嘉興 314001)
長鏈非編碼RNA(Long non-coding RNA,LncRNA)是指長度大于200 nt、缺少或無開放閱讀編碼框(opening reading frame,ORF)不表達蛋白質的基因。與編碼蛋白質的基因相比,這類基因物種間的保守序列低、具有更高的組織器官特異性并且不一定都帶多聚腺苷酸尾巴[1]。H19是一類特殊的長鏈非編碼RNA,是第一個被發現的印跡基因。所謂印跡基因是指同源基因在表達時,只有一方的等位基因進行表達,來自另外一個親本的等位基因不表達或者表達極弱[2]。人H19基因位于11號染色體p15.5位置,是母源性的印跡基因,只有mRNA的表達,不編碼蛋白質。
可變剪接,也稱選擇性剪接(alternative splicing),是基因轉錄為mRNA前體(pre-mRNA)之后,在mRNA加工成熟過程中出現的一種多樣性的剪接方式。一般情況下,前體mRNA的加工成熟是剪除所有內含子,留下外顯子,外顯子再連接形成成熟的mRNA。在此過程中,如果出現不同的剪接方式,就會出現成熟mRNA的可變剪接體,這些剪接體稱為剪接異構體[3-4]。可變剪接不但發生在編碼基因上,也發生在非編碼基因上。長鏈非編碼基因的可變剪接是長鏈非編碼基因進行調控的重要手段,長鏈非編碼基因的異常可變剪接會導致多種疾病的發生,特別是癌癥[5]。
乳腺癌是女性中發病率最高的癌癥,是女性的“第一殺手”,嚴重威脅著女性的身體健康。盡管近年來乳腺癌的死亡率出現下降趨勢,但對乳腺癌的治療仍然面臨著巨大的挑戰。本研究利用幾株常用的乳腺癌細胞系細胞,對乳腺癌中長鏈非編碼RNA H19(H19LncRNA)的可變剪接情況進行鑒定,為進一步研究H19LncRNA的各剪接體介導乳腺癌中腫瘤發生發展各階段的作用提供理論依據,從而為乳腺癌的治療指明新的研究方向。
1 材料與方法
1.1 材料
ZR-75-30、T-47D、BT-474、MDA-MB-231和MCF-7細胞購自中國科學院上海細胞庫,所有細胞培養于添加10%胎牛血清和雙抗的DMEM細胞培養液,置于5%CO2含量的37℃培養箱。
1.2 方法
1.2.1 套式PCR反應
設計并合成針對H19的套式擴增引物(#1 F:5’-AGTTAGAAAAAGCCCGGGC-3’,R:5’-GCAG GGTGAGGGAGGGGGTGGGAT-3’;#2 F:5’-CTTC AGCAGGAGCCCTGGACTCA-3’#2 R:5’-TGTGCC CCTCCCCACCAGGGCTTC-3’),以各細胞提取的DNA為模板,設定如下程序進行PCR擴增(94℃2 min,98℃15 s-60℃30 s-68℃1.5 min 15 cycles,68℃5 min)。PCR產物經瓊脂糖凝膠電泳分離后,參照OMEGA膠回收試劑盒說明書對目的條帶進行回收。回收后條帶經純化后送至上海生工公司測序。
1.2.2 5’RACE和3’RACE檢測
提取MCF細胞總RNA,以21 Nanodrop檢測RNA純度及濃度,普通瓊脂糖凝膠電泳(1.5%)分析RNA完整性之后,QIAGEN逆轉錄試劑盒進行cDNA合成,通過RACE引物(#3:5’-GTCCTAGCC CGGGCTTTTCTA-3’#4:5’-GTCCAGGGCTCCTGCT GAAG-3’)進行RACE檢測。
2 結果與分析
2.1 RACE分析及引物設計
H19LncRNA的可變剪接與癌癥相關性的研究不多,乳腺癌中是否存在H19LncRNA的可變剪接體尚未見報道。我們根據H19LncRNA的UTR序列,通過設計巢式PCR引物(圖1),對H19全長cDNA序列進行擴增,以期發現新的H19剪接體。因為以上的巢式引物位于H19mRNA的UTR區域,為了避免H19在5’端和3’端存在其他的轉錄起始和終止位點而漏檢,我們在此基礎上進行了5’端和3’端的RACE分析。在表達H19的乳腺癌細胞MEF7中,5’端(引物#3)和3’端(引物#4)的RACE分析結果顯示:它們的PCR擴增產物都是單一的條帶(圖2),說明在前體mRNA區域內,H19不存在其他的轉錄起始或終止位點。
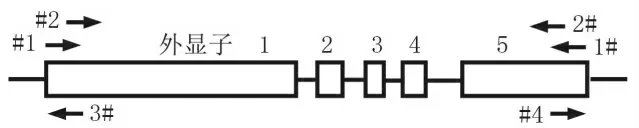
圖1 H19LncRNA的結構及引物設計
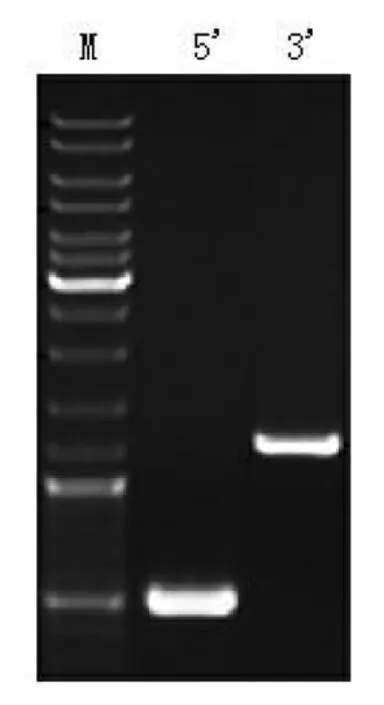
圖2 RACE分析
2.2 H19LncRNA剪接體在乳腺癌細胞中的表達
通過以上設計的巢式引物,我們在幾種常用的乳腺癌細胞系細胞中對H19LncRNA的可變剪接情況進行了檢測。如圖3所示,各乳腺癌細胞中的PCR產物表現為7種大小不一的片段。經進一步測序比對,這7條片段分別為H19的1條成熟mRNA(H19mRNA)和6種不同的可變剪接形式(圖4)。
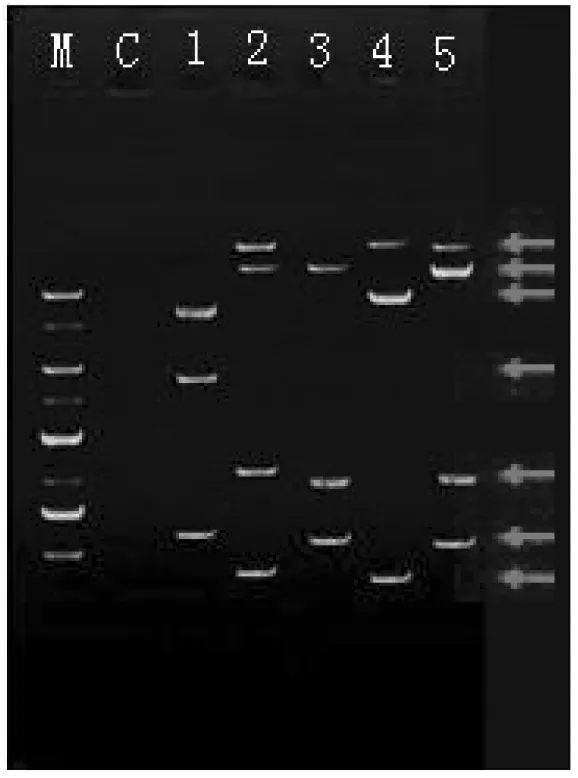
圖3 H19在乳腺癌中的可變剪接
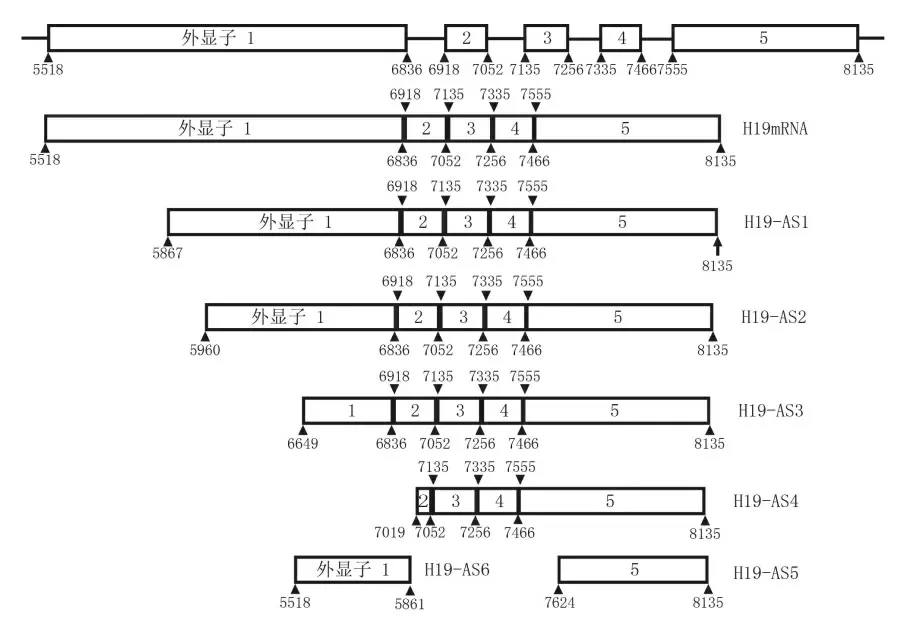
圖4 H19各剪接體示意圖
各剪接體的剪接位點和剪接產物具有一定的特征。與成熟的全長mRNA相比,剪接體H19-AS1、H19-AS2、H19-AS3、H19-AS4、H19-AS5的剪接方式表現為可選擇的5’剪接位點。其中,剪接體H19-AS1、H19-AS2、H19-AS3是在外顯子1上進行的5’剪接位點的可變剪接,可變剪接位點分別是5867、5960和6649;剪接體H19-AS4則是在外顯子2上可變剪接位點7019處進行的可變剪接;而剪接體H19-AS5則是在外顯子5上可變剪接位點7621處進行的可變剪接。另外,與成熟的全長mRNA相比,剪接體H19-AS6則是在外顯子1上進行的3’剪接位點的可變剪接,剪接位點為5861。
3 結論與討論
H19是人類最早發現的印跡基因。研究表明,H19在多種腫瘤中呈現高表達,H19LncRNA參與了腫瘤發生發展過程中多個方面的調控,包括腫瘤細胞增殖、腫瘤細胞轉移、腫瘤細胞干性維持、腫瘤代謝、腫瘤耐藥、腫瘤血管生成以及腫瘤自噬調控等等[6]。然而,在不同癌癥中H19的作用機制有所差別。比如:H19可與miR-675形成復合物,通過調節Fas相關蛋白與死亡結構域(FADD)的表達介導胃癌的發生[7]。H19也可通過“分子海綿”的作用吸附miR-138分子,從而增強結腸癌細胞的遷移和侵襲能力[8]。本研究中,我們在乳腺癌細胞中鑒定出H19的6種可變剪接體,提示乳腺癌與H19的可變剪接有關。
關于H19的可變剪接研究不多,已發現的H19可變剪接體主要包括外顯子4缺失[9]和外顯子1部分缺失[10]兩類。這兩類已報道的可變剪接體主要是在胚胎或者正常組織中的存在形式,而本研究則以乳腺癌細胞為研究對象,通過巢式引物的設計,PCR鑒定出H19的新剪接體。這些新的剪接體在各細胞中存在的類型各不相同。ZR-75-30細胞中有三種剪接體AS2、AS3和AS5,T-47D細胞中鑒定出AS1、AS4和AS6三種可變剪接體,BT-474和MCF-7細胞中存在AS1、AS4和AS5三種可變剪接體,而MDA-MB-231細胞中則只有AS2和AS6兩種可變剪接體,并且,ZR-75-30和BT-474細胞中沒有鑒定出全長的成熟H19mRNA(圖3)。
由于腫瘤存在異質性的特征,不同的腫瘤細胞甚或是同一腫瘤的不同細胞,其侵襲轉移能力都存在一定差別。在對乳腺癌的研究中發現,相關基因的選擇性剪接及其選擇性剪接后的相應產物,對乳腺癌的腫瘤轉移、侵襲具有重要的作用。這些基因包括原癌基因Mdm2、C-erbB-2,抑癌基因PTEN,雌激素受體β(ERβ),凋亡抑制蛋白Survivin等。乳腺癌相關基因的選擇性剪接作為乳腺癌發生發展的特征,新型選擇性剪接異構體的發現和鑒定正成為乳腺癌診斷和治療的新策略。本研究結果提示不同的剪接體有可能介導不同的腫瘤發生發展過程,勢必有利于闡明選擇性剪接對腫瘤發生發展的調控機制,對乳腺癌和其他腫瘤的發病機理、診斷和治療提供更多更有利的參考。

