含氨燃料預混火焰的層流火焰速度及NO排放特性
毛晨林,王平,Prashant Shrotriya,何宏凱,Antonio Ferrante,3
(1江蘇大學能源研究院,江蘇鎮江 212013;2江蘇大學能源與動力工程學院,江蘇鎮江 212013;3燃燒與環境中心,米蘭,Gioia del Colle(BA),70023,意大利)
引 言
為減輕全球變暖,要求盡可能減少人類活動過程中CO2的排放[1],而實現CO2排放目標的關鍵方法之一是在電力和能源系統中增加可再生、低碳或零碳燃料的利用。氨氣作為一種零碳能源,燃燒過程中不產生CO2,且氫密度相對較高,NH3中氫的質量分數占17.7%[2],因而受到越來越多的關注。此外,氨的生產工藝,即Harber-Bosch工藝[3]已經成熟便于大規模生產,它的供應基礎設施也很完善。而且氨氣易于儲存,在壓力為0.8 MPa、溫度為21℃即可液化存儲。但是NH3具有毒性[4-5],在輸運、使用過程中需防止其泄漏。同時NH3層流火焰速度較小、最小點火能較大、可燃范圍較窄,燃料型NOx排放較高[6],這些問題如果不能有效解決將限制NH3作為燃料的推廣應用,因此需深入研究NH3火焰的基本燃燒特性。
為改善純NH3燃燒特性,可將其他活性燃料(如CH4[7-8]、H2[9-11])與NH3進行摻混燃燒。Okafor等[7]實驗測量并結合數值計算對大氣壓下,當量比及NH3含量對NH3/CH4/air層流火焰速度NO排放的影響進行了研究。Okafor等[8]不僅測量了大氣壓下NH3/CH4/air層流火焰速度,還測量了壓力為0.3、0.5 MPa下NH3/CH4/air層流火焰速度,并對文獻[7]中提出的反應機理進行了簡化。Ichikawa等[9]采用實驗和數值模擬方法研究了0.1、0.3、0.5 MPa狀態下H2含量對NH3/H2/air預混層流火焰速度的影響,發現隨著H2含量的增加,層流火焰速度非線性增大。Kumar等[10]實驗測量了NH3/H2/air層流射流火焰速度,在模擬過程中增加了熱損失修正,發現與實驗值更為吻合,并指出OH、H和O自由基對層流燃燒速度的重要性。最近,Han等[11]針對NH3/H2/air,NH3/CO/air及NH3/CH4/air預混火焰開展了實驗測量及數值模擬,發現在這三種含NH3的摻混燃料中,摻H2是最有效的增大含NH3燃料層流火焰速度的方法,而摻CH4的效果最差。
鑒于數值模擬在燃燒研究中起到的重要作用,針對NH3/air、NH3/H2/air及NH3/CH4/air火焰的簡化反應機理近年來受到了越來越多的關注。Duynslaegher等[12]對Konnov機理[13]進行改進,增加了與N2O生成有關的反應,將NH3/H2機理減少到19組分-80步反 應。隨后Xiao等[14]又 基于Konnov機理[13],發展了5個不同大小的NH3/CH4簡化機理,通過對點火延遲期和相關燃燒產物進行計算,發現一些簡化機理在模擬中有相當好的表現,并推薦42組分-500步反應用于今后的研究。Xiao等[15]基于Mathieu機理[16],通過改善對NOx的預測精度,發展了3個不同大小的NH3/H2簡化機理,并證明改進后的簡化機理總體性能優于Mathieu機理[16],顯著優于Duynslaegher機理[12],且機理在燃氣輪機燃燒速度預測方面表現良好。2018年,Otomo等[17]基于Song機理[18]以及相關包含NH2、HNO和N2H2的基元反應發展了32組分-213步反應的NH3/H2簡化機理(UTLCS),該機理準確預測了層流火焰速度,并合理解釋了由于NH3的分解使得下游NOx濃度減少及H2濃度增大。Okafor等[8]基于GRI 3.0和Tian機理[19]發展了42組分-130步反應的NH3/CH4簡化機理,與實驗數據對比,發現該機理能很好地預測層流火焰速度及NH3、NO等組分分布。Li等[20]基于AramcoMech 2.0、Shrestha模型[21]和Tian模型[19]發展了2個不同大小的NH3/H2簡化機理和2個不同大小的NH3/CH4/H2簡化機理,該機理能較好地預測點火延遲期,但在富燃狀態下高估了層流燃燒速度。
層流燃燒速度是決定混合物燃燒特性的最重要參數之一,它可以表征許多預混火焰現象,如回火、吹熄或燃氣輪機的火焰穩定等。通過對比實驗測量與數值計算得到的層流火焰燃燒速度,可以有效驗證反應機理的精度。NO對環境和人類健康都有危害,需要在燃燒過程中盡可能地降低它的排放。而由于NH3分子中含有N原子,含NH3燃料在燃燒過程會產生大量的燃料型NO[6],要推動NH3燃料的廣泛應用就必須解決NO排放問題。
如何確保燃氣輪機中含NH3燃料的穩定燃燒,并盡可能降低NO排放,是燃氣輪機燃燒室研制中面臨的最重要挑戰之一,而CFD方法是應對該挑戰的強有力工具。在確保計算精度時盡可能節省計算時間,需要采用更加準確、穩定和緊湊的NH3/CH4/H2反應機理來研究含NH3燃料的燃燒特性。本文旨在研究多個現有簡化反應機理在預測NH3/air、NH3/H2/air及NH3/CH4/air層流火焰速度的性能,以及NO的排放特性,為下一步的含氨燃料湍流燃燒特性研究提供參考。
1 數值算法
本研究中性能評估所涉及的簡化反應機理如表1所示。
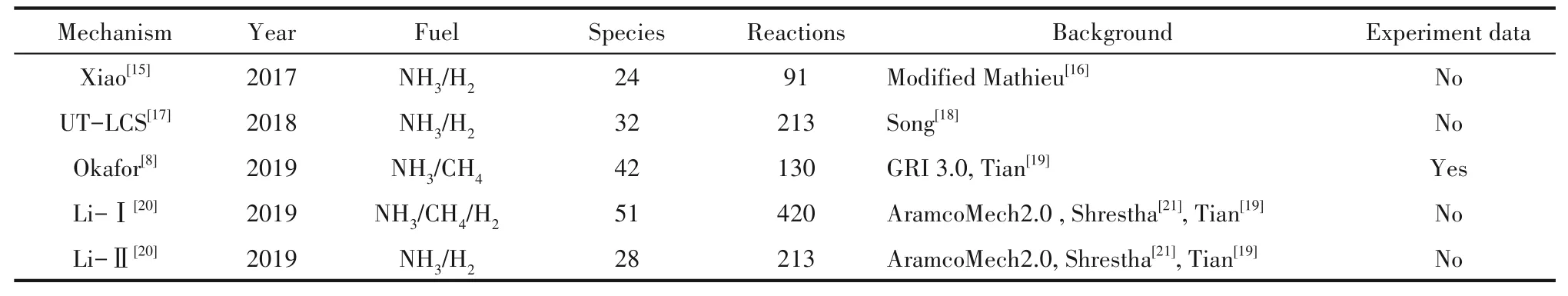
表1 NH3/CH4/H2簡化反應機理Table 1 Reduced mechanism for combustion of NH3/CH4/H2
五個簡化反應機理所含組分如表2所示,Li-Ⅰ、Okafor機理用于NH3/CH4燃料混合物,Li-Ⅰ機理中包含更多化學式中既有N原子又有C原子的組分,將更多的NH3與CH4的反應納入機理當中,而Okafor機 理 不考 慮NH3與CH4之間的 反應。Xiao、UT-LCS、Li-Ⅱ機理用于NH3/H2燃料混合物,UTLCS、Li-Ⅱ機理含有更多的氨基(N2H4,N2H3,N2H2),而它們主要是通過NHi(i=1,2)的消耗來生成;另外Xiao機理含有唯一的特殊組分OH*,而OH*是由H和O自由基反應生成。

表2 簡化反應機理所含組分Table 2 Species of the reduced mechanism
層流火焰速度及NO排放特性的數值計算均在Cantera中進行。Cantera是一個面向對象的開源工具包,用于解決化學動力學、熱力學和輸運等相關問題。它能夠自動離散層流火焰,具有多種反應器及處理化學動力學、燃燒學相關問題的求解器。Cantera可用C/C++、Fortran 90、Matlab和Python語言進行編程。本研究中,使用了Python語言。
一維數值計算域l=0.04 m,入口溫度Ti=298 K,初始網格數為400,計算過程中網格根據相關參數自動優化。NH3/CH4燃料的混合物比例采用Okafor等[7-8]的NH3熱量分數ENH3表示,用式(1)計算
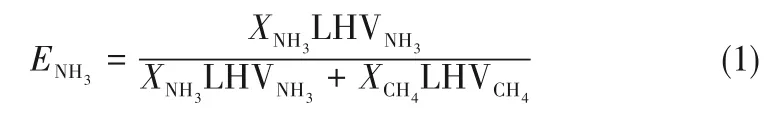
NH3/H2燃料的混合物比例采用多個文獻所使用的H2摩爾分數XH2表示。
使用Newton積分算法,對于穩態問題和時間步長所選用的最大相對、絕對誤差均為10-3。計算輸出整個計算域網格節點處的溫度、速度、密度、機理所包含組分的摩爾分數等相關信息。其中詳細分析了層流火焰速度(入口節點速度)與出口處的NO摩爾分數隨當量比、混合物比例及壓力的變化。
最后,應用CHEMKIN-PRO模擬一維燃燒腔內空氣分級燃燒對于減少NO排放的可行性。圖1所示是一個包含4個部分的由全混流反應器(PSR)-部分混流反應器(PaSR)-柱塞流反應器(PFR)組成的化學反應器網絡:第一部分代表帶有中心回流區(CRZ)的旋流火焰區域;第二部分代表火焰后區;第三部分代表與二次空氣流混合的熄火區;第四部分代表貧燃區。該化學反應器網絡用于模擬0.1 MPa狀態下,二次空氣流是否射入對NH3/CH4燃料混合物和NH3/H2燃料混合物NO排放的影響,其中對于NH3/CH4燃料混合物NH3的熱量分數ENH3=0.3,輸入低位熱功率為27.5 kW;而NH3/H2燃料混合物H2的摩爾分數XH2=0.3,輸入低位熱功率為29.38 kW。無論是否有二次空氣射流,總當量比?total=0.9,而有二次空氣射流時,燃燒主區當量比?primary=1.2。
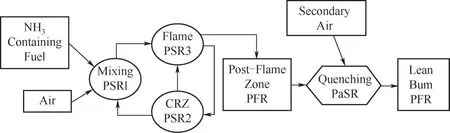
圖1 一維化學反應器網絡示意圖Fig.1 Schematic of 1D chemical reactor network
2 結果與分析
2.1 NH3/CH4/air火焰
2.1.1 層流火焰速度 圖2顯示了不同壓力和當量比下NH3/CH4/air層流火焰速度隨ENH3的變化,實驗數據由Okafor等[7-8]測得。由圖可見,Sl隨著ENH3的增大而單調減小。同一當量比同一NH3熱量分數下,壓力越大,層流火焰速度越小,且壓力從0.1 MPa增大到0.3 MPa時Sl的減小程度比壓力從0.3 MPa增大到0.5 MPa時更大。圖2也顯示了使用Okafor[8]、Li-Ⅰ[20]簡化反應機理預測的層流火焰速度。Okafor機理計算值與實驗值更加吻合,Li-Ⅰ機理計算值皆偏大,但隨著壓力的增大,Okafor、Li-Ⅰ機理計算值與實驗值的偏差越來越小。說明Okafor、Li-Ⅰ機理可能較適用于高壓條件。數值計算過程中,Li-Ⅰ機理比Okafor機理更節省計算時間。例如計算P=0.1 MPa、ENH3=0.3、?=1.0狀態下NH3/CH4/air層流火焰速度時,相同計算設置,Okafor機理的計算時間為19.2 min,而Li-Ⅰ機理的計算時間為3.7 min。但由于Okafor機理計算值與實驗值更加接近,推薦Okafor機理用于三維NH3/CH4/air湍流火焰模擬。

圖2 不同壓力和當量比下NH3/CH4/air層流火焰速度隨ENH3的變化Fig.2 Laminar flame speeds for NH3/CH4/air mixture as a function of ENH3 at different pressure and equivalence ratio
圖3顯示了Okafor等[8]實驗測得的及使用Okafor[8]、Li-Ⅰ[20]簡化反應機理數值計算所得的不同壓力不同NH3熱量分數下NH3/CH4/air層流火焰速度隨當量比的變化。由圖可見,貧燃狀態下,層流火焰速度隨當量比增大而增大;富燃狀態下,層流火焰速度隨當量比增大而減小。?=1.05左右時,NH3/CH4/air層流火焰速度達到最大。?=0.8~1.3的范圍內,Li-Ⅰ機理計算值偏大,而Okafor機理較好預測實驗值。
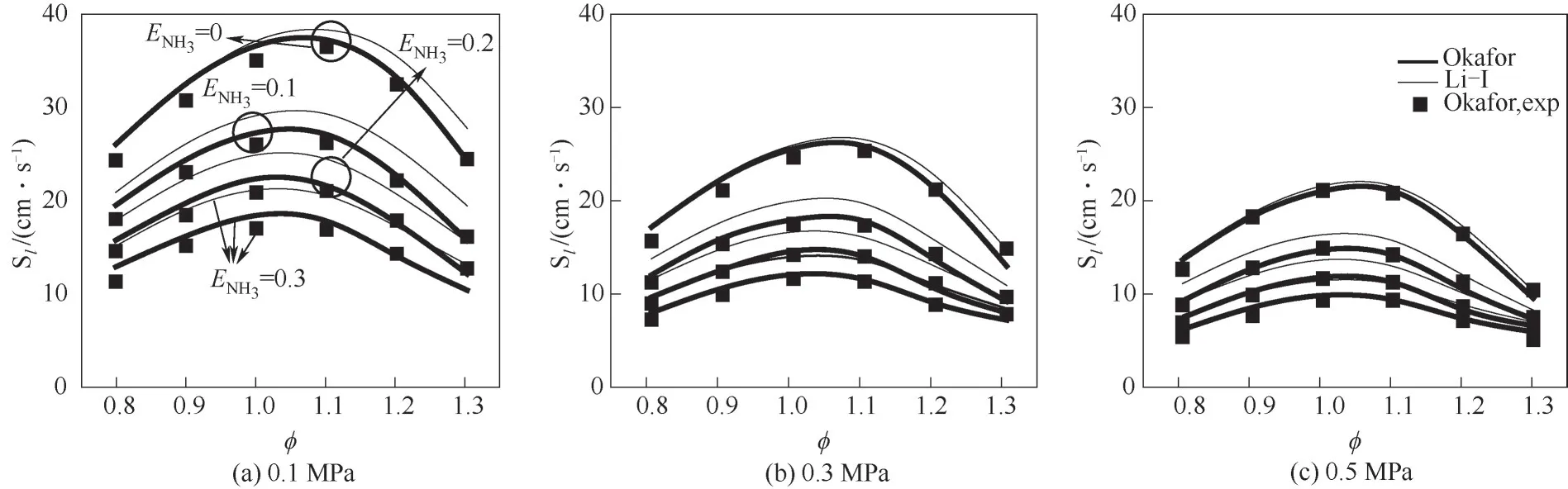
圖3 不同壓力和ENH3下NH3/CH4/air層流火焰速度隨?的變化Fig.3 Laminar flame speeds for NH3/CH4/air mixture as a function of?at different pressure and ENH3
2.1.2 NO排放 使用Okafor[8]、Li-Ⅰ[20]簡化反應機理對不同壓力下化學計量比的NH3/CH4/air火焰煙氣中NO摩爾分數隨ENH3的變化進行數值計算,結果 如 圖4所 示。P=1.5 MPa、ENH3>0.5時 及P=3.0 MPa、ENH3>0.2時,Li-Ⅰ機理在計算過程中發散,故在中高壓狀態下只顯示Li-Ⅰ機理部分計算結果。注意,不同圖中的縱坐標范圍不同。由圖可見,在可計算范圍內,Li-Ⅰ機理計算值皆大于Okafor機理。但兩個機理計算結果趨勢一致,隨著ENH3的增大,NH3/CH4/air火焰煙氣中NO摩爾分數先增大后減小。低壓P=0.1 MPa時,兩個機理計算所得的NO摩爾分數均在0.2≤ENH3≤0.3的范圍內達到最大值;而中高壓P=1.5、3.0 MPa時,最大NO摩爾分數在ENH3≈0.1處得到。由此說明NH3含量增大的情況可有效減少NO排放,同時摻有CH4,提高NH3火焰燃燒特性。
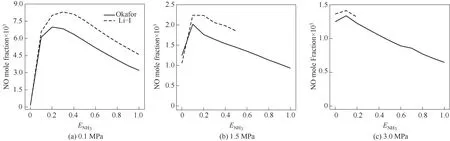
圖4 ?=1.0時不同壓力下NH3/CH4/air火焰煙氣中NO摩爾分數隨ENH3的變化Fig.4 NO mole fraction in the flue gas for chemical stoichiometric NH3/CH4/air mixture as a function of ENH3 atdifferent pressure
使用Okafor[8]、Li-Ⅰ[20]簡化反應機理對不同壓力和ENH3下NH3/CH4/air火焰煙氣中NO摩爾分數隨?的變化進行了數值計算,結果如圖5所示。ENH3=0.3時,Li-Ⅰ機理只顯示P=0.1 MPa時0.8≤?≤1.3和P=1.5 MPa時0.8≤?≤1.0的計算結果。注意,不同圖中的縱坐標范圍不同。由圖可見,ENH3=0時,各個壓力下,貧燃時Li-Ⅰ機理計算值大于Okafor機理;富燃時,壓力P=1.5、3.0 MPa時,兩個機理計算結果相差較小,而P=0.1 MPa時,相差較大。ENH3=0.3時,Li-Ⅰ機理計算結果均大于Okafor機理。但在可計算范圍內兩個機理的計算結果趨勢一致。壓力相等NH3熱量分數相等時,隨著當量比的增大,NH3/CH4/air火焰煙氣中NO摩爾分數先增大后減小。ENH3=0,P=0.1、1.5 MPa時,最大NO摩爾分數在?≈1.0處得到;P=3.0 MPa時,在?≈0.9處。ENH3=0.3時,不同壓力下,?≈0.9時,NO摩爾分數達到最大值。由圖5中曲線的變化趨勢說明,CH4/air火焰可以在貧燃狀態下燃燒減少NO排放;而為有效減少NH3/CH4/air火焰的NO排放,需使其在富燃狀態下燃燒,而富燃燃燒效率低,不經濟環保,因而提出空氣分級燃燒系統(富燃-貧燃),利用二次空氣流使總當量比?<1.0,提高燃燒效率,并且有效減少NO排放[22]。如圖6所示為利用圖1的化學反應器網絡模擬二次空氣射流對NH3/CH4燃料混合物燃燒時NO排放的影響。由圖可見,采用二次空氣射流的分級燃燒在貧燃區依然有NO的產生,但是對比兩組上下曲線,可以發現燃燒器出口NO摩爾分數在采用空氣分級燃燒后減少了約一個量級。
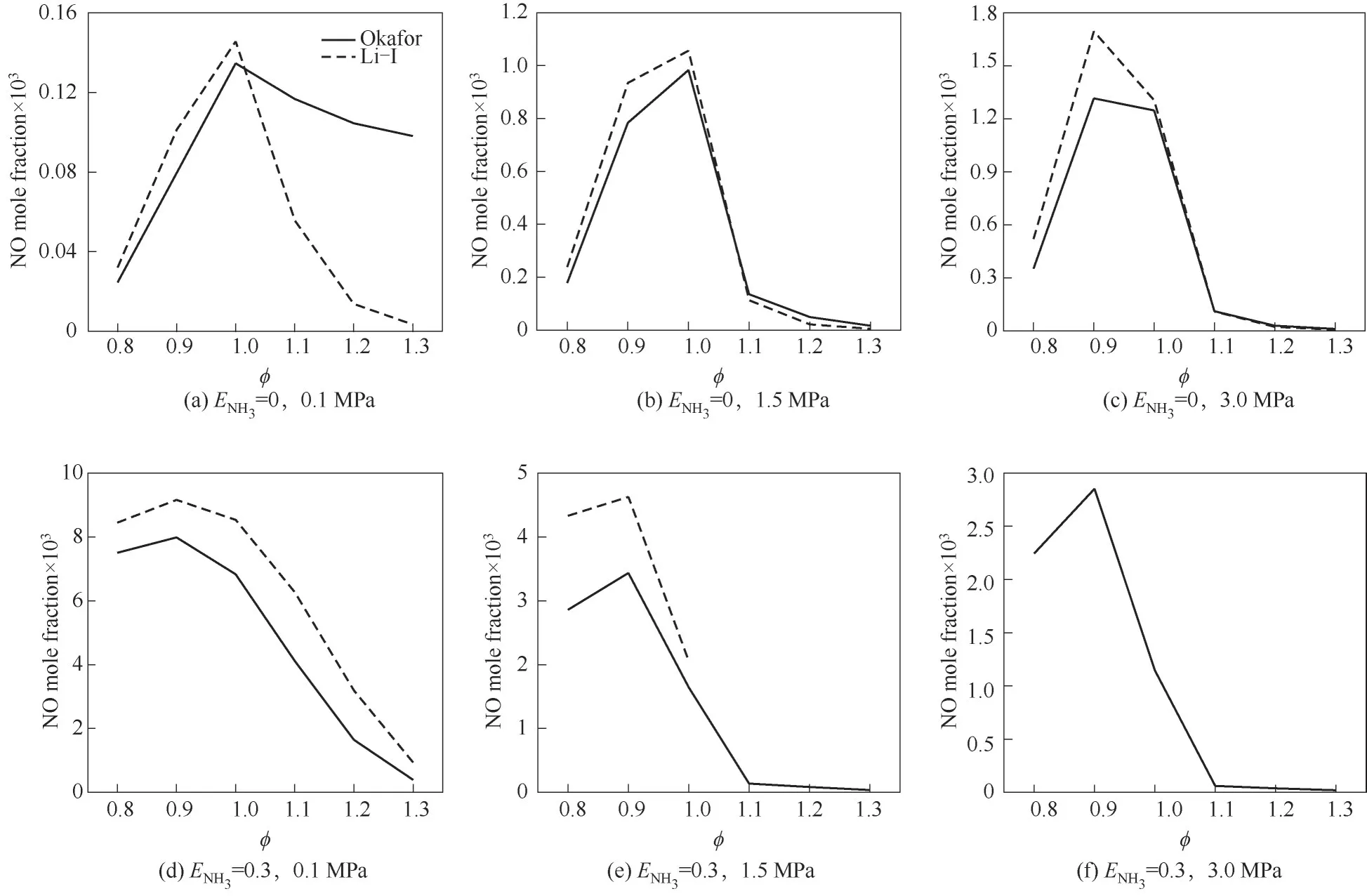
圖5 不同壓力和ENH3下NH3/CH4/air火焰煙氣中NO摩爾分數隨?的變化Fig.5 NO mole fraction in the flue gas for NH3/CH4/air mixture as a function of?at different pressure and ENH3
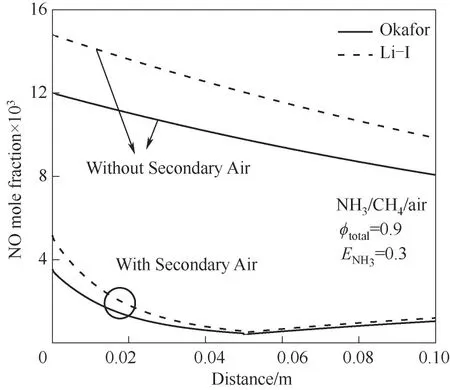
圖6 P=0.1 MPa時空氣分級燃燒對NO排放的影響Fig.6 NO emission with or without the secondary air at P=0.1 MPa
圖7顯示了NH3/CH4燃料混合物在燃燒主區火焰區域的Okafor、Li-Ⅰ機理中重要的十個NO生成和消耗的反應。左圖[圖7(a)、(c)]為不采用空氣分級燃燒,主燃燒區火焰區域為貧燃狀態;右圖[圖7(b)、(d)]為采用空氣分級燃燒,主燃燒區火焰區域為富燃狀態。由圖可以看出NO主要通過OH、H、O自由基或O2分子的消耗生成,而NO的消耗主要是NO與NH2、NH1、N自由基反應。富燃時過量的NH3分解為NHi(i=0,1,2)自由基,促進NO的消耗;而貧燃時空氣過量,存在更多的OH、H、O自由基和O2分子使得更多的NO生成,故富燃狀態下NO排放比貧燃時低。正如圖7顯示的兩個機理左圖的NO凈生成速率比右圖大。對比兩個機理左右兩組圖,可以發現NO+O+MNO2+M為貧燃狀態下重要的NO消耗反應,這是由于貧燃時空氣過量而產生較多的O自由基。貧燃狀態下Okafor機理和Li-Ⅰ機理最重要的消耗NO的反應是NH+NON2O+H;而富燃時兩個機理中最重要的NO生成的反應是HNO+HNO+H2。對比圖7(a)、(c),NO生成速率范圍相近,但是NO生成最重要的十個反應中Li-Ⅰ機理包含更多的NO生成反應;而圖7(b)、(d)相比較后,可以看到Li-Ⅰ機理的生成速率范圍更大。因而Li-Ⅰ機理NO計算值比Okafor大。
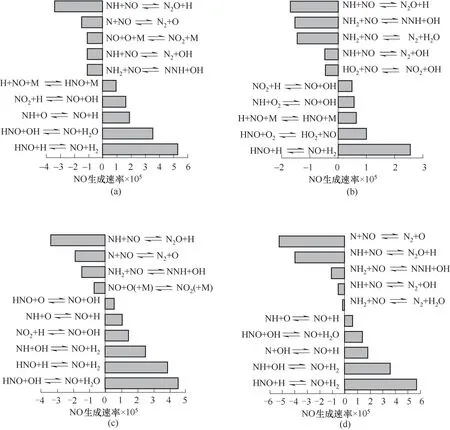
圖7 NH3/CH4燃料混合物燃燒主區火焰區域NO生成速率Fig.7 Rate of NO production in flame zone of primary combustion zone for NH3/CH4fuel mixture(a)Okafor Mech without secondary air;(b)Okafor Mech with secondary air;(c)Li-ⅠMech without secondary air;(d)Li-ⅠMech with secondary air
圖8顯示了?=1.0時,不同ENH3下NH3/CH4/air火焰煙氣中NO摩爾分數隨壓力的變化。使用Okafor[8]、Li-Ⅰ[20]簡化反應機理進行了數值計算,Li-Ⅰ機理在ENH3=0.3時,只顯示壓力0.1 MPa≤P≤2.0 MPa的計算結果。由圖可見,兩個機理計算結果趨勢一致,但在可計算范圍內,Li-Ⅰ機理計算值均大于Okafor機理。對比ENH3=0和ENH3=0.3兩組曲線,可以看出ENH3=0.3時,NO摩爾分數是ENH3=0時的數倍,說明燃料型NO是NH3/CH4燃料燃燒時主要的NO來源。由圖中曲線的變化趨勢可以看出隨著壓力的增大,CH4/air火焰煙氣中NO摩爾分數增大,CH4燃燒時排放的NO主要是熱力型NO,壓力升高后,絕熱火焰溫度升高,故CH4在低壓下燃燒可有效減少NO排放。NH3/CH4/air火焰煙氣中NO摩爾分數隨壓力的升高而減小,NH3/CH4燃料混合物NO的生成主要通過H、O、OH自由基和O2分子的消耗而生成,壓力增大,火焰區域的OH、O、H自由基濃度均減小,限制了NO的生成,故而為有效減少NO排放,應使NH3/CH4燃料混合物在中高壓下燃燒。NH3/CH4燃料混合物在中高壓下燃燒可有效降低煙氣中NO濃度。此外,NH3/CH4/air火焰煙氣中NO摩爾分數隨壓力的變化趨勢比CH4/air的更陡,且隨著壓力增大,CH4/air、NH3/CH4/air火焰煙氣中NO摩爾分數的變化趨于平緩。

圖8 ?=1時不同ENH3下NH3/CH4/air火焰煙氣中NO摩爾分數隨壓力的變化Fig.8 NO mole fraction in the flue gas for chemical stoichiometric NH3/CH4/air mixture as a function of pressure at different ENH3
2.2 NH3/H2/air火焰
2.2.1 層流火焰速度?=1.0時,不同壓力下NH3/H2/air層流火焰速度隨XH2的變化如圖9所示,實驗數 據 由Ichikawa等[9]、Lee等[23]、Kumar等[10]和Han等[11]測得。由圖可見,隨著XH2增大,NH3/H2/air層流火焰速度逐漸增大。壓力P=0.1、0.3、0.5 MPa,XH2<0.5時,層流火焰速度隨XH2增大而增大的趨勢較平緩;而壓力P=0.1 MPa,XH2>0.5時,層流火焰速度隨XH2增大而增大的程度較大。XH2=0.3和XH2=0.7時,NH3/H2/air層流火焰速度相差較大,XH2=0.7時,H2在化學反應中占主導,而XH2=0.3時,NH3在化學反應中占主導。故選擇XH2=0.3和XH2=0.7的狀態,研究NH3/H2/air火焰煙氣中NO濃度隨當量比的變化,詳細內容見2.2.2節。另外,從圖中不同高度的三組曲線可以看出H2摩爾分數相等的狀態下,增大壓力,層流火焰速度減小。圖9也顯示了使用Xiao[15]、UTLCS[17]、Li-Ⅱ[20]簡化反應機理預測的層流火焰速度。不同壓力狀態下,Li-Ⅱ、Xiao機理均能夠較準確地預測實驗數據,而UT-LCS機理計算結果與實驗數據的偏差相較于前兩個機理較大。數值計算過程中UT-LCS機理消耗的計算時間最少,Xiao機理次之,Li-Ⅱ機理消耗最多計算時間。Xiao機理在計算P=0.1 MPa、XH2=0.4、?=1.0狀態下火焰速度需要3.1 min,相同狀態相同計算設置下,UT-LCS需要1.8 min,而Li-Ⅱ機理需要163.2 min。綜合預測準確性與計算時間,推薦Xiao機理用于三維NH3/H2/air湍流火焰模擬。
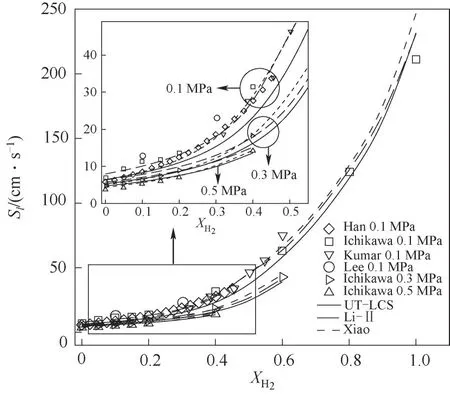
圖9 ?=1.0時不同壓力下NH3/H2/air層流火焰速度隨XH2的變化Fig.9 Laminar flame speeds for chemical stoichiometric NH3/H2/air mixture as a function of XH2 at different pressure
圖10顯示了Han等[11]實驗測得的及Xiao[15]、UT-LCS[17]、Li-Ⅱ[20]簡化反應機理數值計算的不同XH2下NH3/H2/air層流火焰速度隨當量比的變化。由圖可見,層流火焰速度與當量比呈非單調關系,不同H2摩爾分數狀態下,0.6≤?≤0.95時,層流火焰速度隨當量比的增大而增大;1.15≤?≤1.7時,層流火焰速度隨當量比的增大而減小。實驗結果與計算結果均顯示,不同狀態下,當量比0.95≤?≤1.15時,層流火焰速度達到最大值。對比圖10(a)、(b)、(c),可以看出隨著XH2的增大,最大層流火焰速度所對應的當量比增大。XH2=0.15、XH2=0.25時,Li-Ⅱ機理計算值在貧燃狀態下與實驗值較為吻合;XH2=0.40時,Li-Ⅱ機理較為準確地預測了整個當量比范圍內的層流火焰速度。不同的H2摩爾分數XH2,Xiao、Li-Ⅱ機理計算值在富燃時較為接近;Xiao、UT-LCS機理計算值貧燃時較為接近。
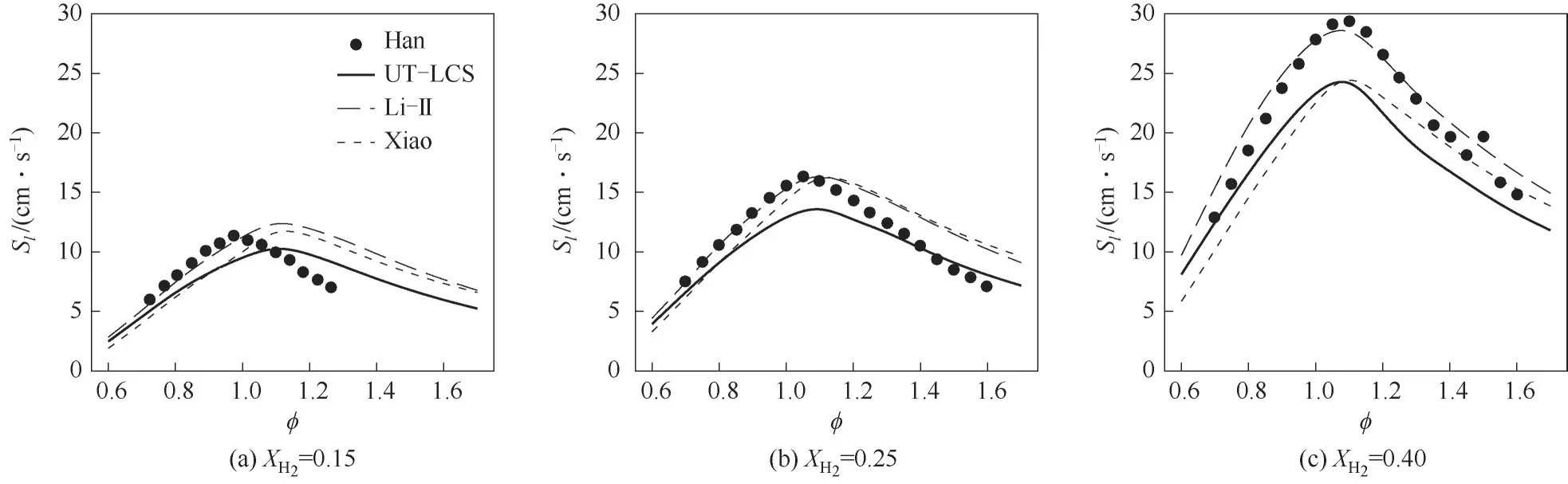
圖10 大氣壓下不同XH2的NH3/H2/air層流火焰速度隨?的變化Fig.10 Laminar flame speeds for NH3/H2/air mixture as a function of?for different XH2 at atmosphere
2.2.2 NO排放?=1.0時,不同壓力下NH3/H2/air 火焰煙氣中NO摩爾分數隨XH2的變化如圖11所示。使用Xiao[15]、UT-LCS[17]、Li-Ⅱ[20]簡化反應機理進行了數值計算,Li-Ⅱ機理只顯示低壓P=0.1 MPa時的計算結果。注意,不同圖中的縱坐標范圍不同。低壓時,整個XH2范圍內三個機理計算結果較好吻合;中高壓時Xiao、UT-LCS機理計算結果相差也較小,但Xiao機理計算值大于UT-LCS機理。隨著XH2的增大,NH3/H2/air火焰煙氣中NO摩爾分數先增大后減小。低壓P=0.1 MPa時,三個機理計算得到的NO摩爾分數均在XH2=0.7~0.8的范圍內達到最大值;而中高壓P=1.5、3.0 MPa時,最大NO摩爾分數對應XH2≈0.9。由此說明,H2含量減少,即NH3/H2燃料混合物中含有較多NH3時可有效減少NO的排放,而相對少量H2能夠有效提高NH3火焰燃燒特性。
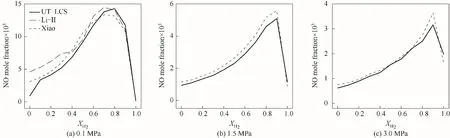
圖11 ?=1時不同壓力下NH3/H2/air火焰煙氣中NO摩爾分數隨XH2的變化Fig.11 NO mole fraction in the flue gas for chemical stoichiometric NH3/H2/air mixture as a function of XH2 at different pressure
使用Xiao[15]、UT-LCS[17]、Li-Ⅱ[20]簡化反應機理對不同壓力和XH2下NH3/H2/air火焰煙氣中NO摩爾分數隨?的變化進行數值計算,結果如圖12所示。由于中高壓狀態下,Li-Ⅱ機理在計算過程中易發散,故Li-Ⅱ機理只顯示低壓P=0.1 MPa時的計算結果。注意,不同圖中的縱坐標范圍不同。由圖可見,低壓時三個機理計算結果在富燃狀態下較為吻合,中高壓時UT-LCS機理和Xiao機理計算結果在富燃時相差也較小,而不同壓力和H2摩爾分數狀態下,貧燃時Xiao機理計算值小于UT-LCS機理。隨著?的增大,XH2=0.3、0.7的NH3/H2/air火焰煙氣中NO摩爾分數均先增大后減小。不同壓力下,XH2=0.3時,最大NO摩爾分數對應?≈0.9;XH2=0.7時,0.8≤?≤0.9,NO摩爾分數達到最大值。圖中曲線的變化趨勢說明,NH3/H2燃料混合物富燃時可有效減少NO排放。可采用空氣分級燃燒,提高燃燒效率的同時,有效減少NO排放。通過化學反應器網絡計算了P=0.1 MPa、XH2=0.3、輸入低位熱功率為29.38 kW的狀態下,NH3/H2燃料混合物燃燒時NO的排放特性,在計算過程中分別采用了UT-LCS、Li-Ⅱ和Xiao機理。二次空氣射流對NH3/H2燃料混合物燃燒時NO排放的影響類似于對NH3/CH4燃料混合物的影響。UT-LCS機理計算結果顯示:在二次空氣射流情況下燃燒器出口NO摩爾分數約為0.51×10-3,而沒有二次空氣射流時其值約為7.20×10-3;Li-II機理計算結果顯示:有/無二次空氣流時燃燒器出口NO摩爾分數分別為0.69×10-3和10.2×10-3;而對Xiao機理其計算結果分別是0.65×10-3和7.42×10-3。由此可見,采用二次空氣入流的分級燃燒技術可大大降低NH3/H2/air火焰的NO排放。
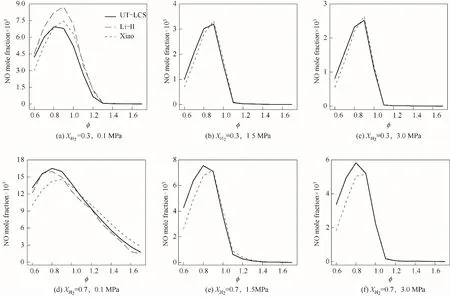
圖12 不同壓力和XH2下NH3/H2/air火焰煙氣中NO摩爾分數隨?的變化Fig.12 NO mole fraction in the flue gas for NH3/H2/air mixture as a function of?at different pressure and XH2
UT-LCS、Li-Ⅱ和Xiao機理在燃燒主區火焰區域的NO生成和消耗最重要的十個反應如圖13所示。左圖[圖13(a)、(c)、(e)]為不采用空氣分級燃燒,右圖[圖13(b)、(d)、(f)]為采用空氣分級燃燒。NH3/H2燃料混合物在燃燒主區火焰區域NO生成和消耗的主要路徑與NH3/CH4燃料混合物幾乎相同。對比左右兩組圖,可以看出除Xiao機理計算結果外,右圖NO生成速率范圍均比左圖小,貧燃狀態下NO的消耗和生成均比在富燃狀態下的增強,故富燃狀態下NO的凈生成速率比貧燃狀態小。雖然Xiao機理計算結果顯示的富燃狀態的生成速率范圍更大,但只有最重要的NO生成和消耗反應速率達到10-4的量級,其余反應速率皆比左圖小,且最重要的NO生成和消耗反應所導致的凈NO生成速率為0.8×10-6,故Xiao機理結算結果與UT-LCS、Li-Ⅱ機理計算結果一致,富燃時NO的凈生成速率比貧燃時小。對比圖13(a)、(c)、(e),可以看出NO生成和消耗的最重要的十個反應相同,只是其重要程度不同,且HNO+OHNO+H2O是三個機理中最重要的NO生成反應。而對比圖13(b)、(d)、(d),NO消耗和生成反應不盡相同,NH+NON2O+H、NH2+NONNH+OH為三個機理中共有的NO消耗反應;N+O2NO+O、NO+H(+M)HNO(+M)為共同的NO生成反應。

圖13 NH3/H2燃料混合物燃燒主區火焰區域NO生成速率Fig.13 Rate of NO production in flame zone of primary combustion zone for NH3/H2fuel mixture(a)UT-LCS Mech without secondary air;(b)UT-LCS Mech with secondary air;(c)Li-ⅡMech without secondary air;(d)Li-ⅡMech with secondary air;(e)Xiao Mech without secondary air;(f)Xiao Mech with secondary air
圖14顯示了使用Xiao[15]、UT-LCS[17]和Li-Ⅱ[20]簡化反應機理數值模擬不同XH2下NH3/H2/air火焰煙氣中NO摩爾分數隨壓力變化的計算結果。計算過程中,Li-Ⅱ機理只顯示XH2=0.3時,0.1 MPa≤P≤1.2 MPa和XH2=0.7時,0.1 MPa≤P≤2 MPa的計算結果。由圖可見,Xiao機理與UT-LCS機理計算結果比較接近,而Li-Ⅱ機理計算結果與Xiao、UT-LCS機理偏差較大。整體而言Xiao機理計算值略大于UT-LCS機理,而Li-Ⅱ機理計算值在XH2=0.3時計算值大于另外兩個機理,在XH2=0.7時計算值小于另外兩個機理。但三個機理計算結果趨勢一致,隨著壓力的增大,無論是NH3含量較大還是較小,NH3/H2/air火焰煙氣中NO摩爾分數均減小,說明中高壓條件下燃燒NH3/H2燃料,可有效減少NO排放。NH3/H2燃料混合物在高壓下燃燒減少NO排放的原因與NH3/CH4燃料混合物一致,皆是由于高壓下OH、O、H自由基濃度的減少。此外,從NO摩爾分數隨壓力的變化趨勢可以看出,隨著壓力的增大,NO摩爾分數的減小程度呈遞減趨勢。另外對比圖中不同H2摩爾分數的兩組曲線,可以看出XH2=0.7的NH3/H2/air火焰煙氣中產生更多的NO。由此說明NH3含量較少時,雖會有相對較少的燃料型NO生成,但是H2含量較大,提高了火焰溫度,使熱力型NO大大增多。如P=0.1 MPa、?=0.9狀態下,XH2=0.3時Xiao、UT-LCS機理計算所得的絕熱火焰溫度約為2030 K,Li-Ⅱ機理計算所得的絕熱火焰溫度約為2016 K;XH2=0.7時Xiao、UT-LCS機理計算所得的絕熱火焰溫度約為2130 K,Li-Ⅱ機理計算所得的絕熱火焰溫度約為2115 K。XH2=0.3與XH2=0.7的絕熱火焰溫度相差約100 K,故相同條件下XH2=0.7的NH3/H2/air火焰煙氣中NO摩爾分數更大的原因應是大量的熱力型NO的生成。
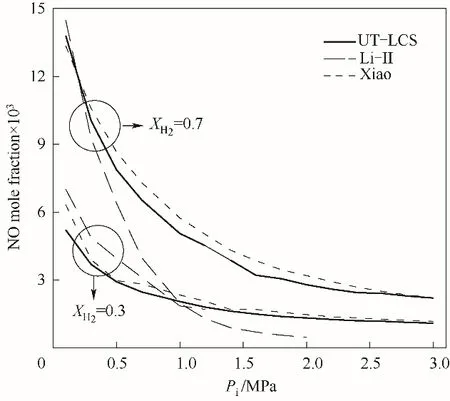
圖14 ?=1時不同XH2下NH3/H2/air火焰煙氣中NO摩爾分數隨壓力的變化Fig.14 NO mole fraction in the flue gas for chemical stoichiometric NH3/H2/air mixture as a function of pressure at different XH2
2.3 NH3/air火焰
2.3.1 層流火焰速度 不同壓力下NH3/air層流火焰速度隨當量比的變化如圖15所示,實驗數據由Hayakawa等[24]、Takizawa等[25]、Pfahl等[26]、Zakaznov等[27]和Ronney[28]測得,數值計算采用計算性能較好的Xiao[15]、Okafor[8]簡化反應機理。由圖可見,不同壓力下,NH3/air層流火焰速度與當量比呈非單調關系,隨著當量比的增大,層流火焰速度先增大后減小,在當量比?=1.1左右時,Sl達到最大值。P=0.1 MPa時,NH3/air最大層流火焰速度約為8 cm·s-1,為CH4/air火焰的1/5。且圖中不同壓力的三組曲線說明,隨著壓力的增大,NH3/air層流火焰速度減小。不同壓力下,貧燃時,Xiao機理計算值低于Okafor機理;富燃時,Xiao機理計算值高于Okafor機理。兩個機理均能較好預測實驗結果,但計算過程中Xiao機理更節省計算時間,例如計算P=0.1 MPa、?=1.0狀態下NH3/air層流火焰速度時,相同計算設置,Okafor的計算時間為117.4 min,Xiao機理的計算時間為2.1 min,故推薦Xiao機理用于NH3/air三維湍流模擬。
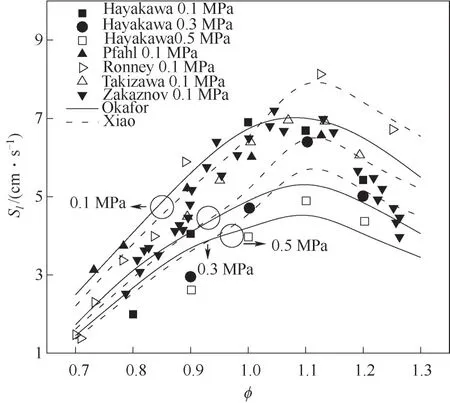
圖15 不同壓力下NH3/air層流火焰速度隨?的變化Fig.15 Laminar flame speeds for NH3/air mixture as a function of?at different pressure
2.3.2 NO排放 圖16顯示了使用Xiao[15]、Okafor[8]簡化反應機理數值模擬不同壓力下NH3/air火焰煙氣中NO摩爾分數隨?變化的計算結果。由圖可見,Okafor機理與Xiao機理的計算結果較為相近,但低壓時Okafor機理計算值較大,中高壓時Xiao機理計算值較大。不同壓力下,隨著?的增大,NH3/air火焰煙氣中NO摩爾分數先增大后減小,在當量比?≈0.9時,NO摩爾分數達到最大值。不同壓力下,0.9≤?≤1.1時,NO摩爾分數隨著?的增大急劇減小;而?>1.1時,NO摩爾分數隨著?的變化趨勢較平緩。P=0.1 MPa時,富燃狀態下NO摩爾分數可小于4×10-3;而高壓時,富燃狀態下NO排放可小于0.01×10-3。由此說明不同壓力下,NH3可以在微富燃狀態下燃燒,而有效地減少NH3/air火焰煙氣中NO排放。
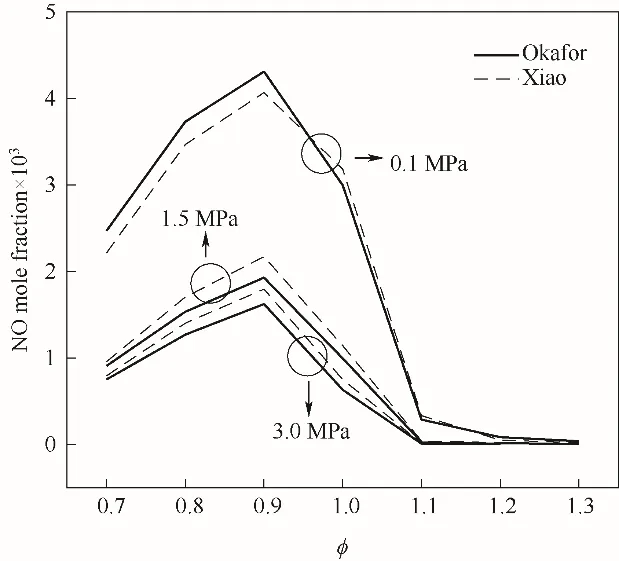
圖16 不同壓力下NH3/air火焰煙氣中NO摩爾分數隨?的變化Fig.16 NO mole fraction in the flue gas for NH3/air mixture as a function of?at different pressure
使用Xiao[15]、Okafor[8]簡化反應機理對?=1.0時,NH3/air火焰煙氣中NO摩爾分數隨壓力的變化進行數值計算,計算結果如圖17所示。由圖可見,Okafor機理與Xiao機理的計算結果較為相近,但整體而言,Xiao機理的計算值大于Okafor機理。隨著壓力的增大,NH3/air火焰煙氣中NO摩爾分數減小。0.1 MPa 圖17 ?=1.0時NH3/air火焰煙氣中NO摩爾分數隨壓力的變化Fig.17 NO mole fraction in the flue gas for NH3/air mixture as a function of pressure at?=1.0 采用文獻中的五種化學機理對不同狀態下的NH3/CH4/air、NH3/H2/air和NH3/air火焰進行了計算,研究不同狀態參數對層流火焰速度和NO排放的影響,并與文獻中的實驗數據進行比較分析,得到如下結論。 (1)NH3/CH4、NH3/H2燃料混合物隨著NH3含量的增多,層流火焰速度單調減小;NH3/CH4/air、NH3/H2/air、NH3/air的層流火焰速度,隨著當量比的增大先增大后減小,但隨著壓力的增大而單調減小。 (2)Okafor機理用于數值計算NH3/CH4/air火焰時,精度更高;但對于NH3/H2/air、NH3/air火焰,Xiao機理表現更佳。 (3)NH3/CH4、NH3/H2燃料混合物中提高NH3的含量可有效減少NO排放,同時摻入的少量活性燃料,有效提高了NH3火焰燃燒特性。NH3/CH4燃料混合物中NH3熱量分數在0.1~0.3的范圍內時,煙氣中NO摩爾分數達到最大值;而對NH3/H2混合氣,NH3摩爾分數在0.1~0.3的范圍內時,NO排放達到最大。 (4)含氨燃料在富燃狀態下燃燒可有效減少NO排放,但富燃燃燒效率低,不經濟環保,可采用空氣分級燃燒(富燃-貧燃),利用二次空氣流使總當量比?<1.0,提高燃燒效率,且有效控制NO排放。 (5)含NH3燃料燃燒時NO主要通過與OH、H、O自由基和O2分子反應來生成,主要通過與NHi(i=0,1,2)自由基反應而消耗。 (6)含氨燃料的火焰煙氣中NO摩爾分數隨著壓力的增大而減小,在中高壓下燃燒可有效減少NO排放;但隨著壓力的增大,NO減小趨勢變緩。 符號說明 ENH3——二元燃料中NH3熱量分數 LHV——低位發熱量,kJ·mol-1 Pi——入口處壓力,MPa Sl——層流火焰速度,cm·s-1 Ti——入口處溫度,K X——摩爾分數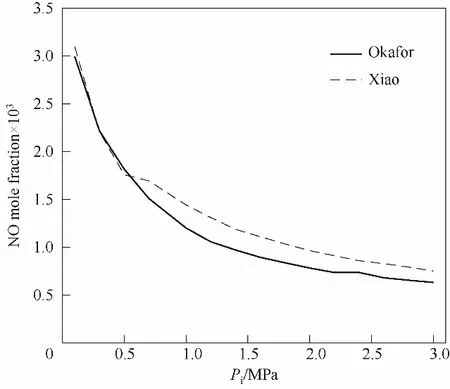
3 結 論

