銀杏內酯B對癲癇模型大鼠學習記憶能力和海馬神經元病變的影響
魯光輝 李新峰 馮亮 羅玲 王海華
癲癇是一種慢性神經系統疾病,目前我國約有900萬癲癇患者,是僅次于腦血管疾病的第二大腦部疾病[1]。研究發現30%~40%的癲癇患者存在不同程度認知功能障礙,主要表現為學習記憶能力降低,其中以視覺空間記憶能力、短時記憶能力損傷最為嚴重,嚴重影響癲癇患者的生活質量[2]。海馬是參與空間學習記憶的重要腦區,癲癇發病過程中大腦神經元過度興奮和異常同步放電導致活性氧自由基(reactive oxygen species,ROS)、炎癥細胞因子大量生成,引發海馬神經元損傷是癲癇所致認知功能障礙的重要機制[3-5]。銀杏內酯B(ginkgolide B,GB)是從銀杏葉中提取的一種倍半萜內酯化合物,具有良好的抗氧化和抗炎活性[6-7];但GB能否通過抑制氧化應激反應和炎癥反應改善癲癇所致認知功能障礙的報道少見。筆者通過研究GB對癲癇模型大鼠氧化應激、炎癥反應的影響,探討GB對癲癇模型大鼠學習記憶能力和海馬神經元病變的影響及其機制,現將結果報道如下。
1 材料和方法
1.1 試劑與儀器 試劑:GB粉末(美國Sigma公司,批號:BN90418);丙戊酸鈉粉針劑(sodium valproate,VPA,成都諾迪康生物制藥有限公司,規格:0.4 g/瓶,批號:20190716);丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、過氧化氫酶(catalase,CAT)試劑盒(南京建成生物工程研究所,批號:190704、190811、190724);TNF-α、IL-1β、IL-6 ELISA試劑盒(北京索萊寶生物技術有限公司,批號:SEKR-0009、SEKR-0002、SEKR-0005)。儀器:WMT-100 型Morris水迷宮及視頻分析系統(四川成都儀器廠);Synergy-HT型多功能酶標儀(美國 BioTck公司);RM2125型石蠟切片機(德國Leica公司);TDK-BMB型石蠟包埋機(孝感泰康達醫療設備公司);SZ-1型組織勻漿器(江蘇金壇市晶玻實驗儀器廠)。
1.2 實驗動物與分組 清潔級雄性SD大鼠180只,體重220~250 g,由河北省實驗動物中心提供 [許可證號:SCXK(冀)2018-004],適應性飼養 7 d。按照隨機數字表法分為空白對照組、模型組、GB低、中、高劑量組(2.5、5、10 mg/kg)[8]和 VPA(300 mg/kg)組[9],每組 30 只。
1.3 造模與給藥方法 除空白對照組外,其余各組大鼠均參照陳姝璇等[10]報道的氯化鋰-匹羅卡品法誘導制備癲癇大鼠模型:腹腔注射氯化鋰溶液127 mg/kg,20 h后背部皮下注射匹羅卡品溶液15 mg/kg。藥物配制:精確稱量GB粉末200 mg,加入10 ml二甲基亞砜溶解后,加入適量0.9%氯化鈉注射液制備濃度2 mg/ml的GB溶液,然后依次用0.9%氯化鈉注射液稀釋制備濃度1 mg/ml、0.5 mg/ml的GB溶液;取VPA粉針劑加入適量0.9%氯化鈉注射液制備濃度60 mg/ml的VPA溶液。給藥方法:GB低、中、高劑量組分別在注射匹羅卡品前30 min腹腔注射濃度為0.5、1、2 mg/ml的GB溶液(注射量為5 ml/kg);VPA組在注射匹羅卡品前30 min腹腔注射濃度為60mg/ml的VPA溶液(注射量為5 ml/kg);模型組和空白對照組腹腔注射0.9%氯化鈉注射液(注射量為 5 ml/kg)。
1.4 大鼠行為學觀察 注射匹羅卡品后2 h內觀察各組大鼠行為學變化,記錄癲癇發作潛伏期和癲癇發作持續時間,參照Racine分級標準對各組大鼠癲癇發作程度進行分級[11]:無發作為0級;須動及口周、面部肌肉抽搐為Ⅰ級;點頭或濕狗樣頻繁抖動為Ⅱ級;前肢局限性陣攣為Ⅲ級;前肢局限性陣攣伴后肢站立的全身強直性發作為Ⅳ級;伴有站立并摔倒、翻滾的全身強直陣攣發作為Ⅴ級。
1.5 大鼠學習記憶能力測定 采用Morris水迷宮實驗。Morris水迷宮平臺固定于第Ⅲ象限,水溫設置為(25±1)℃,注射匹羅卡品24 h后,各組按照隨機數字表法取10只大鼠,實驗前適應性訓練3 d,每天訓練4次,分別于第Ⅰ、Ⅱ、Ⅲ、Ⅳ象限面朝池壁輕輕放入水中,訓練過程中誘導大鼠找到第Ⅲ象限平臺。
1.5.1 大鼠學習能力測定 采用定位航行實驗。將每只大鼠分別在第Ⅰ、Ⅱ、Ⅳ象限面朝器壁方向放入水中,記錄每只大鼠找到平臺的時間,120 s內未能找到平臺則按120 s計算,各組大鼠取平均值,即逃避潛伏期。
1.5.2 大鼠記憶能力測定 采用空間探索實驗。撤除第Ⅲ象限平臺,每只大鼠于第Ⅰ象限面朝器壁方向放入水中,記錄120 s內穿越平臺次數。
1.6 大腦海馬神經元病理學檢查 注射匹羅卡品24 h后,在各組剩余的20只大鼠中按隨機數字表法再取10只大鼠,腹腔注射10%水合氯醛溶液3 ml/kg進行麻醉后開胸、暴露心臟,由左心室-右心耳通路依次灌注0.9%氯化鈉溶液300 ml、4%多聚甲醛溶液300 ml,斷頭取腦,置于4%多聚甲醛溶液固定72 h后,行石蠟包埋、4 μm厚度切片、透明和脫蠟后行常規HE染色,中性樹脂封片后通過光學顯微鏡觀察大腦海馬神經元病理學改變。
1.7 大腦海馬組織生化指標檢測 注射匹羅卡品24 h后,取各組剩余的10只大鼠,腹腔注射10%水合氯醛溶液3 ml/kg進行麻醉后予頸椎脫臼處死,斷頭取腦并剝離海馬,加入9倍量冷裂解液后研磨勻漿,4℃離心(r=10 cm、3 000 r/min、10 min)取上清液,然后采用黃嘌呤氧化法和鉬酸銨法分別檢測SOD、CAT活性,硫代巴比妥酸法檢測MDA水平;并采用ELISA法檢測海馬組織 TNF-α、IL-1β、IL-6水平。
1.8 統計學處理 采用SPSS 15.0統計軟件。正態分布的計量資料以表示,多組間比較采用單因素方差分析,兩兩比較方差齊者采用LSD-t檢驗,方差不齊者采用Tamhane's T2法;非正態分布的計量資料以M(P25,P75)表示,組間比較采用Wilcoxon秩和檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠行為學指標的比較 空白對照組大鼠行為正常,未出現癲癇發作,癲癇發作程度為0級。與模型組比較,GB中、高劑量組和VPA組大鼠癲癇發作潛伏期延長、發作持續時間縮短、發作程度降低,差異均有統計學意義(均P<0.01)。與VPA組比較,GB高劑量組大鼠癲癇發作潛伏期延長、發作持續時間縮短、發作程度降低,差異均有統計學意義(P<0.05或0.01)。見表1。
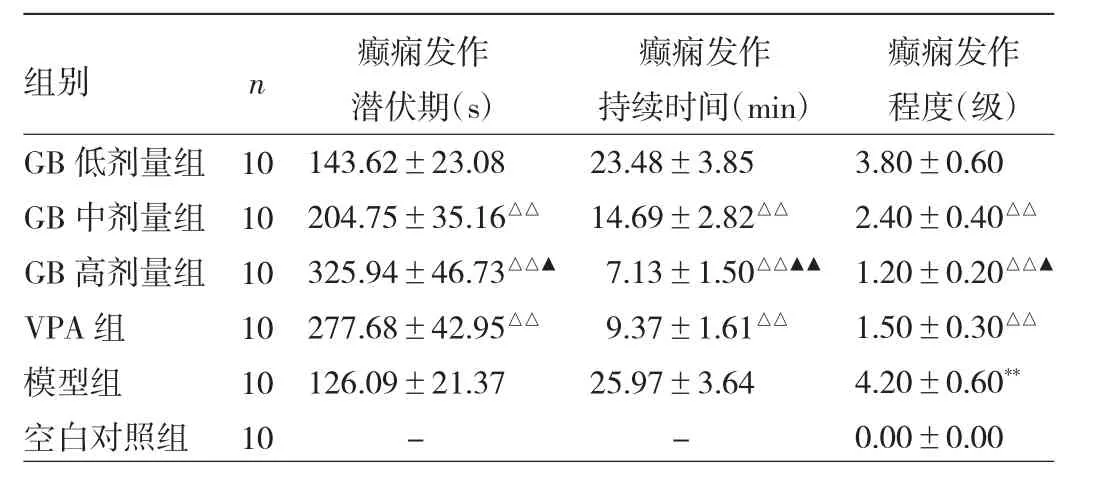
表1 各組大鼠行為學指標比較
2.2 各組大鼠學習記憶能力的比較 與空白對照組比較,模型組大鼠逃避潛伏期延長、穿越平臺次數降低,差異均有統計學意義(均P<0.01);與模型組比較,GB中、高劑量組和VPA組逃避潛伏期縮短、穿越平臺次數增多,差異均有統計學意義(P<0.05或0.01);與VPA組比較,GB高劑量組逃避潛伏期縮短且穿越平臺次數增多(P<0.05或 0.01)。見圖 1(插頁)、表 2。
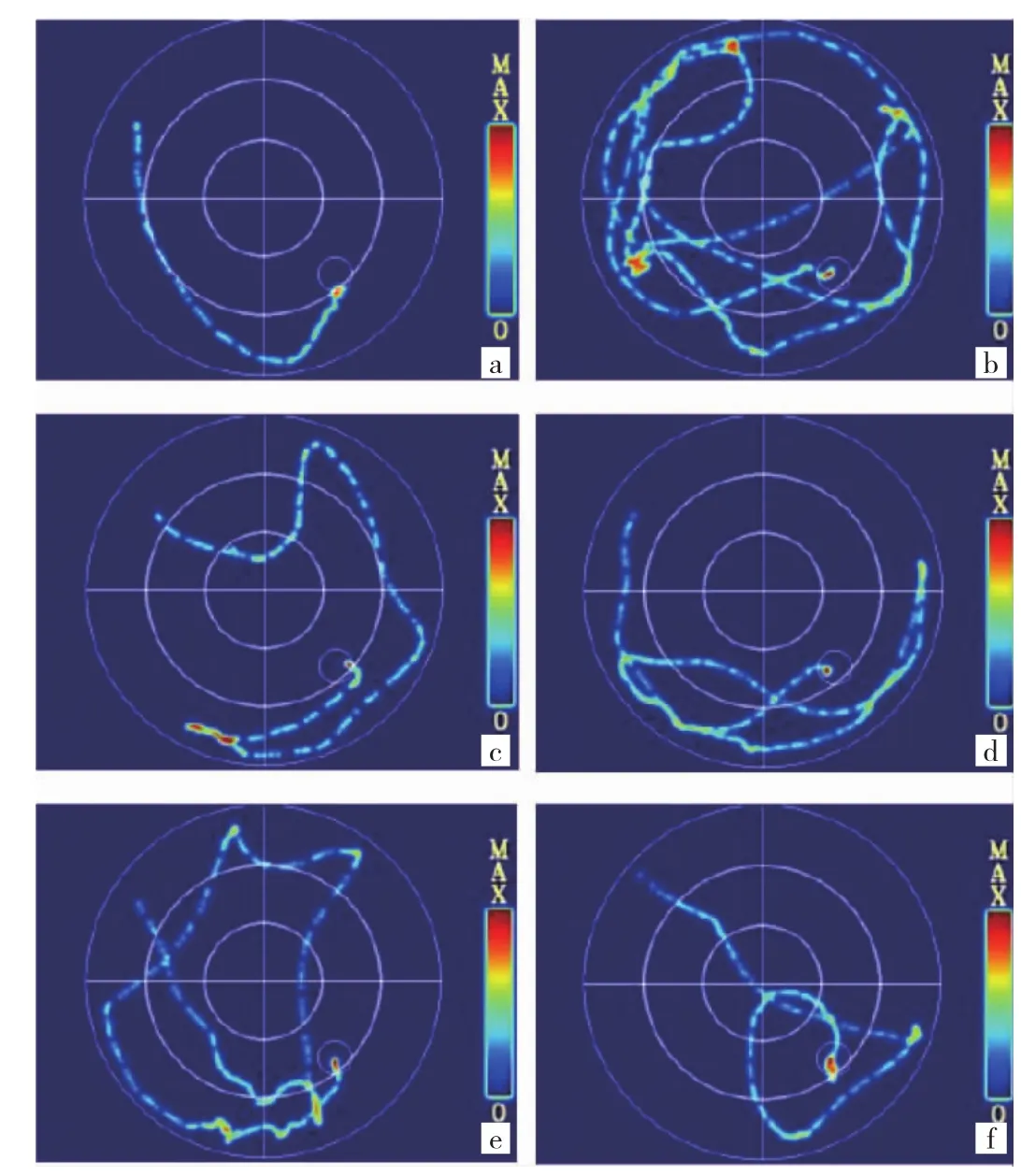
圖1 各組大鼠典型定位巡航實驗軌跡圖[a:空白對照組;b:模型組;c:銀杏內酯 B(GB)低劑量組;d:GB 中劑量組;e:GB 高劑量組;f:丙戊酸鈉(VPA)組]
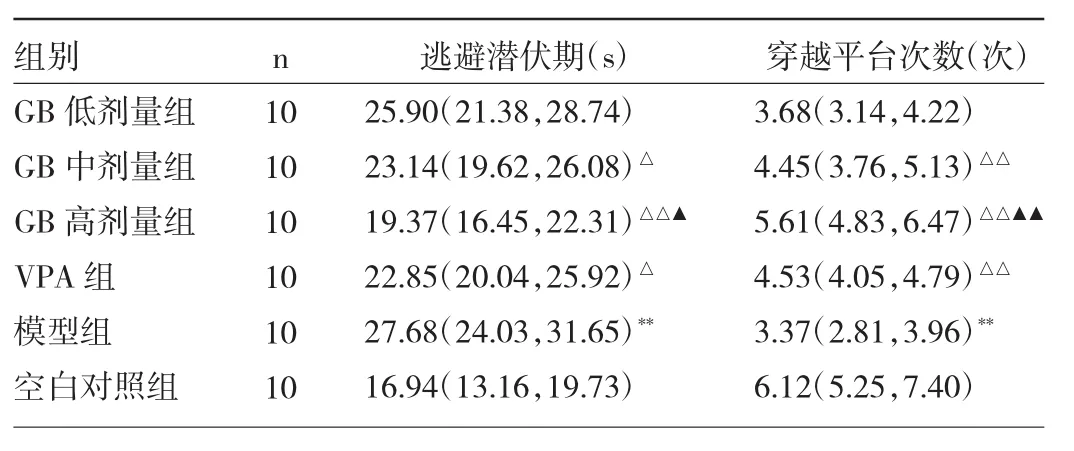
表2 各組大鼠逃避潛伏期和穿越平臺次數的比較
2.3 各組大鼠海馬神經元病理學改變比較 空白對照組大鼠海馬神經元呈圓形或橢圓形,排列整齊、層次清晰,核膜、核仁清晰;模型組海馬神經元呈現形態不規則,數量減少、間隙增大,排列紊亂、層次不清,胞體固縮、深染等病理學改變;與模型組比較,GB各劑量組和VPA組大鼠海馬神經元上述病理學形態結構改變呈不同程度減輕;其中GB高劑量組海馬神經元數量減少不明顯、形態較規則、排列較整齊,效果優于其它組。見圖2(插頁)。
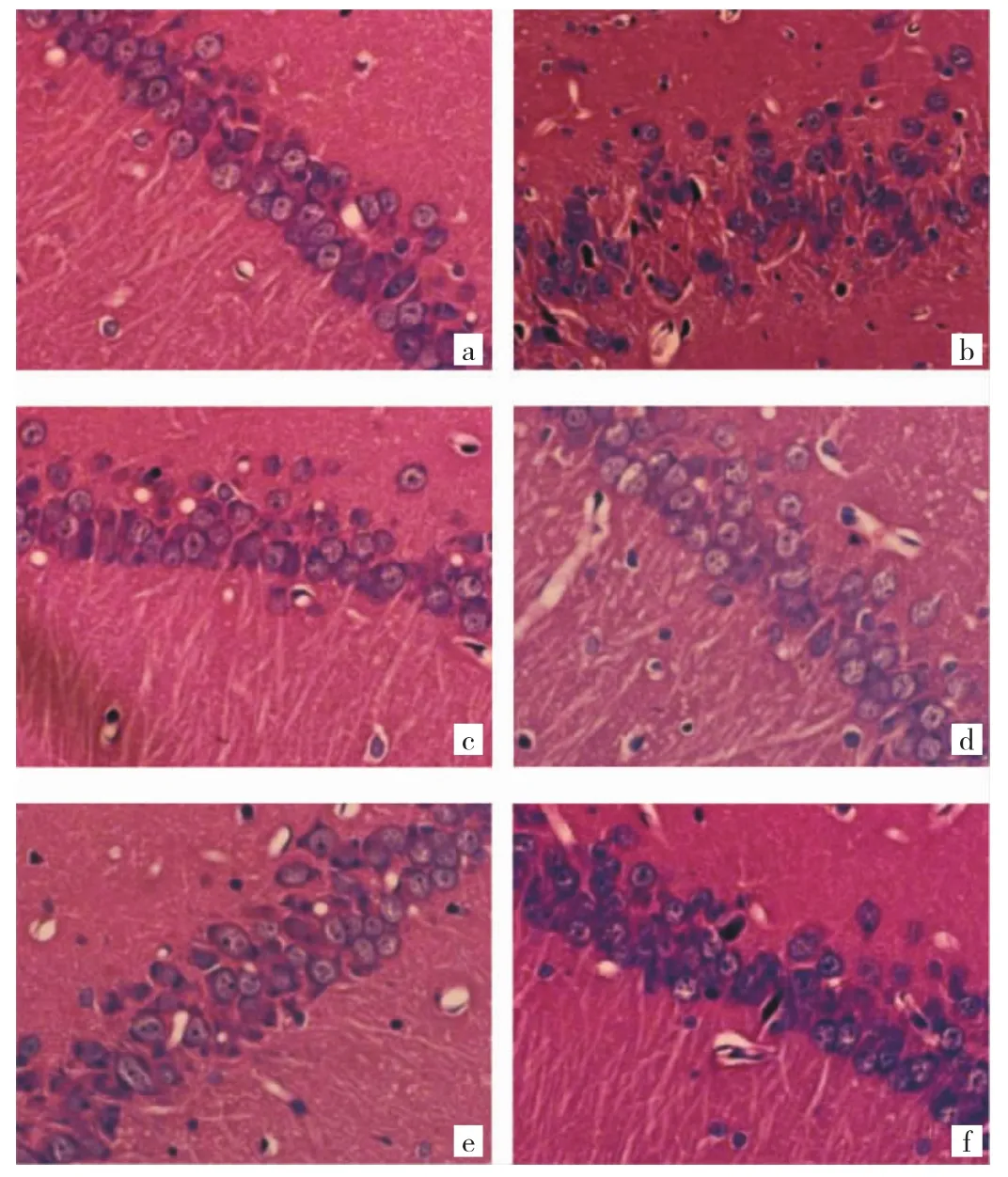
圖2 各組大鼠海馬組織病理學改變比較[a:空白對照組;b:模型組;c:銀杏內酯 B(GB)低劑量組;d:GB 中劑量組;e:GB 高劑量組;f:丙戊酸鈉(VPA)組;HE 染色,×400]
2.4 各組大鼠海馬組織SOD、CAT活性和MDA水平比較 與空白對照組比較,模型組大鼠海馬組織SOD、CAT活性降低,MDA水平升高,差異均有統計學意義(均P<0.01);與模型組比較,GB中、高劑量組和VPA組SOD、CAT活性升高,MDA水平降低,差異均有統計學意義(P<0.05或 0.01);與VPA組比較,GB高劑量組SOD活性升高且MDA水平降低,差異均有統計學意義(P<0.05或0.01)。見表3。
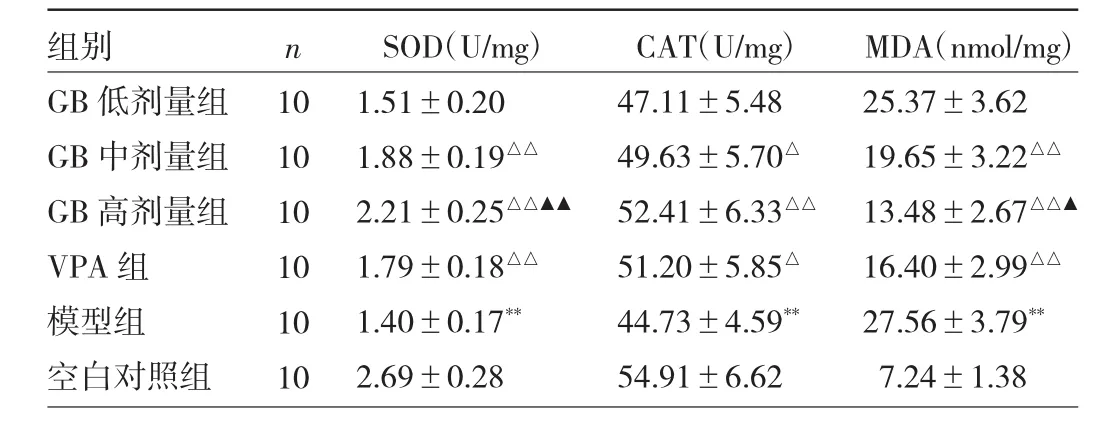
表3 各組大鼠海馬組織SOD、CAT活性和MDA水平比較
2.5 各組大鼠海馬組織TNF-α、IL-1β、IL-6水平比較 與空白對照組比較,模型組大鼠海馬組織TNF-α、IL-1β、IL-6水平升高,差異均有統計學意義(均P<0.01);與模型組比較,GB中、高劑量組和VPA組TNF-α、IL-1β、IL-6水平降低,差異均有統計學意義(均P<0.01);與VPA組比較,GB高劑量組TNF-α、IL-6水平降低,差異有統計學意義(均P<0.01)。見表4。

表4 各組大鼠海馬組織TNF-α、IL-1β、IL-6水平比較(pg/ml)
3 討論
癲癇是一種由于大腦神經元高度同步異常放電而引發的腦功能障礙綜合征,具有自發性、反復性發作的特點,我國癲癇發病率高達千分之七,是僅次于腦卒中的第二大神經系統疾病。認知功能受損是癲癇患者最常見的并發癥,與患病時程呈正相關,是影響患者生活質量的重要因素,抑制癲癇后認知功能障礙是當前腦科學研究熱點之一。病理生理學研究發現,癲癇發作引發氧化應激和炎癥反應所致海馬神經元損傷與認知功能障礙的發生、發展密切相關[3-5]。因此,尋找靶向抑制氧化應激和細胞凋亡的新型藥物減輕海馬神經元損傷,或許是改善癲癇患者預后的有效途徑。
GB是從中藥銀杏葉中提取的一種小分子活性單體化合物,具有抗氧化、抗凋亡等藥理學作用,較易通過血腦屏障;Li等[6]和劉暉等[12]研究發現GB能夠通過抑制氧化應激反應和炎癥反應減輕大鼠缺血性腦損傷。VPA是一種廣泛應用于臨床的廣譜抗癲癇藥,也是新型抗癲癇藥研究動物實驗的常用陽性對照藥物。臨床上以顳葉癲癇最為常見,癲癇實驗動物模型的制備方法主要有電點燃和化學點燃兩大類,其中氯化鋰-匹羅卡品化學點燃法制備的癲癇大鼠模型為顳葉癲癇,與人類癲癇病理特點一致,并且操作簡便、重復性高,是公認的癲癇大鼠模型制作方法[13]。本研究采用氯化鋰-匹羅卡品誘導制備癲癇大鼠模型,以VPA作為陽性對照藥物,研究發現經GB干預能夠明顯延長大鼠癲癇發作潛伏期、縮短持續時間、降低發作程度,明顯改善癲癇大鼠海馬神經元病變,并且GB高劑量組效果優于VPA組,提示GB具有保護癲癇大鼠海馬神經元并抑制癲癇發作的作用。
Morris水迷宮是目前世界公認的學習記憶能力評價方法,主要包括定位航行實驗和空間探索實驗[14]。本研究結果顯示,經GB干預能夠明顯改善癲癇大鼠學習記憶能力,并且GB高劑量組效果優于VPA組,提示GB具有改善癲癇大鼠學習記憶能力的作用。
ROS代謝失衡是導致機體氧化應激損傷的基礎。癲癇發作時神經元過度興奮和異常放電導致ROS大量生成與釋放[15],以ROS為底物的抗氧化酶(SOD、CAT)被過度消耗致使ROS過剩,ROS攻擊破壞核酸、蛋白質及生物膜脂質發生氧化應激反應,生成具有生物毒性的MDA,因此SOD、CAT活性和MDA水平能夠反映機體氧化應激反應程度[16]。本研究發現,經GB干預能夠明顯提高癲癇大鼠海馬組織SOD、CAT活性并降低MDA水平,并且GB高劑量組對SOD活性和MDA水平的調控作用優于VPA組,提示GB對癲癇大鼠海馬神經元氧化應激損傷具有抑制作用。
癲癇發病過程大腦神經元過度興奮與異常同步放電刺激炎癥細胞因子(TNF-α、IL-1β、IL-6)大量釋放,引發系列炎癥反應進而導致海馬神經元損傷。并且TNF-α、IL-1β作為炎性趨化因子能夠刺激粒細胞而進一步釋放炎癥因子,形成炎癥級聯反應而加重炎癥損傷[17];IL-6則能夠刺激細胞大量產生ROS而加重氧化應激損傷[18]。本研究發現,經GB干預能夠明顯降低癲癇大鼠海馬組織TNF-α、IL-1β、IL-6水平,并且GB高劑量組對 TNF-α、IL-1β、IL-6 的調控作用優于VPA組,提示GB對癲癇大鼠海馬組織在這炎癥反應具有抑制作用。
綜上所述,GB能夠延長癲癇模型大鼠癲癇發作潛伏期、縮短發作持續時間、降低發作強度,改善癲癇大鼠學習記憶能力,其機制可能與GB通過抑制氧化應激和炎癥反應而保護海馬神經元有關。

