磷脂酶A2對冠狀動脈粥樣硬化大鼠疾病嚴重程度的評估價值
唐靜怡,段肖翠,范艷平,劉立立,李 靜,王健飛,史 平
動脈粥樣硬化(atheroselerosis, AS)是一種發生在大、中血管的慢性特異性炎癥[1],可引發冠心病和腦梗死,其發病率和病死率均居各種疾病前列,是嚴重危害人類生命健康的疾病之一[2]。臨床發現并確診冠狀動脈及腦血管病變檢查多為復雜及有創檢查,對儀器和操作者水平、經驗均要求較高,不利于臨床篩查。脂質蛋白相關磷脂酶A2(lipoprotein-associated phospholipase A2, Lp-PLA2)是近年發現的一種新型血管炎性因子,由動脈斑塊中的巨噬細胞分泌,并在相應的病灶區呈高表達[3]。AS早期低密度脂蛋白膽固醇(LDL-C)在血管內膜聚集并促進白細胞黏附分子上調,與此同時在巨噬細胞集落刺激因子的誘導下,募集的單核細胞分化成為巨噬細胞,觸發炎癥反應和斑塊形成[4]。近年研究亦證實Lp-PLA2與血管內皮功能障礙有關,可能直接參與AS,增加冠心病風險[5]。本研究探討Lp-PLA2與AS大鼠冠狀動脈疾病嚴重程度和穩定性的關系,旨在為AS的治療提供一定的理論依據。
1 材料與方法
1.1實驗動物 100只SPF級雄性SD大鼠,體質量(200±20)g ,由北京維通利華實驗動物技術有限公司提供,動物許可證號:SCXK(京)2017-0022,普通級,分20個籠子飼養,每籠5只。大鼠飼養于河北醫科大學動物學部屏障環境獨立通氣籠中,溫度控制在(25±1)℃,相對濕度控制在40%~60%,自由進食水。
1.2藥物與試劑 阿托伐他汀(立普妥)購自北京嘉林藥業股份有限公司;維生素D3注射液購自上海通用藥業公司;膽固醇購自上海藍季科技發展公司;三酰甘油(TG)、總膽固醇(TC)、LDL-C試劑盒均購自北京中生生物試劑公司;蘇木素-伊紅(HE)染色試劑盒購自武漢博士德生物技術有限公司;中性甲醛、乙醇、二甲苯購自天津科密歐有限公司。
1.3實驗儀器 采用日本Olympus公司全自動生化分析儀;東莞市同創儀器有限公司光學顯微鏡;德國Leica公司切片機;湖南恒諾離心機有限公司低溫離心機;北京賽多斯儀器系統有限公司BS-124s 型電子天平。
1.4分組、模型建立 將100只SPF級雄性SD大鼠隨機分為3組,健康組30只,模型1組35只,模型2組35只。模型1、2組造模方法及判定造模是否成功參考楊小蓉等[6]研究。模型1、2組均給予高脂飼料喂養,高脂飼料成分為基礎飼料76.5%、膽固醇3%、膽酸鈉0.5%、白糖5%、豬油10%、蛋黃粉5%,共飼養7周。模型1組造模初連續4 d給予維生素D320萬U/(kg·d)腹腔注射,模型2組一次性給予維生素D380萬U/kg腹腔注射。健康組給予普通飼料喂養并注射等量生理鹽水。本研究每組處死大鼠15只,取心臟主動脈瓣組織行HE染色,證實AS模型均制備成功[7]。
1.5藥物干預 模型1組、2組大鼠分別于造模成功后24 h使用阿托伐他汀5 mg/(kg·d)灌胃,健康組大鼠使用等量生理鹽水灌胃。給藥時間均為4周,給藥期間均使用普通飼料喂養。
1.6觀察指標及方法
1.6.1主動脈粥樣硬化斑塊面積(PA)、血管管腔面積(LA):分別于造模后和治療后,每組處死15只大鼠,將大鼠主動脈根用石蠟包埋,HE染色顯微鏡下拍照并使用Image-Pro Plus 圖像分析多次拍攝照片中的PA、LA,校正斑塊面積=PA/LA。
1.6.2大鼠血清TG、TC、LDL-C、超敏C反應蛋白(hs-CRP)和Lp-PLA2含量:分別于造模后和治療后取大鼠血液0.5 ml,使用全自動生化分析儀檢測血清TG、TC、LDL-C和hs-CRP含量。使用Lp-PLA2試劑盒檢測血清Lp-PLA2含量,操作步驟及Lp-PLA2水平計算方式嚴格按照說明書進行。
2 結果
2.1大鼠體質量比較 造模期間3組大鼠體質量均呈增長趨勢。喂養1、4、5、6、7周3組大鼠體質量比較差異無統計學意義(P>0.05)。喂養2、3周,模型1、2組大鼠體質量高于健康組(P<0.05);模型1、2組大鼠體質量比較差異無統計學意義(P>0.05)。見圖1。
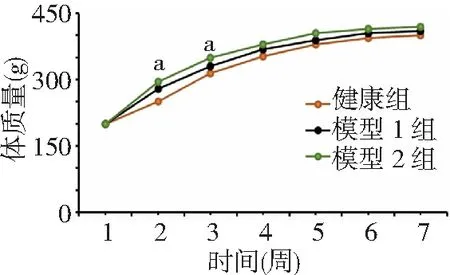
圖1 3組大鼠喂養7周體質量變化情況模型1、2組均為AS模型,模型1組造模初連續4 d給予維生素D3 20萬U/(kg·d)腹腔注射,模型2組一次性給予維生素D3 80萬U/kg腹腔注射;AS為動脈粥樣硬化;與健康組比較,aP<0.05
2.2大鼠主動脈粥樣硬化PA、血管LA比較 與健康組比較,模型1、2組造模后及治療后大鼠血管LA均降低(P<0.05)。與造模后比較,治療后模型1、2組血管LA增加,主動脈粥樣硬化PA及PA/LA降低,但模型2組治療后血管LA低于模型1組,主動脈粥樣硬化PA及PA/LA高于模型1組(P<0.05)。見表1。
表1 3組大鼠主動脈粥樣硬化PA及血管LA比較
2.3大鼠血清TG、TC、LDL-C含量比較 與健康組比較,造模后及治療后模型1、2組TG、TC、LDL-C含量升高,且模型2組高于模型1組(P<0.05)。與造模后比較,治療后模型1、2組TG、TC、LDL-C含量均顯著降低(P<0.05)。見圖2。

圖2 3組大鼠血清血脂水平比較模型1、2組均為AS模型,模型1組造模初連續4 d給予維生素D3 20萬U/(kg·d)腹腔注射,模型2組一次性給予維生素D3 80萬U/kg腹腔注射;TG為三酰甘油,TC為總膽固醇,LDL-C為低密度脂蛋白膽固醇;與健康組比較,aP<0.05;與模型1組比較,bP<0.05;與造模后比較,cP<0.05
2.4大鼠血清Lp-PLA2活性及hs-CRP比較 與健康組比較,造模后及治療后模型1、2組Lp-PLA2活性、hs-CRP含量均顯著升高,且模型2組Lp-PLA2活性高于模型1組,hs-CRP含量低于模型1組(P<0.05)。與造模后比較,治療后模型1、2組大鼠Lp-PLA2活性及hs-CRP含量均顯著降低(P<0.05)。見圖3。
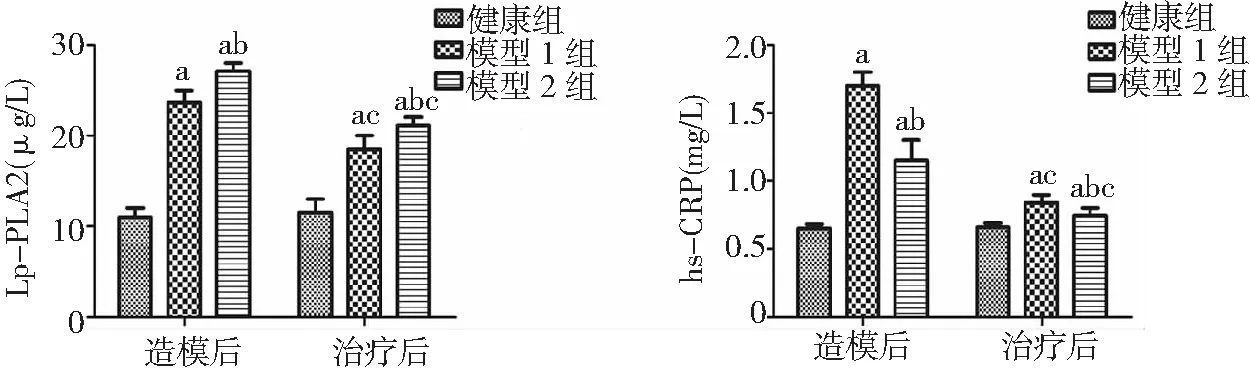
圖3 3組大鼠血清Lp-PLA2及hs-CRP水平比較模型1、2組均為AS模型,模型1組造模初連續4 d給予維生素D3 20萬U/(kg·d)腹腔注射,模型2組一次性給予維生素D3 80萬U/kg腹腔注射;Lp-PLA2為脂質蛋白相關磷脂酶A2,hs-CRP為超敏C反應蛋白;與健康組比較,aP<0.05;與模型1組比較,bP<0.05;與造模后比較,cP<0.05
3 討論
AS發病機制復雜,快速建立有效的AS模型,是研究其確切發病機制的重要手段。目前建立AS模型方法包括喂養法、機械損傷法、免疫學方法、化學誘導法、轉基因法等[8]。本研究采用高脂飼料喂養配合不同方法注射維生素D3建立大鼠AS模型,比較符合人類飲食特點,同時死亡率也較低。楊小蓉等[6]研究指出多次、小劑量使用維生素D3(鈣離子誘導劑)能破壞動脈血管內皮的完整性,利于血漿脂質侵入并損傷血管壁;同時因鈣鹽沉積,平滑肌細胞變形,加速了動脈病變形成,從而建立AS模型,但多次注射時間較長,一次性大劑量注射維生素D3亦可快速誘導大鼠形成AS模型。本研究分別采用上述兩種方法制備AS模型,檢測其主動脈粥樣硬化PA、血管LA及各項血脂指標,提示AS造模成功,與既往文獻一致[8-9]。
阿托伐他汀直接作用于血管緊張素轉化還原酶,抑制其活性,可降低患者血脂,改善血管內皮功能,穩定動脈血管斑塊,降低心腦血管事件發生風險,臨床主要用于高膽固醇血癥、冠心病等的治療[10]。鄒行斌和黃鶴[11]報道,阿托伐他汀可以降低血清血脂及炎性因子水平,使大鼠主動脈粥樣硬化PA縮小,從而抑制AS發展。本研究結果顯示,與健康組比較,模型1、2組造模后及治療后大鼠血管LA降低。與造模后比較,治療后模型1、2組血管LA增加,主動脈粥樣硬化PA及PA/LA降低。與模型1組比較,模型2組治療后血管LA降低,主動脈粥樣硬化PA及PA/LA升高,說明使用阿托伐他汀治療后大鼠AS病變得到了顯著改善,與徐臘生[12]研究結果一致。說明阿托伐他汀可以有效降低血脂,抑制AS進展并改善患者癥狀[13-14]。
Lp-PLA2是磷脂酶A2家族的一個亞類,可以催化多種氧化磷脂Sn-2位上酯鍵水解,產生游離脂肪酸和溶血磷脂[15]。劉建輝和張春妮[16]報道,Lp-PLA2活性與其濃度相關,當體內Lp-PLA2濃度升高其活性也會隨之升高,同時TG、高密度脂蛋白膽固醇具有一定的活化該酶的作用。本研究結果顯示,與健康組比較,造模后及治療后模型1、2組TG、TC、LDL-C及Lp-PLA2含量顯著升高,且模型2組上述指標高于模型1組。說明隨著AS大鼠體內血脂水平增高,Lp-PLA2活性亦顯著升高,穩定的AS模型大鼠體內Lp-PLA2通過分解脂類物質、促進炎癥反應和氧化應激反應,導致AS病變發展[17]。與造模后比較,治療后模型1、2組TG、TC、LDL-C及Lp-PLA2含量均顯著降低。說明當大鼠體內AS病變緩解后,Lp-PLA2氧化應激水平也顯著降低,對機體血管損傷減輕。提示Lp-PLA2活性能夠準確反映動脈粥樣斑塊炎癥反應和氧化應激程度,與相關文獻報道一致[18-19]。
hs-CRP是一種急性時相反應蛋白,可以反映人體內非特異性炎癥,其含量越高說明患者體內炎癥反應越活躍[20];粥樣硬化斑塊不穩定時,hs-CRP作為非特異性炎癥標志物升高[21],該指標亦是衡量冠狀動脈病變程度及判斷預后的重要指標[22-23]。毛海慧等[21]研究發現hs-CRP是高危斑塊的獨立危險因素。本研究結果顯示,與模型1組比較,模型2組造模后及治療后hs-CRP含量顯著降低,與既往文獻報道一致[24-25]。
綜上所述,血清Lp-PLA2水平能反映AS疾病嚴重程度和穩定性,且隨著AS病變嚴重程度和不穩定性增加而升高,可能與AS導致的炎癥與氧化應激反應相關。本研究證實了Lp-PLA2與AS大鼠疾病嚴重程度和穩定性相關,本課題組將在后續研究中,進一步使用Lp-PLA2抑制劑,探究降低Lp-PLA2是否可以改善AS相關實驗室檢查指標及癥狀。

