超聲引導下腔內射頻消融術聯合聚桂醇治療下肢靜脈曲張的效果
劉光輝,張琪潤,邱福軒
[焦作煤業(集團)有限責任公司中央醫院 普通外科三區,河南 焦作 454000]
下肢靜脈曲張是常見的血管疾病,患者主要為長期從事站立工作或體力勞動者,表現為病變淺靜脈延伸、擴展,患肢酸脹疼痛,可誘發營養障礙性疾病[1]。對病情較嚴重者一般采用手術治療。既往常規大隱靜脈高位結扎剝脫術創傷較大,術后恢復緩慢,具有一定局限性。近年來微創手術的不斷進展為下肢靜脈曲張治療提供了新方向,通過腔內射頻消融術、泡沫硬化劑治療的優勢明顯,包括創傷小、術后恢復快、并發癥少等。本研究探討超聲引導下腔內射頻消融術聯合聚桂醇治療下肢靜脈曲張的效果。
1 資料與方法
1.1 一般資料回顧性選取2019年4月至2020年9月焦作煤業(集團)有限責任公司中央醫院收治的107例下肢靜脈曲張患者。根據手術方案將患者分為對照組(53例)和觀察組(54例)。對照組:男29例,女24例;年齡36~65歲,平均(50.57±6.68)歲;病程4.5~16.5 a,平均(10.42±2.78)a;患肢為左側22例,右側31例;CEAP分級為C4a級26例,C4b級22例,C5級5例。觀察組:男28例,女26例;年齡35~67歲,平均(51.33±6.82)歲;病程4.0~17.5 a,平均(10.67±2.83)a;患肢為左側24例,右側30例;CEAP分級為C4a級25例,C4b級23例,C5級6例。兩組性別、年齡、病程、患肢側別、CEAP分級比較,差異無統計學意義(P>0.05)。
1.2 選取標準(1)納入標準:①經彩色多普勒超聲檢查確診為下肢靜脈曲張;②單側發病;③大隱靜脈主干直徑<15 mm;④患肢股靜脈與大隱靜脈交界處瓣膜存在反流;⑤臨床資料完善。(2)排除標準:①大隱靜脈根部存在瘤樣擴張;②超聲檢查顯示大隱靜脈主干扭曲;③大隱靜脈主干存在血栓;④過敏體質;⑤認知異常;⑥合并嚴重器官功能障礙;⑦妊娠期或哺乳期女性。
1.3 手術方法
1.3.1對照組 接受常規大隱靜脈高位結扎剝脫術:持續硬膜外麻醉,于大隱靜脈根部做切口,約6 cm,逐層剝離皮膚組織,充分暴露大隱靜脈根部,觀察靜脈主干及主要屬支,高位結扎靜脈,剝脫曲張靜脈部位,彈力繃帶加壓包扎。術后常規預防感染,使用彈力襪,維持腳踝壓力為30 mmHg(1 mmHg=0.133 kPa)。穿戴彈力襪1~2個月。
1.3.2觀察組 接受超聲引導下腔內射頻消融術聯合聚桂醇治療:術前8 h禁食,術前30 min肌內注射苯巴比妥0.1 g,哌替啶50 mg;囑患者取站位,超聲引導下標記大隱靜脈及曲張靜脈部位走行,在體表投影部位標記,并結合超聲定位點測量結果明確穿刺點,局部麻醉;對大隱靜脈進行腔內射頻消融,穿刺大隱靜脈主干,與隱股靜脈交界處1 cm左右置入6 F(1 F=0.33 mm)導管,在微導管絲引導下置入射頻導管,膝關節下扎止血帶,隔斷淺靜脈血流,排空大隱靜脈血液;導管到病變處后開啟射頻導管電極片,明確照射部位,接通射頻發射器,調節適當溫度;完成后復查,若血管皺縮欠佳則繼續治療;于小腿曲張靜脈點注入2 mL聚桂醇(陜西天宇制藥有限公司,國藥準字H20080445)。術后處理同對照組。
1.4 觀察指標
1.4.1手術效果 評估標準:顯效,即下肢靜脈曲張消失,超聲檢查未見血液反流;好轉,即下肢靜脈曲張基本消失或存在微小曲張,超聲檢查顯示存在輕微血液反流;無效,即下肢靜脈曲張改善不明顯,超聲檢查顯示存在明顯血液反流。總有效率為顯效率與好轉率之和。
1.4.2疼痛程度 術后2、6、12 h以視覺類比疼痛評分法(visual analog pain scale,VAPS)評估疼痛程度,分值0~10分,分值越高表明疼痛越嚴重。
1.4.3炎癥因子 術前及術后6個月抽取空腹靜脈血3 mL,離心處理(轉速3 000 r·min-1,離心10 min),以酶聯免疫吸附試驗檢測血清白細胞介素-6(interleukin-6,IL-6)、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、基質金屬蛋白酶-13(matrix metalloproteinase-13,MMP-13)水平。
1.4.4疾病嚴重程度和并發癥 術前及術后6個月以靜脈臨床嚴重程度評分表(venous clinical severity scale,VCSS)評估疾病嚴重程度,共10項,每項0~3分,分值越高表明疾病越嚴重。記錄術后并發癥。

2 結果
2.1 手術總有效率手術后,對照組無效8例,好轉20例,顯效25例;手術后,觀察組無效1例,好轉21例,顯效32例。觀察組手術總有效率[98.15%(53/54)]較對照組[84.91%(45/53)]高(χ2=4.491,P=0.034)。
2.2 疼痛程度術后2、6、12 h,觀察組VAPS評分均較對照組低(P<0.05)。見表1。
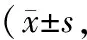
表1 兩組術后VAPS評分比較分)
2.3 炎癥因子兩組術前血清IL-6、TNF-α、MMP-13水平比較,差異無統計學意義(P>0.05);術后6個月,兩組血清IL-6、TNF-α、MMP-13水平均低于術前,觀察組血清IL-6、TNF-α、MMP-13水平低于對照組(P<0.05)。見表2。
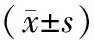
表2 兩組手術前后炎癥因子比較
2.4 VCSS評分兩組術前VCSS評分比較,差異無統計學意義(P>0.05);術后6個月,兩組VCSS評分較術前低,觀察組VCSS評分較對照組低(P<0.05)。見表3。
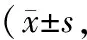
表3 兩組手術前后VCSS評分比較分)
2.5 術后并發癥對照組術后出現靜脈炎5例,感染1例,下肢深靜脈血栓3例;觀察組術后出現靜脈炎1例,感染1例。觀察組術后并發癥發生率[3.70%(2/54)]較對照組[16.98%(9/53)]低(χ2=5.112,P=0.024)。
3 討論
下肢靜脈曲張臨床較常見,多為經常站立、下肢粗壯造成下肢靜脈高壓所致。病情輕微者通過穿彈力襪、按摩或藥物治療可明顯緩解臨床癥狀,但對病情嚴重者則需通過手術進行治療。傳統手術以高位結扎剝脫術為主,可明顯緩解相應癥狀,減輕炎癥反應,效果明顯,但其局限性為手術創傷較大,術后恢復緩慢,且存在較高并發癥風險。因此,探討安全性更好的手術方案對下肢靜脈曲張患者具有重要的臨床意義。
近年來隨著醫療技術的不斷進步,手術微創化逐漸成為臨床趨勢。射頻消融術是臨床常用的微創術式,手術時間短,創傷小,患者痛苦程度低,有助于促進術后恢復,且術后不留明顯瘢痕,患者接受度高[2-3]。采用超聲引導下腔內射頻消融術治療下肢靜脈曲張可明顯改善臨床癥狀,糾正血液反流,消除靜脈曲張,通過破壞大隱靜脈內膜結構促使靜脈粘連,以達到治療的目的[4]。超聲引導下腔內射頻消融術結合聚桂醇泡沫硬化劑,可誘使靜脈血管及周圍黏膜組織產生無菌性炎癥反應以阻塞靜脈腔,緩解靜脈血管白細胞、內皮細胞炎癥反應[5-6]。與常規高位結扎剝脫術相比,超聲引導下腔內射頻消融術聯合聚桂醇治療具有操作簡單、創傷小等優勢,對增強手術效果有積極作用。本研究中,觀察組手術總有效率較對照組高且術后VAPS評分較對照組低。這證實了超聲引導下腔內射頻消融術聯合聚桂醇治療下肢靜脈曲張可提高手術效果,緩解術后疼痛。
炎癥反應是評估手術效果及術后病情程度的重要指標。TNF-α是常用的炎癥因子指標,可刺激釋放IL-6,誘導釋放血小板活化因子、活性氧相關中間產物,造成組織損傷,誘導細胞凋亡。TNF-α、IL-6水平對預測炎癥反應具有較高的靈敏度。MMP-13主要負責清除細胞外基質,參與細胞外基質代謝。測定曲張靜脈管壁MMP-13水平可反映細胞外基質重塑情況,從而評估下肢靜脈曲張程度[7-8]。本研究中,術后6個月觀察組血清IL-6、TNF-α、MMP-13水平以及VCSS評分較對照組低。這提示超聲引導下腔內射頻消融術聯合聚桂醇治療可有效緩解炎癥反應,減輕病情程度。觀察組術后并發癥發生率較對照組低,表明超聲引導下腔內射頻消融術聯合聚桂醇治療的并發癥較少。
超聲引導下腔內射頻消融術聯合聚桂醇治療下肢靜脈曲張的效果確切,可緩解炎癥反應,減輕患者疼痛感,減少并發癥。

