采用組合策略提高灰色鏈霉菌胰蛋白酶在畢赤酵母中的表達
彭文堅,張娟,劉松*
1(糧食發酵工藝與技術國家工程實驗室(江南大學),江蘇 無錫,214122)2(江南大學 生物工程學院,江蘇 無錫,214122)
胰蛋白酶(EC 3.4.21.4)是一種堿性蛋白酶,能專一性催化蛋白質肽鏈中精氨酸(R)或賴氨酸(K)殘基羧基端的肽鍵或酰胺鍵的水解[1]。胰蛋白酶已經廣泛應用于皮革軟化、洗滌、食品和制藥工業,約占工業酶制劑市場的3%[2]。目前大部分市售胰蛋白酶主要從豬、牛、羊等哺乳動物[3]的胰腺組織提取。然而,哺乳動物組織提取物通常具有免疫原性及病原體污染[4]等隱患,限制了其在食品與醫藥領域的應用。因此,微生物來源胰蛋白酶的開發成為重要研究方向。
目前動物來源胰蛋白酶的異源表達以豬胰蛋白酶為主要研究對象,其在大腸桿菌中以包涵體形式表達,在包涵體復性后,最高產量為209 mg/L活性胰蛋白酶[5](2 L發酵罐)。在畢赤酵母中,豬胰蛋白酶以酶原的形式表達,產量為480 mg/L,經腸激酶激活后酶活力可達19.2 U/mL[6](5 L發酵罐)。微生物來源胰蛋白酶主要研究對象為尖孢鐮刀菌胰蛋白酶(Fusariumoxysporumtrypsin,FOT)與灰色鏈霉菌胰蛋白酶(Streptomycesgriseustrypsin, SGT)。FOT在畢赤酵母中以成熟酶的形式表達,酶活力為2.7 U/mL(搖瓶水平)[7]。重組SGT在大腸桿菌中同樣以包涵體形式存在,而在變鉛青鏈霉菌與枯草芽孢桿菌中SGT以成熟酶的形式實現了活性表達,最大酶活力分別為9.21 U/mL(搖瓶水平)[8]與33.8 U/mL(搖瓶水平)[9]。針對SGT表達量低、酶原活化效率低和穩定性差等問題,本研究室通過融合高效分泌信號肽、自活化前導肽、疏水性前導肽及自降解位點突變(R145I/K101A/R201V)等策略[10-12],實現了SGT在畢赤酵母中的高效活性表達,5 L發酵罐的酰胺降解酶活力為549.18 U/mL,是目前文獻報道的重組SGT最高產量。因此,畢赤酵母較其他宿主更適于SGT的表達。
目前,研究者已提出一系列基于宿主改造和發酵條件優化提高畢赤酵母產酶性能的策略。畢赤酵母宿主改造主要基于過量表達分子伴侶,其中Cne1蛋白具有輔助糖蛋白折疊的功能,與葡萄糖氧化酶(glucose oxidase,GOD)共表達時,GOD酶活力提高141%[13]。Ssa4與Bmh2蛋白能夠提高蛋白運輸速率,2F5 FAB單克隆抗體片段與其分別共表達時,表達量分別提高了60%與50%[14]。Vhb蛋白能夠增強氧氣運輸速率,與纖維素酶Cel5A共表達時,Cel5A的酶活提高了40%[15]。此外,轉錄因子Yap1參與畢赤酵母碳水化合物代謝與氧化應激反應,其與β-葡萄糖醛酸苷酶PGUS共表達時,PGUS酶活力提高80.4%[16]。轉錄因子Aft1參與蛋白折疊和分泌,與水蛭透明質酸酶LHyal共表達時,LHyal酶活力提高47.1%[17]。發酵條件優化集中于培養基pH優化及補料控制。對于最適反應pH或穩定pH偏堿性的重組酶,pH<5.5將限制活性酶的產量。在中性pH條件下誘導表達Penicilliumcyclopium二酰基甘油脂肪酶在畢赤酵母的胞外表達量可達到2.43 g/L[18]。以甲醇為誘導劑的醇氧化酶 (alcohol oxidase,AOX)啟動子是畢赤酵母系統最重要的啟動子之一,但甲醇對細胞的毒害作用日趨受到重視。作為AOX1啟動子的非抑制性碳源,山梨醇與甲醇混合補料能將畢赤酵母主要供能途徑由甲醛異化供能轉向三羧酸循環,細胞產熱與耗氧速率下降的同時強化目標蛋白合成途徑[19-20]。
在前期構建的產SGT重組畢赤酵母的基礎上[10-11],本研究考察了轉錄因子(Aft1和Yap1)及分子伴侶(Cne1、Ssa4、Bmh2和Vhb)對SGT表達的影響,并優化了發酵pH及補料策略,顯著提高了SGT的發酵水平,為降低胰蛋白酶工業化生產提供了重要的基礎數據。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株與質粒
整合表達質粒pGAPZB[17]、EscherichiacoliJM109和重組菌PP-SGTm[11](含重組質粒pPIC9K-SGTm的PichiapastorisGS115)均為作者所在實驗室保存。
1.1.2 主要試劑
限制性內切酶AvrⅡ、大腸桿菌感受態制備試劑盒、PrimerSTAR Max DNA 聚合酶、酵母基因組DNA 抽提試劑盒,TaKaRa 公司;無縫克隆試劑盒、博萊霉素、質粒提取試劑盒,上海生工公司;酵母粉、胰蛋白胨,Oxoid 公司;底物BAPNA,Sigma 公司(美國);蛋白質Maker、蛋白電泳 Loading buffer、Bis-Tris 預制凝膠,Invitrogen 公司;BCA 蛋白濃度檢測試劑盒,天根公司。其他常規試劑及藥品為國產或進口分裝。
1.1.3 培養基
LB培養基(g/L):酵母提取物 5,蛋白胨 10,NaCl 5,pH 7.0。
YPD 培養基(g/L):酵母提取物 10,蛋白胨 20,D-葡萄糖 20。
BMMY培養基:酵母提取物10 g/L,蛋白胨20 g/L,甲醇10 g/L,PBS 50 mmol/L,10×YNB 酵母基礎氮源母液10%(體積分數),生物素 4×10-4g/L。
BMGY培養基:酵母提取物10 g/L,蛋白胨20 g/L,甘油20 g/L,PBS 50 mmol/L,10×YNB酵母基礎氮源母液10%(體積分數),生物素 4×10-4g/L。
BSMG 培養基(g/L):CaSO4·2H2O 0.93,K2SO424.6,MgSO4·7H2O 14.9,(NH4)2SO410,甘油 40,六水甘油磷酸鈉 12,PTM1 4 mL/L。
PTM1 微量元素溶液(g/L):CuSO4·5H2O 6,KI 0.08,MnSO4·H2O 3,Na2MoO4·2H2O 0.2,H3BO30.02,CoCl20.5,ZnCl220,FeSO4·7H2O 65,Biotin 0.2,H2SO45 mL/L。
1.2 實驗方法
1.2.1 分子伴侶及轉錄因子表達載體的構建及轉化
按表1引物以畢赤酵母GS115基因組為模板擴增Bmh2(Genebank NO:28198501)、Cne1(Genebank NO:8198102)、Ssa4(Genebank NO:8197809)、Yap1(Genebank NO:18200866)與Aft1(Genebank NO:18200866)基因;以質粒pGapZB為模板,擴增含有相應分子伴侶基因同源臂的載體片段。按照上海生工無縫克隆試劑盒說明書,連接轉錄因子或分子伴侶基因與對應載體片段。連接完成后轉化E.coliJM109,提取重組質粒進行測序驗證。Vhb(GenBank No.AAA27585.1)基因由上海生工根據畢赤酵母密碼子偏好性合成,并克隆至pGapZB載體(圖1-a)。
將上述分子伴侶及轉錄因子的表達載體分別用AvrⅡ酶切,將線性化的載體轉化PP-SGTm感受態。將菌液涂布于含100 μg/mL博萊霉素YPD平板,采用pGapZB載體的通用引物pGAPF與3AOX(表1)進行菌落PCR驗證。獲得單一目標分子伴侶或轉錄因子基因條帶的克隆即為陽性轉化子。
1.2.2 重組畢赤酵母搖瓶發酵
重組畢赤酵母于YPD平板30 ℃培養48 h后,挑取單菌落接種含有50 mL YPD培養基的250 mL 搖瓶中,于30 ℃和220 r/min培養至OD600=7。將發酵液于5 000 r/min離心5 min,去除上清液后,用無菌生理鹽水洗滌菌體沉淀2次。分別用50 mL pH為5.0、5.5、6.0、6.5和7.0 的BMMY培養基重懸菌體,于30 ℃和220 r/min 下繼續發酵,每24 h補加1%的甲醇。發酵120 h后,取發酵上清液測定SGT酶活力。
為測定pH對菌體生長的影響,重組畢赤酵母于YPD平板30 ℃培養48 h后,挑取單菌落接種至pH分別為5.0、5.5、6.0、6.5和7.0 的含50 mL BMGY培養基的250 mL搖瓶中,30 ℃和220 r/min培養120 h。測定OD600并繪制生長曲線。

表1 本研究所用引物Table 1 Primers used in this study
1.2.3 重組畢赤酵母5 L罐發酵
將重組畢赤酵母在YPD平板上30 ℃培養48 h,挑取單菌落接種含有200 mL YPD培養基的2 L 搖瓶中,30 ℃、220 r/min培養至OD600=7。將發酵液接種至含有2 L BSMG培養基的5 L發酵罐中。以50%氨水和30%磷酸溶液控制pH 5.5,設定初始發酵溫度、攪拌轉速和通氣量分別為30 ℃、400 r/min和2 L/min;當發酵液溶解氧上升至60%時,以0.18/h的比生長速率,指數流加250 mL的500 g/L甘油(含12 mL/L PTM1),通氣量調節至4 L/min,攪拌轉速與溶氧關聯(溶解氧維持20%)。指數速率如公式(1)所示:
(1)
式中:μset,設定比生長速率,h-1;ρx0,初始菌體質量濃度,g/L;V0,初始體積,L;ρs,發酵液中甘油濃度,g/L;YX/S,菌體得率系數,g/g;t,指數流加開始后的發酵時間。
待發酵液溶解氧再次上升至60%時,控制pH 6.5開始恒速流加甲醇與山梨醇[6 g/(L·h)]。甲醇與山梨醇的質量比分別設為20∶0、20∶0.5、20∶1和20∶1.5。每隔12 h取1次樣,測定菌體干重和酶活力等性質。
1.2.4 甘油濃度的測定
采用高碘酸鈉比色法[21]測定發酵液中的甘油濃度。
1.2.5 胰蛋白酶酰胺酶活力的測定
以Nα-苯甲酰-DL-精氨酸-p-硝基苯酰胺(Nα-benzoyl-DL-arginine-4-nitroanilide hydrochloride,BAPNA)為底物測定胰蛋白酶活力。將100 μL酶液與900 μL BAPNA溶液(50 mmol/L pH 8.0 磷酸鉀緩沖液,20 mmol/L CaCl2,10 mmol/L BAPNA)混合后,測定其在37 ℃下410 nm處吸光值變化值(ΔA410/min)。酶活力定義為:在37 ℃下,升高0.1即為胰蛋白酶的1個酰胺酶水解單位[12]。計算如公式(2)所示:
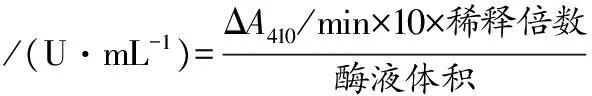
(2)
1.2.6 畢赤酵母醇氧化酶活力的測定
取1 mL重組畢赤酵母發酵液,離心后收集菌體,用去離子水洗滌2次。用50 mmol/L pH 7.5 的PBS重懸并測定OD600。取300 μL的重懸液于0 ℃高壓勻漿破碎,加入700 μL PBS 溶液,混勻后于4 ℃和8 000 r/min離心10 min,取上清液置于冰上。反應體系共3 mL:100 mmol/L pH 6.0 PBS,4.3 μmol/L苯酚,200 μmol/L甲醇,1 μmol/L 4-氨基安替吡啉,15 U的辣根過氧化物酶以及1 mL待測酶液。在37 ℃下測定在500 nm處吸光度的改變,計算醌的增加量從而測定醇氧化酶的活力。酶活力單位定義為:1 mL 細胞重懸液,在OD600=1時,37 ℃,pH 6.0的條件下1 min產生1 μmol 的過氧化氫所需的酶量[22]。
1.2.7 SDS-PAGE 凝膠電泳分析
具體操作方法請參考Invitrogen 公司Bis-Tris 預制凝膠說明書。
2 結果與分析
2.1 共表達轉錄因子及分子伴侶對SGT酶活力的影響
在前期構建的重組畢赤酵母中[10-11],以pPIC9K為整合表達載體,在SGT突變體(R145I/K101A/R201V/Q151P)上游依次融合了高效分泌信號肽、自活化前導肽及疏水性前導肽(圖1-a)。為進一步提高SGT的表達水平,基于pGAPZB分別構建了轉錄因子(Aft1和Yap1)及分子伴侶(Cne1、Ssa4、Bmh2和Vhb)的整合表達載體(圖1-a),并轉化至上述重組畢赤酵母中與SGT共表達。菌落PCR分析顯示,擴增得到的轉錄因子及分子伴侶基因片段得到與各自理論分子量一致的條帶(圖1-b)。
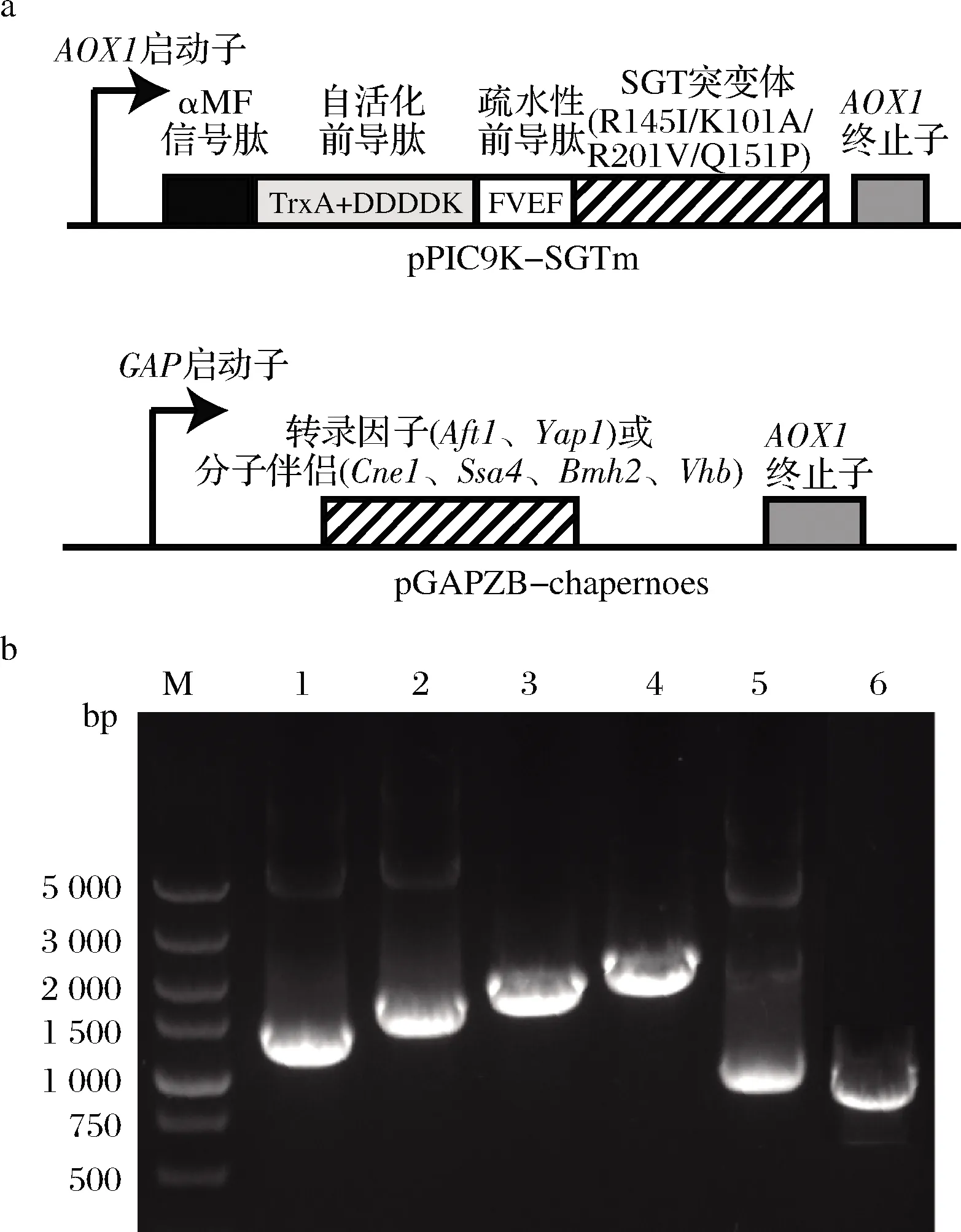
M-DNA標準分子質量;1-Aftl;2-Yapl;3-Cnel;4-Ssa4;5-Bmh2;6-Vhb a-SGT突變體與分子伴侶或轉錄因子表達質粒示意圖; b-菌落PCR驗證共表達菌株圖1 共表達SGT突變體與分子伴侶(或轉錄因子) 重組畢赤酵母的構建Fig.1 The scheme of the recombinant P.pastoris co-expressing SGT mutant and chaperones (or transcription factors)
如圖2所示,甲醇誘導120 h后,共表達轉錄因子Aft1使SGT酶活力提高19.71%,達到217.30 U/mL,而其他轉錄因子或分子伴侶的表達使SGT酶活力有所下降。Aft1的過表達也使胞外總蛋白含量較對照提高了9.8%達到了753.51 μg/mL。研究表明,在畢赤酵母中Aft1調控多個分子伴侶的表達,涉及蛋白折疊(Pdi1和BiP)、糖基化(Och1)、胞內運輸(Sec12、Sec23、Sec61和Gos1)及蛋白跨膜運輸(Kin1)等過程[23]。上述結果表明,Aft1有效促進了SGT的分泌表達。
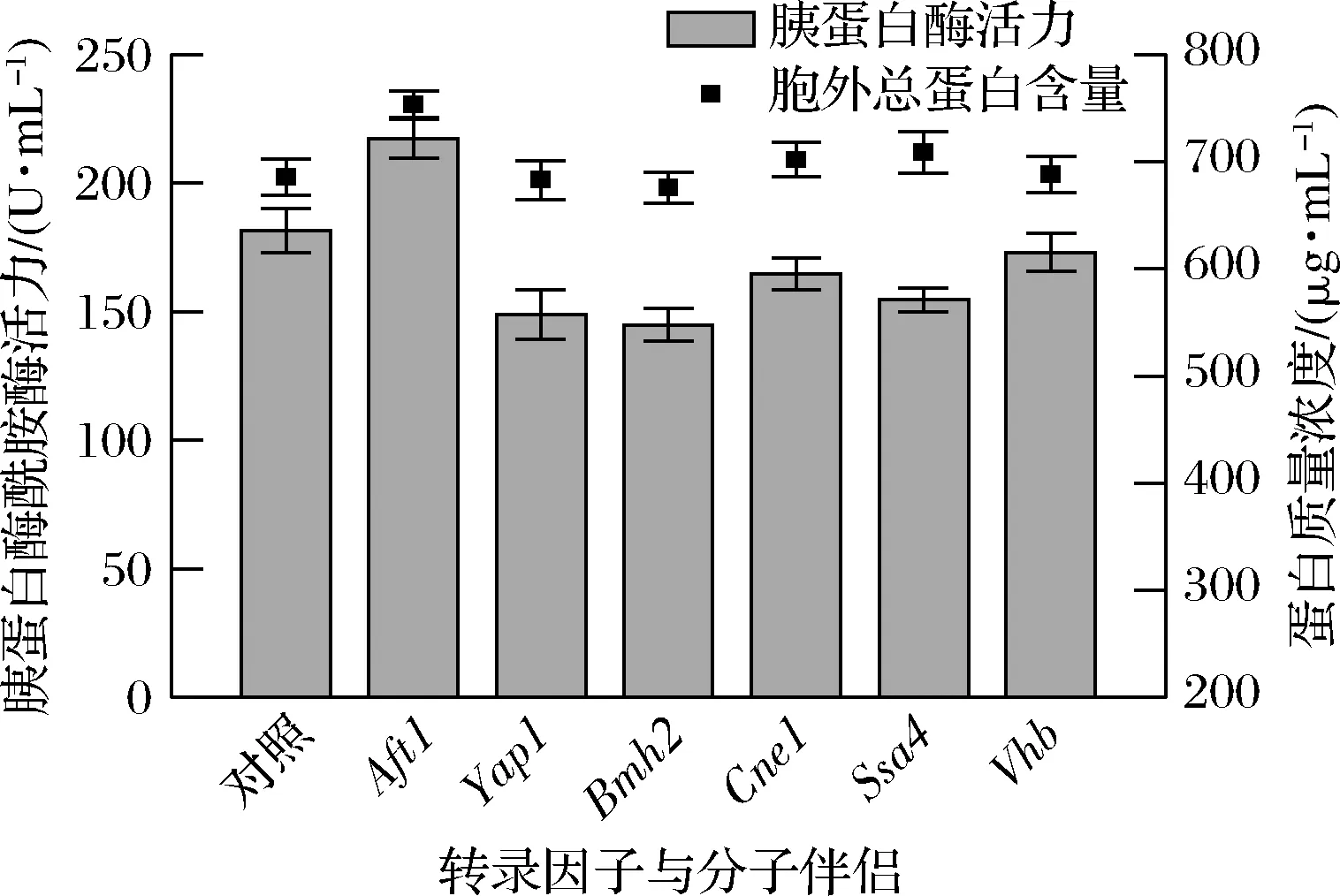
圖2 共表分子伴侶或轉錄因子對SGT產量的影響Fig.2 The effect of the co-expression of transcription factors or chaperones on SGT yield in shake-flask
2.2 pH對SGT在畢赤酵母中表達的影響
在前期研究中,SGT上游融合了牛胰蛋白酶的酶原區序列DDDDK(圖1-a),能夠被SGT自身所識別和切割,使得以前體形式合成的SGT實現自活化[12]。值得注意的是,SGT的最適反應pH為8.0[12],而畢赤酵母發酵通常在pH 5.0~5.5的環境下進行,較低pH發酵環境顯然不利于SGT的自活化。因此,重組畢赤酵母誘導階段的pH可能是影響SGT活性表達的重要因素。
搖瓶培養結果顯示,在BMMY培養基中,重組菌PP-SGTm/Aft1的最適誘導表達pH為6.5,較pH 5.5下的酶活力提高了16.71%,達到了253.61 U/mL(圖3-a)。然而,進一步將pH提高至7.0,SGT酶活力卻顯著下降(圖3-a)。將重組菌PP-SGTm/Aft1分別接入pH 5~7的BMGY培養基測定其生長曲線。結果顯示,發酵菌株的最適生長pH為5.5,發酵菌株在搖瓶培養64 h后OD600達到了最大值(圖3-b)。當環境pH達到7時,PP-SGTm/Aft1的生長受到明顯抑制(圖3-b)。上述結果表明,pH 6.5提高了SGT活化效率的同時,又確保了重組菌生長活性。
基于pH優化結果,驗證了PP-SGTm/Aft1在5 L罐的發酵產量。將生長階段控制在5.5以獲得最大菌體濃度與將誘導階段的pH控制在6.5。為克服發酵罐常用基礎鹽培養基(BSM)在pH>5.5易形成磷酸鹽沉淀的問題,選用BSMG培養基進行發酵[18]。如圖4所示,BSMG培養基在發酵120 h時,菌體干重達到最大值121.62 g/L;發酵144 h后,酶活力達2 220.34 U/mL,較搖瓶發酵提高7.75倍。
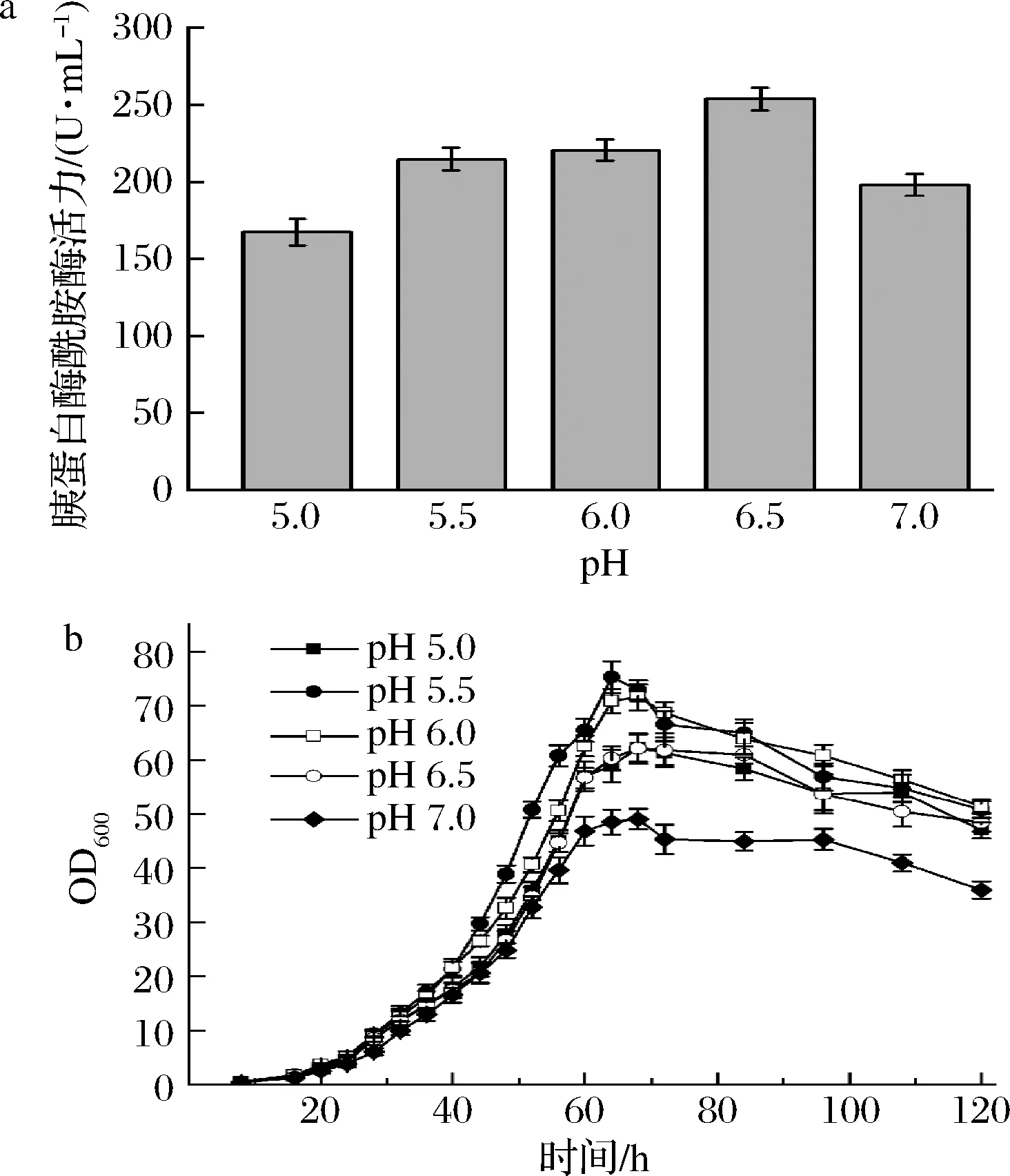
a-不同pH的BMMY對SGT產量的影響; b-不同pH的BMGY對PP-SGTm/Aft1生長的影響圖3 pH對重組畢赤酵母PP-SGTm/Aft1發酵的影響Fig.3 The effect of pH on the fermentation of the PP-SGTm/Aft1
2.3 雙碳源混合流加提高SGT發酵水平
重組畢赤酵母單獨流加甲醇時,高濃度的甲醇易對菌體產生毒害作用,且細胞生長和外源蛋白表達途徑會競爭甲醇,影響外源蛋白表達效率。研究顯示,在誘導過程中添加少量山梨醇能夠顯著改善上述問題[24]。如圖4-a所示,甲醇與山梨醇以20∶0.5的質量比混合流加時,SGT產量在發酵144 h后達到了2 667.24 U/mL,較僅流加甲醇的酶活力提高了20.1%。進一步提高甲醇與山梨醇質量比至20∶1時,SGT產量有所下降,但仍高于僅流加甲醇的酶活力。當甲醇與山梨醇質量比達到20∶1.5時,SGT產量低于純甲醇流加(圖4-a)。SDS-PAGE分析顯示,在發酵60 h后各流加條件下,重組菌發酵上清液均能看到較清晰的SGT蛋白條帶(圖4-b)。與僅流加甲醇相比,甲醇與山梨醇質量比為20∶0.5和20∶1時對應的SGT蛋白條帶更粗,與酶活力測定結果一致(圖4-b)。
與僅流加純甲醇相比,發酵144 h時,雙碳源混合流加使菌體量提高22.1%~29.1%,高山梨醇流加比例更有助于菌體生長(圖4-c)。混合流加能夠改善菌體生長狀況,但菌體生長與SGT的產量并不密切相關(圖4-a、圖4-c)。重組菌PP-SGTm/Aft1中,SGT以醇氧化酶(AOX)啟動子表達,宿主AOX的變化能夠間接反應SGT基因的表達效率。如圖4-d所示,甲醇與山梨醇以質量比20∶0.5和20∶1混合流加時,發酵60 h后AOX 活性比單流加甲醇分別提高36.3%和43.7%,且發酵后期仍能維持更高的AOX活性;而甲醇與山梨醇以質量比20∶1.5流加與僅補甲醇的AOX活性相近,且在發酵后期其活性低于后者(圖4-d)。上述結果表明,雙碳源混合流加增強了AOX1啟動子活性,從而提高SGT在畢赤酵母中的產量。
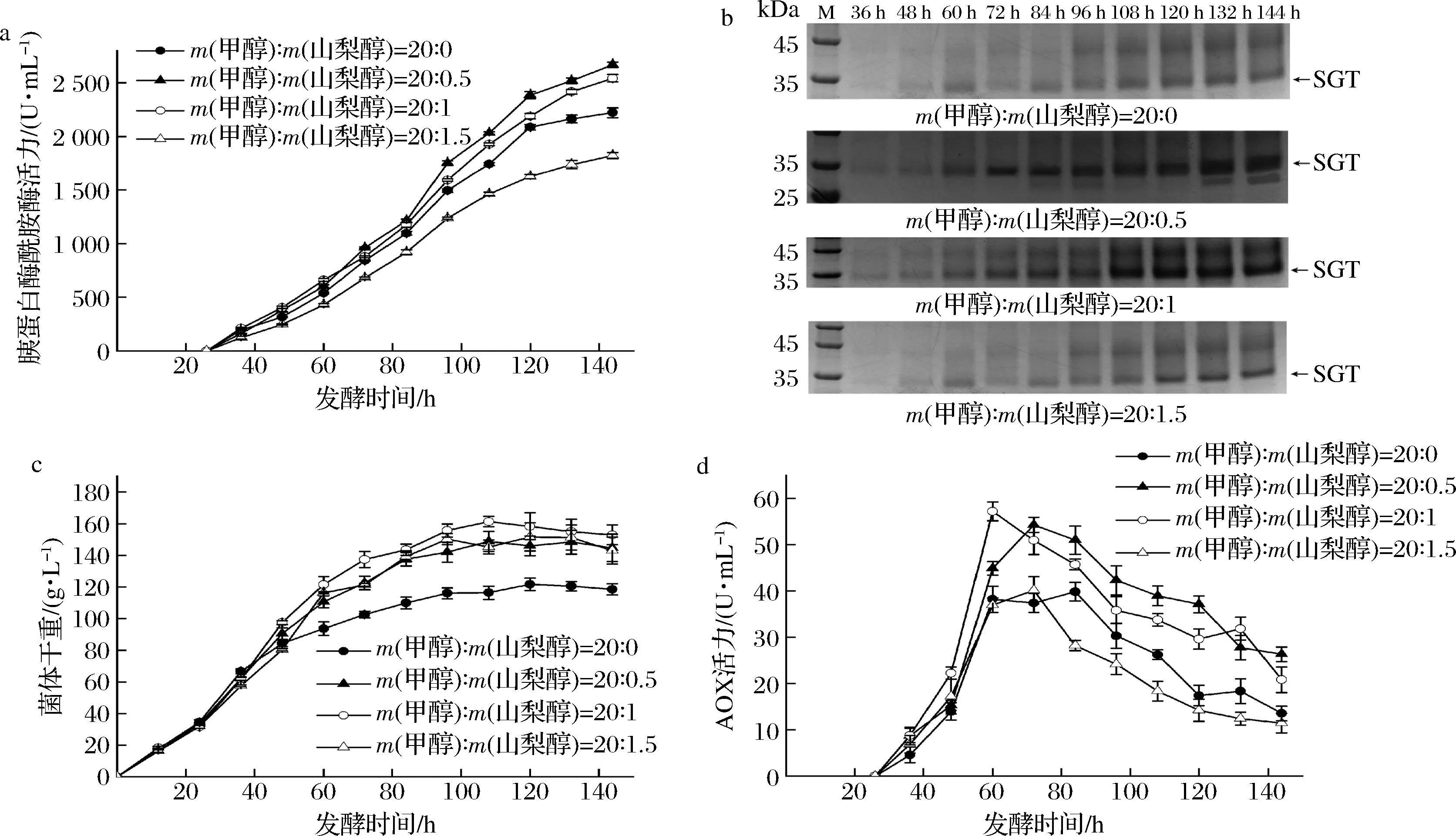
a-雙碳源混合比例對SGT活力的影響;b-SDS-PAGE分析雙碳源混合比例對SGT表達量的影響; c-雙碳源混合比例對菌體生長的影響;d-雙碳源混合比例對AOX活力的影響圖4 甲醇與山梨醇混合流加對PP-SGTm/Aft1發酵的影響Fig.4 The effect of the co-feeding of methanol and sorbitol on the fermentation of the PP-SGTm/Aft1
3 結論與討論
早期應用畢赤酵母異源表達胰蛋白酶的研究中,由于對畢赤酵母表達系統的研究不夠完善使得胰蛋白酶活力達到19.2 U/mL后沒有進一步提升[6]。隨著畢赤酵母作為表達異源蛋白宿主的研究不斷深入,使用更高效的表達元件[10]、發掘更新穎與高效的轉錄因子與分子伴侶[16]以及針對目的蛋白性質優化發酵條件[18]是目前克服畢赤酵母表達瓶頸的主要手段。
本研究在前期構建的高產SGT重組畢赤酵母的基礎上,通過共表達轉錄因子Aft1使搖瓶水平的SGT產量提高19.71%。轉錄因子Aft1能夠調控蛋白分泌相關的多個分子伴侶,這可能是較其他分子伴侶更有助于提高SGT表達水平的主要原因。由于SGT以前體形式合成,發酵過程高效自活化亦是影響其活性表達的重要因素。基于SGT的最適反應pH與畢赤酵母最適生長pH的差異,本研究確定了最佳的發酵pH為6.5。因此,有效平衡SGT的活化和菌體生長,同樣是提高SGT活性表達的有效途徑。在上述菌株改造和條件優化的基礎上,采用混合流加碳源[m(甲醇)∶m(山梨醇)=20∶0.5]使SGT發酵水平進一步提升至2 667.24 U/mL,為其工業化發酵生產提供了重要基礎數據。
SGT能夠催化蛋白水解,發酵過程中成熟SGT的自降解同樣是其高產的主要限制性因素[11]。通過分子改造提高SGT分子穩定性和抗自降解能力,將是其后續研究的主要內容之一。