紫藍(lán)草紫色素提取工藝優(yōu)化及其對(duì)糯米染色的表觀性能研究
弘子姍,陸挎仙,黃文豪,龔加順
(云南農(nóng)業(yè)大學(xué) 食品科學(xué)技術(shù)學(xué)院,云南 昆明,650201)
紫藍(lán)草(Peristropheroxburghiana)為爵床科植物,又名紅藍(lán)、紅絲線[1],紫藍(lán)草具有清熱解毒、消腫止痛等功效[2-3]。有研究表明,紫藍(lán)草含有黃酮類化合物、生物堿、β-谷甾醇、豆甾醇、香豆素、苯丙素、三萜、甾體、苷類及揮發(fā)油等化學(xué)成分[4-7],具有多種生物和藥物活性,包括防癌[8]、降血壓[9]、降血脂[10]、抗炎[11]、保護(hù)肝臟[12-13]、抑制血栓[14]等。民間常把紫藍(lán)草用來染制糯米,蒸出來的紫色糯米晶瑩剔透,清香撲鼻,是云南、貴州等少數(shù)民族特色食品“五彩飯”的一種。
近幾年我國有關(guān)天然色素的提取、抗氧化活性評(píng)估、組成成分分析、安全性評(píng)價(jià)等領(lǐng)域的研究逐漸增多,如成黎[15]對(duì)天然色素的特性、應(yīng)用、安全性進(jìn)行了評(píng)價(jià);黎海利等[16]對(duì)紅肉火龍果皮色素進(jìn)行了提取工藝的優(yōu)化及其抗氧化性的研究;劉長姣等[17]對(duì)黑米色素成分及提取工藝進(jìn)行了綜述。隆金橋等[18-19]對(duì)紫藍(lán)草紫色素的提取及穩(wěn)定性進(jìn)行了研究,發(fā)現(xiàn)紫色素具有一定的耐氧化性,其提取工藝為:微波功率320 W、微波時(shí)間80 s、料液比1∶20。
目前針對(duì)地方特色五彩飯中紫藍(lán)草色素對(duì)大米染色方面的研究尚未見報(bào)道。植物色素對(duì)大米的著色是植物色素與大米淀粉和蛋白質(zhì)發(fā)生了結(jié)合作用。徐塬等[20-22]對(duì)烏飯樹樹葉色素對(duì)大米蛋白和淀粉相互作用進(jìn)行研究,認(rèn)為烏飯樹葉色素與大米蛋白之間以疏水作用和氫鍵作用進(jìn)行結(jié)合;劉立增等[23]探討紅曲紅色素在淀粉顆粒表面的吸附機(jī)制中發(fā)現(xiàn)羥基紅曲紅色素分子與淀粉顆粒間的吸附是以氫鍵為主的物理吸附作用;AMOAKO等[24]在研究中發(fā)現(xiàn)直鏈淀粉和聚合原花青素之間形成II型半結(jié)晶V型包合物。但就目前來看,在天然色素對(duì)糯米中淀粉與蛋白相互作用機(jī)制方面的研究還相對(duì)較少。
本文以云南產(chǎn)的人工種植紫藍(lán)草為原料,采用紫外可見光譜確定紫藍(lán)草紫色素提取溶劑乙醇濃度的選擇及最大吸收波長;采用單因素和響應(yīng)面優(yōu)化設(shè)計(jì),對(duì)紫藍(lán)草紫色素的提取工藝進(jìn)行優(yōu)化,并通過掃描電鏡(scanning electron microscope, SEM)初步研究?jī)?yōu)化提取的色素對(duì)糯米的染色表觀性能的影響,以期獲得紫藍(lán)草色素最佳提取工藝,為紫藍(lán)草染制糯米的產(chǎn)業(yè)化生產(chǎn)和紫藍(lán)草色素開發(fā)利用提供理論依據(jù),為少數(shù)民族特色食品——五彩飯的開發(fā)提供科學(xué)依據(jù)。
1 材料與方法
1.1 材料與試劑
紫藍(lán)草,于2019年8月10日采自云南省紅河州河口縣橋頭鄉(xiāng)甘子樹村,東經(jīng)103°23′~104°17′,北緯22°30′~23°02′,海拔930 m,曬干儲(chǔ)存?zhèn)溆茫慌疵桩a(chǎn)自云南版納;無水乙醇,分析純。
1.2 儀器與設(shè)備
DFT-100型手提式高速中藥粉碎機(jī),溫嶺市林大機(jī)械有限公司;RE-5210型旋轉(zhuǎn)蒸發(fā)器,上海亞榮生化儀器廠;TDL-5-A型離心機(jī),上海安亭科學(xué)儀器廠;FD-1A-50型冷凍干燥機(jī),上海比朗儀器制造有限公司;80-2型離心機(jī),上海安亭科學(xué)儀器廠;UV-1800型紫外可見分光光度計(jì),上海翱藝儀器有限公司;S-4800 型掃描電子顯微鏡,日本日立公司。
1.3 實(shí)驗(yàn)方法
1.3.1 紫藍(lán)草紫色素提取工藝
紫藍(lán)草紫色素提取工藝如下:
紫藍(lán)草→烘干→磨粉→過篩→加入30%(體積分?jǐn)?shù))乙醇溶液47 ℃浸提20 min→離心過濾→旋轉(zhuǎn)蒸發(fā)濃縮→冷凍干燥→粗提物(備用)
1.3.2 紫藍(lán)草紫色素提取溶劑的選擇及最大吸收波長的確定
稱取1.0 g植物粉末于錐形瓶中,分別加入50 mL超純水、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%(均為體積分?jǐn)?shù))乙醇,在50 ℃條件下浸提2 h,取出于3 000 r/min離心10 min,取上清液稀釋相同倍數(shù),在190~800 nm做紫外可見光光譜掃描。
1.3.3 單因素試驗(yàn)設(shè)計(jì)
以吸光度為指標(biāo),在不同條件下考察料液比、提取時(shí)間、提取溫度3個(gè)因素對(duì)紫藍(lán)草提取效果的影響。
1.3.3.1 料液比對(duì)紫藍(lán)草紫色素提取吸光度的影響
稱取1.00 g植物粉末于錐形瓶中,加入10、20、30、40、50、60、70 mL 30%(體積分?jǐn)?shù))乙醇,在50 ℃條件下浸提2 h,取出于3 000 r/min離心10 min,取上清液稀釋至相同體積,在598 nm測(cè)吸光度。
1.3.3.2 提取溫度對(duì)紫藍(lán)草紫色素提取吸光度的影響
稱取1.00 g植物粉末于燒杯中,加入40 mL 30%乙醇,在30、40、50、60、70、80 ℃條件下浸提2 h,取出于3 000 r/min離心10 min,取上清液稀釋相同倍數(shù),在598 nm測(cè)吸光度。
1.3.3.3 提取時(shí)間對(duì)紫藍(lán)草紫色素提取吸光度的影響
稱取1.00 g植物粉末于燒杯中,加入40 mL 30%乙醇,在50 ℃條件下浸提10、20、30、40、50 min,取出于3 000 r/min離心10 min,取上清液稀釋相同倍數(shù),在598 nm測(cè)吸光度。
1.3.4 響應(yīng)面優(yōu)化試驗(yàn)設(shè)計(jì)
響應(yīng)面試驗(yàn)設(shè)計(jì)如表1所示:

表1 響應(yīng)面試驗(yàn)因素與水平設(shè)計(jì)表Table 1 Independent variables and their levels used in response surface analysis
1.3.5 掃描電鏡的樣品制備
1.3.5.1 紫藍(lán)草色素染色糯米飯制備
以傳統(tǒng)民間植物染飯工藝流程為基礎(chǔ),結(jié)合曹昌偉等[25]密蒙花黃色素染制黃米飯工藝,基本工藝流程為:
原料糯米→稱量→淘洗→紫藍(lán)草染料常溫浸泡5 h
1.3.5.2 掃描電子顯微鏡觀察
以紫藍(lán)草紫色素、白糯米、紫藍(lán)草紫色素染色糯米為觀測(cè)樣本。挑選出外形完整的米粒,用刀片將米粒橫向從中間斷開。讓米粒的斷面朝上,用導(dǎo)電雙面膠粘附在銅臺(tái)上,采用離子濺射儀對(duì)斷面進(jìn)行真空噴金處理。然后在 10.0 kV的工作電壓下,分別放大不同倍數(shù)并拍照記錄。
1.4 數(shù)據(jù)處理
采用Excel 2010、Design-Expert 8.0.6、Origin Pro 9.1進(jìn)行數(shù)據(jù)整理和響應(yīng)面分析;利用 SPSS 19.0 進(jìn)行方差顯著性分析。
2 結(jié)果與分析
2.1 單因素試驗(yàn)
2.1.1 紫藍(lán)草紫色素提取溶劑的選擇及最大吸收波長的確定
當(dāng)乙醇體積分?jǐn)?shù)為0%~40%時(shí),紫藍(lán)草色素的紫外吸收光譜趨勢(shì)如圖1所示,此時(shí)樣品顏色仍為紫紅色(圖2),在220~260 nm和 560~600 nm處有2個(gè)吸收峰,由于在220~260 nm處的吸光值不符合朗伯比爾定律[26],因此選擇560~600 nm確定最佳吸收波長。由圖1可看出,當(dāng)吸光度為598 nm時(shí)吸光度最大,因此確定紫藍(lán)草紫色素的最佳吸收波長為598 nm。隨著乙醇濃度持續(xù)增加,樣品顏色逐漸由紫紅色變成綠色(圖2),而紫色素的吸收光譜變成了另一種趨勢(shì)(圖1),樣品在210、250和663 nm處均有強(qiáng)吸收峰;當(dāng)乙醇濃度為50%~80%時(shí),樣品在600 nm附近仍有弱吸收峰,但隨著乙醇濃度繼續(xù)增加,600 nm附近的吸收峰消失,隨之在300和430 nm處出現(xiàn)吸收峰。原因可能是紫藍(lán)草紫色素溶于低濃度的乙醇溶液,而不溶或難溶于高濃度的乙醇溶液,且高濃度的乙醇溶液可將紫藍(lán)草中其他雜質(zhì)物質(zhì)提取出來。由圖1可看出,當(dāng)乙醇體積分?jǐn)?shù)為30%時(shí),得到的吸光度值最大,紫藍(lán)草紫色素提取效果最好。

a-紫藍(lán)草紫色素紫外-可見光吸收光譜;b-不同乙醇濃度對(duì)紫藍(lán)草紫色素吸光值的影響;c-紫藍(lán)草紫色素的吸光值變化 圖1 紫藍(lán)草紫色素提取溶劑的選擇及最大吸收波長的確定Fig.1 Extraction solvent selection and determination of maximum absorption wavelength of pigment from Peristrophe roxburghiana注:圖中小寫字母表示差異顯著(P<0.05)(下同)
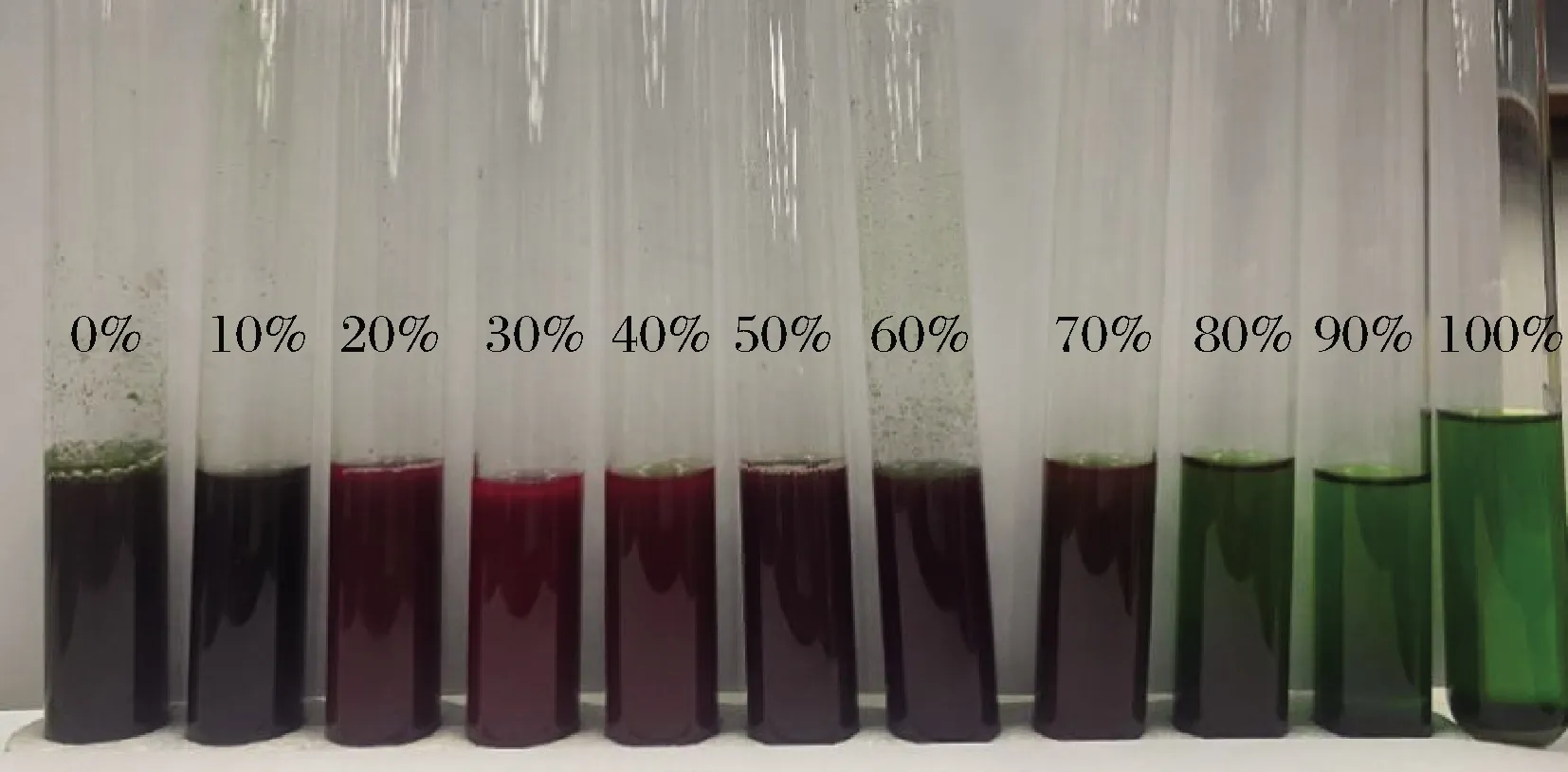
圖2 不同乙醇體積分?jǐn)?shù)對(duì)紫藍(lán)草紫色素提取顏色變化的影響Fig.2 Effect of different ethanol concentration on the color change of pigment from Peristrophe roxburghiana
2.1.1 提取料液比對(duì)色素提取液吸光度的影響
由圖3可看出,紫藍(lán)草紫色素得率隨著提取料液比的不斷升高先呈現(xiàn)快速增長的趨勢(shì),當(dāng)料液比達(dá)到1∶50(g∶mL)時(shí)達(dá)到最大,吸光度為1.36±0.07,此時(shí)若繼續(xù)增加提取溶劑體積,紫藍(lán)草紫色素的提取率反而呈下降趨勢(shì),由于料液比為1∶40 (g∶mL)時(shí)吸光度為1.35±0.06,與料液比為1∶50 (g∶mL)時(shí)差異不顯著(P>0.05),經(jīng)綜合考慮,因此選擇料液比為1∶40 (g∶mL)。
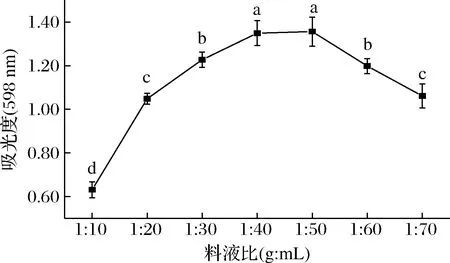
圖3 料液比對(duì)色素得率的影響Fig.3 Effect of water-material ratio on the yield of pigments
2.1.2 提取溫度對(duì)色素提取吸光度的影響
由圖4可以看出,隨著提取溫度的不斷升高,紫藍(lán)草紫色素提取效果呈現(xiàn)快速增長的趨勢(shì),當(dāng)提取溫度為50 ℃時(shí)達(dá)到最大,為1.26±0.07,且差異顯著(P<0.05),而后提取效果隨著提取溫度的繼續(xù)升高而迅速下降。但是當(dāng)提取溫度達(dá)到80 ℃時(shí)吸光度卻顯著上升(P<0.05),原因可能是提取溶劑在此溫度下有揮發(fā)現(xiàn)象,導(dǎo)致體系中色素濃度增加。
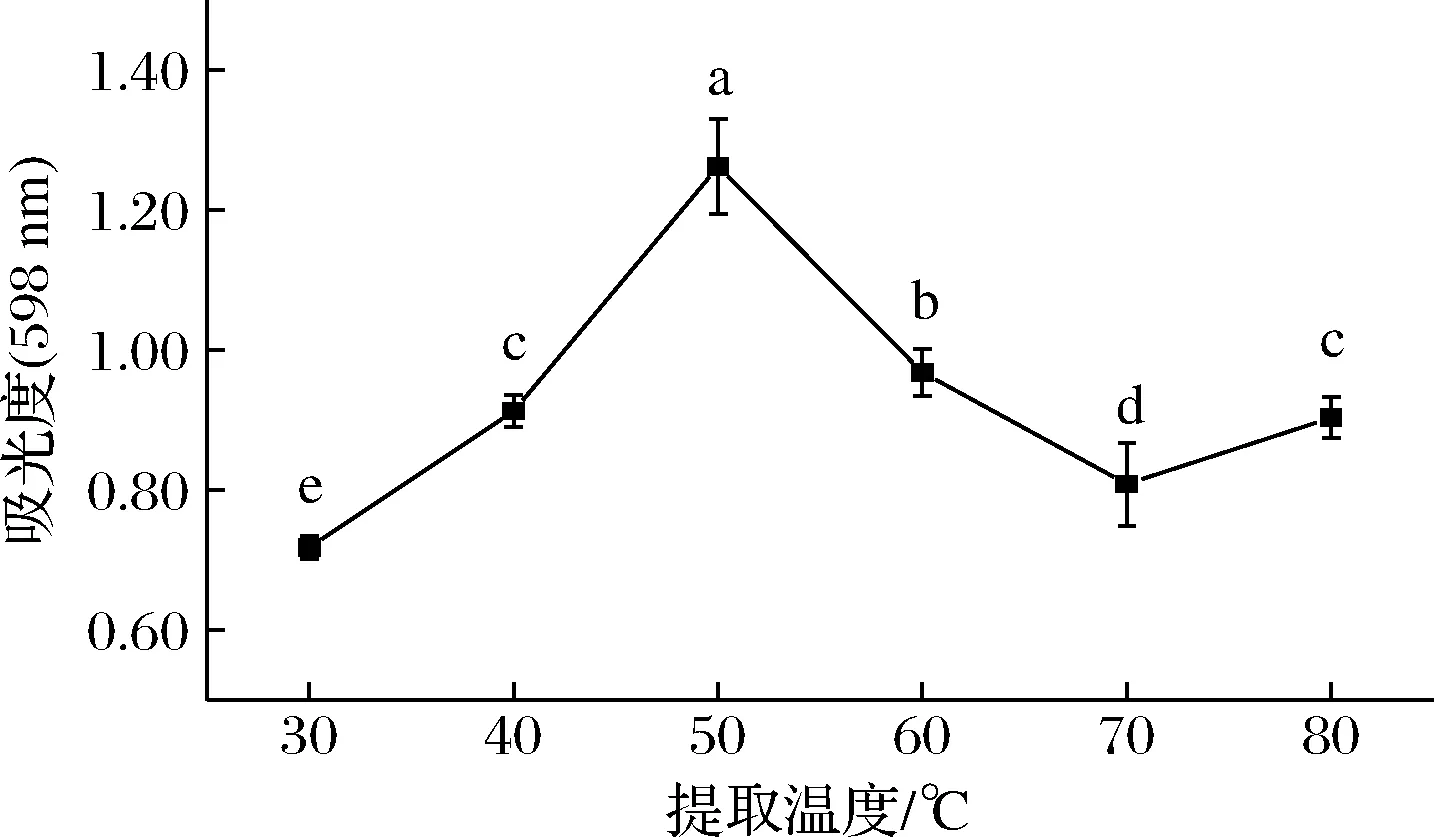
圖4 提取溫度對(duì)色素得率的影響Fig.4 Effect of temperature on the yield of pigments
2.1.3 提取時(shí)間對(duì)色素提取吸光度的影響
由圖5可以看出,紫藍(lán)草紫色素的提取效果隨著提取時(shí)間的增加呈現(xiàn)先上升后下降的趨勢(shì),在30 min時(shí)達(dá)到最大,為1.26±0.01,且差異顯著(P<0.05)。因此,提取時(shí)間為30 min最佳。
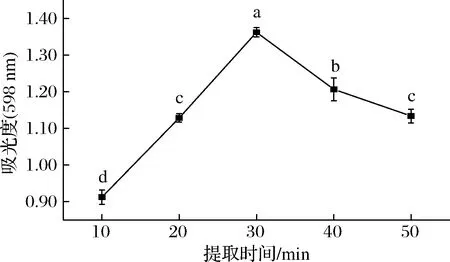
圖5 提取時(shí)間對(duì)色素得率的影響Fig.5 The effect of time on the yield of pigments
2.2 響應(yīng)面優(yōu)化試驗(yàn)
2.2.1 響應(yīng)面實(shí)驗(yàn)設(shè)計(jì)與結(jié)果
根據(jù)單因素實(shí)驗(yàn)結(jié)果,由Design-Expert 8.0.6統(tǒng)計(jì)分析軟件設(shè)計(jì)出的實(shí)驗(yàn)方案及實(shí)驗(yàn)結(jié)果如表2所示,以吸光度為響應(yīng)值,以提取時(shí)間(A),提取溫度(B),料液比(C)為自變量,建立3因素3水平中心組合實(shí)驗(yàn)設(shè)計(jì)。
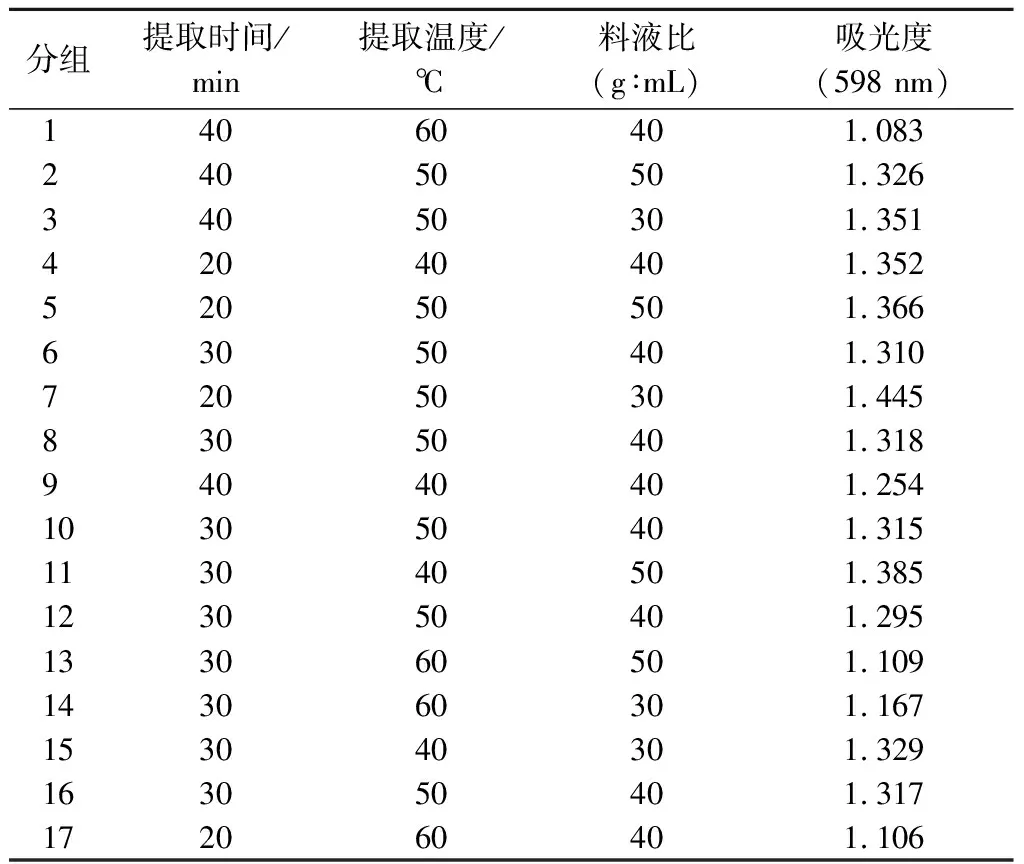
表2 響應(yīng)面分析方案與結(jié)果Table 2 Experimental design and results for response surface analysis
2.2.2 模型建立及顯著性檢驗(yàn)
利用Design-Expert 8.0.6 軟件進(jìn)行多元回歸擬合,回歸模型的方差分析結(jié)果見表3。對(duì)各因素回歸擬合后,二次方程模型為:Y=1.31-0.032A-0.11B-0.013C+0.019AB+0.013AC-0.029BC+0.006 0A2-0.12B2+0.055C2

表3 紫藍(lán)草紫色素得率回歸模型方差分析表Table 3 Analysis of variance analysis of degree of the yield of pigments
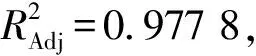
模型中一次項(xiàng)A、B對(duì)色素提取效果達(dá)到極顯著水平(P<0.01),C對(duì)色素提取效果達(dá)到顯著水平(P<0.05);模型中交互項(xiàng)BC對(duì)色素提取效果達(dá)到極顯著水平(P<0.01),AB對(duì)色素提取效果達(dá)到顯著水平(P<0.05),AC對(duì)色素提取效果不顯著(P>0.05);模型中二次項(xiàng)B2、C2對(duì)色素提取效果達(dá)到極顯著水平(P<0.01),A2對(duì)色素提取效果不顯著(P>0.05)。由回歸系數(shù)顯著性表明,在所取因素水平范圍內(nèi),各因素對(duì)紫藍(lán)草紫色素提取工藝影響的順序?yàn)椋禾崛囟?提取時(shí)間>料液比。
2.2.3 最佳條件的確定和回歸模型的驗(yàn)證
圖6是提取時(shí)間(A)、提取溫度(B)、料液比(C)3個(gè)因素之間交互作用的響應(yīng)面圖和等高線圖,等高線是響應(yīng)面圖在水平方向上的投影[27]。
由圖6可看出,提取溫度和料液比交互作用呈馬鞍形,表示2因素交互作用顯著[28]。同時(shí)在提取溫度和料液比交互作用的等高線圖中,等高線沿提取溫度的增加方向密集,降低方向稀疏,說明增加提取溫度會(huì)更顯著地影響色素提取效果。同理,降低提取時(shí)間和料液比會(huì)更顯著地影響色素提取效果。
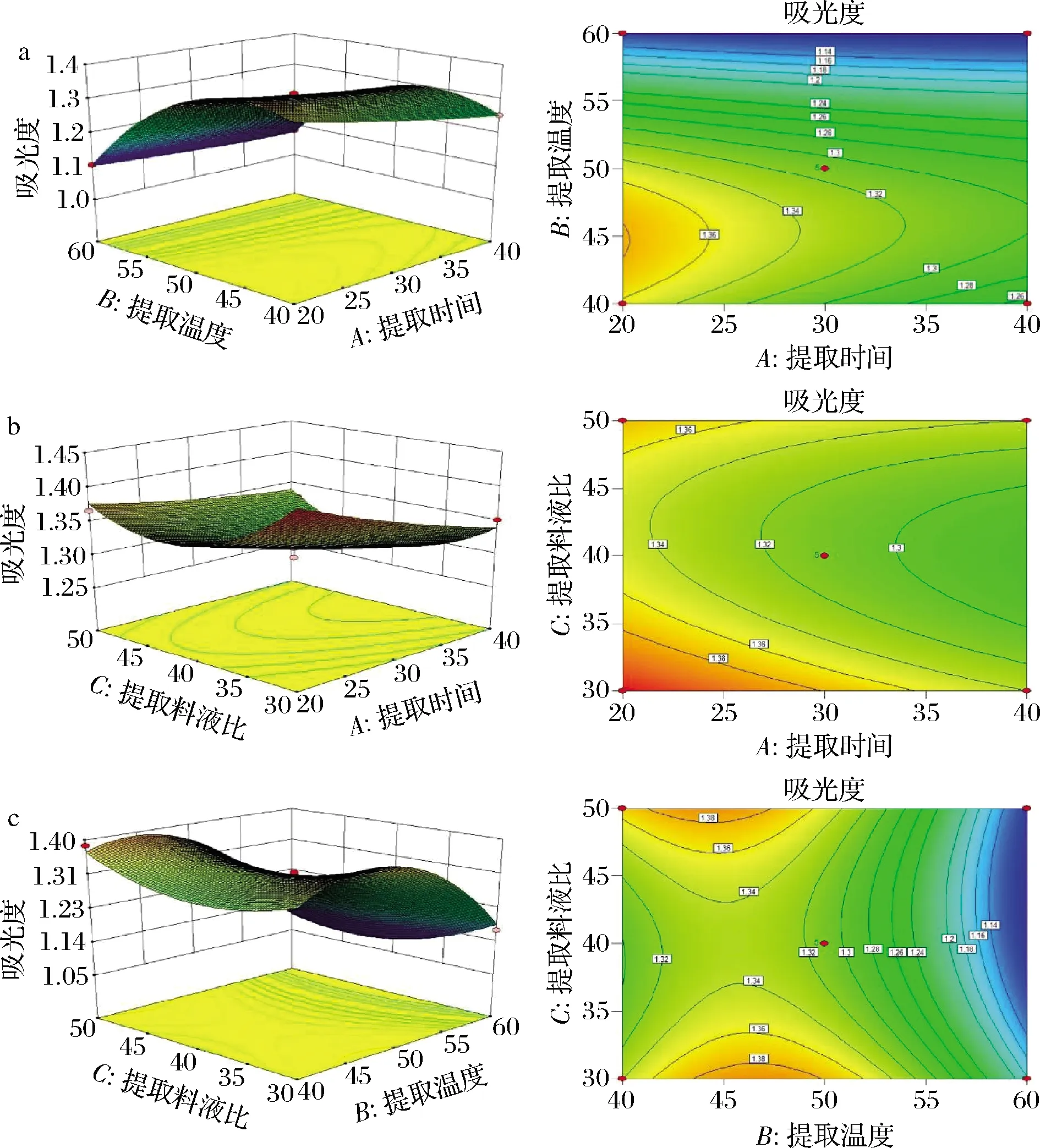
圖6 各因素交互作用的響應(yīng)面圖和等高線圖Fig.6 The response surface and contour plot for interaction of various factors
二次回歸模型擬合結(jié)果顯示,提取時(shí)間為20.41 min,提取溫度為45.96 ℃,提取料液比為1∶30.18(g∶mL),此時(shí)預(yù)測(cè)吸光度為1.45。為了驗(yàn)證模型的有效性,同時(shí)考慮到實(shí)際情況,將最佳工藝條件修改為提取時(shí)間為20 min,提取溫度為45 ℃,提取料液比為1∶30(g∶mL),在此條件下進(jìn)行6次重復(fù)試驗(yàn),結(jié)果表明吸光度為1.412±0.018,與預(yù)測(cè)值接近,說明模型準(zhǔn)確可靠。
2.3 掃描電子顯微鏡觀察分析結(jié)果
2.3.1 紫藍(lán)草紫色素顆粒掃描電鏡
掃描電鏡能夠直觀反映紫藍(lán)草紫色素顆粒的粒徑大小與形貌[29],圖7是放大2 000倍下紫藍(lán)草紫色素的微觀形態(tài),紫藍(lán)草紫色素顆粒是表面光滑的不規(guī)則片狀顆粒。

圖7 紫藍(lán)草紫色素顆粒顯微結(jié)構(gòu)形態(tài)Fig.7 Microstructure and morphology of pigment from Peristrophe roxburghiana
2.3.2 糯米染色前后掃描電鏡
白糯米和紫藍(lán)草紫色素染色糯米(以下簡(jiǎn)稱紫糯米)的微觀形態(tài)如圖8所示。通過掃描電鏡可以看出白糯米米粒橫斷面胚乳細(xì)胞的排列形式,如圖8-A1所示,粳糯米胚乳細(xì)胞為由糯米橫斷面中心向外呈輻射狀排列的長方柱狀細(xì)胞[30],將淀粉粒包裹其中。同時(shí)通過圖8-A2可看出,胚乳細(xì)胞內(nèi)的復(fù)合淀粉粒介于完全被覆蓋和完全暴露出來之間,同時(shí)胚乳細(xì)胞表面有微孔和花紋,因此實(shí)驗(yàn)用粳糯米為介于裸露型和非裸露型之間的中間型胚乳細(xì)胞。由圖8-A3可看出,胚乳細(xì)胞橫斷面有裂紋,這可能是因?yàn)榕疵自诮輹r(shí)米粒吸水產(chǎn)生裂縫。由圖8-A4和圖8-A5可看出,胚乳細(xì)胞內(nèi)的單粒淀粉粒大小差異不大,為各面呈凹陷狀態(tài)緊密排列的多面體;同時(shí)存在由多個(gè)單粒淀粉里組成的復(fù)合淀粉粒[31]。并且可以明顯看出,大米橫斷面分布著一些“小孔”(如圖灰色圓圈標(biāo)注區(qū)域),這些小孔是細(xì)胞內(nèi)和細(xì)胞外之間的物質(zhì)在胚乳生長時(shí)進(jìn)行物質(zhì)交換時(shí)留下的通道[32]。
對(duì)比同一放大倍數(shù)的白糯米和紫糯米,由圖8-A1、圖8-B1和圖8-A2、圖8-B2可以明顯看出在胚乳細(xì)胞淀粉粒變得粗糙不光滑,淀粉粒或復(fù)合淀粉體表面凹凸不平,并且有碎片顆粒嵌在淀粉粒之間。可以觀察到圖8-B3糯米橫斷面上胚乳細(xì)胞間隙變大,并且鑲嵌有發(fā)光碎片(如圖白色橢圓圈標(biāo)注區(qū)域),猜測(cè)碎片為紫藍(lán)草紫色素;同時(shí)圖8-B3分布的小孔明顯比圖8-A3增多變大。由圖8-A4、圖8-B4可觀察到,復(fù)合淀粉體表面出現(xiàn)孔狀凹陷,同時(shí)復(fù)合淀粉體間出現(xiàn)與凹陷大小類似的圓球體,可能是鑲嵌在淀粉粒間的蛋白顆粒脫落[33]所致。由圖8-A5、圖8-B5可觀察到,淀粉粒表面凹凸不平,粗糙且不均勻,由表面光滑的狀態(tài)變?yōu)楸砻娉什y狀凹陷狀態(tài),可能是淀粉粒與色素發(fā)生相互作用所致。
2.3.3 糊化糯米染色前后掃描電鏡
糊化白糯米和糊化紫糯米的微觀形態(tài)見圖9。由圖9可以看出,白糯米胚乳細(xì)胞淀粉粒已經(jīng)糊化,表面多孔且粗糙,糯米胚乳細(xì)胞結(jié)構(gòu)消失,橫斷面淀粉粒形態(tài)改變,相互交聯(lián),沒有淀粉粒或復(fù)合淀粉體的形狀存在,淀粉糊化后淀粉顆粒與水分子發(fā)生水合溶脹,氫鍵斷裂,淀粉晶體結(jié)構(gòu)崩潰,淀粉分子鏈溶出并相互纏繞成為網(wǎng)絡(luò)狀海綿樣結(jié)構(gòu),這與朱曉倩等[34]家用壓力鍋烹調(diào)米飯的研究一致。
對(duì)比圖9-C1和圖9-D1可以看出,同一浸泡條件和蒸煮條件的白糯米的糊化度明顯高于紫糯米,糊化白糯米細(xì)胞內(nèi)部復(fù)合淀粉體和淀粉粒相互交聯(lián),產(chǎn)生一種絲狀物,伸展并相互交織成為具有孔洞的海綿樣結(jié)構(gòu),而紫糯米的糊化狀態(tài)則呈纖維狀,混亂沒有孔隙,可能是紫藍(lán)草紫色素與淀粉粒的吸附作用影響了淀粉粒之間的交聯(lián),降低糯米米粒的吸水作用,阻礙淀粉分子打開,降低淀粉糊化,這一結(jié)果與許多研究[35-38]一致,多酚類物質(zhì)與淀粉的結(jié)合會(huì)顯著降低淀粉的糊化及消化,這意味著紫藍(lán)草紫色素與淀粉的結(jié)合可能會(huì)抑制淀粉的消化率。
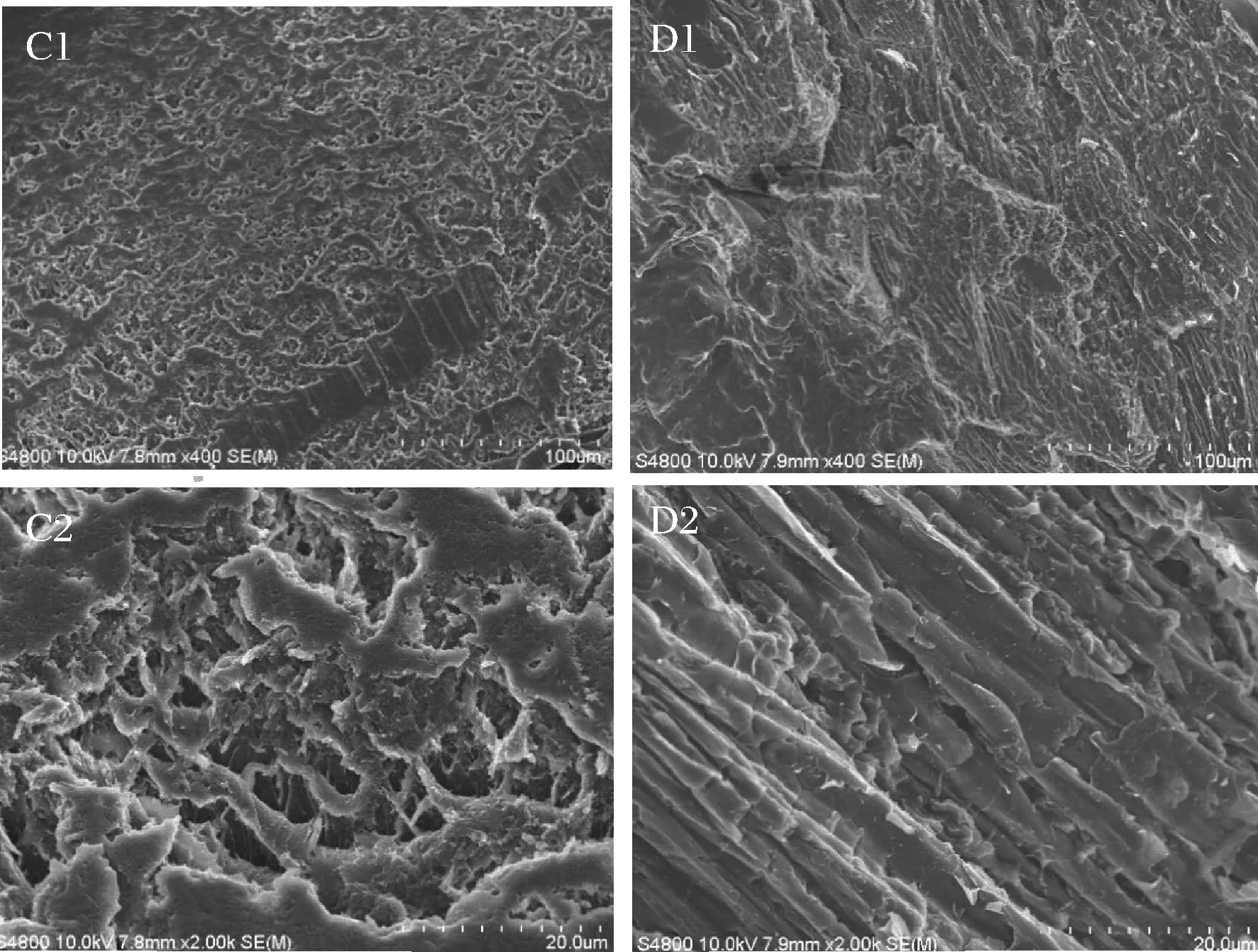
C-糊化白糯米胚乳細(xì)胞微觀結(jié)構(gòu)(C1:×400、C2:×2 000) D-糊化紫糯米胚乳細(xì)胞微觀結(jié)構(gòu)(D1:×400、D2:×2 000)圖9 染色前后糊化糯米胚乳細(xì)胞表面微觀結(jié)構(gòu)Fig.9 Microstructure of albuminous cells of gelatinized glutinous rice before and after dyeing
3 結(jié)論
紫藍(lán)草紫色素的最佳提取工藝為提取時(shí)間為20 min,提取溫度為45 ℃,提取料液比為1∶30(g∶mL),提取液吸光度為1.412±0.018。
SEM分析表明,紫藍(lán)草紫色素顆粒呈現(xiàn)碎片狀;淀粉粒與色素發(fā)生相互作用,紫糯米淀粉粒表面由光滑的狀態(tài)變?yōu)榘櫩s、粗糙不均勻狀態(tài);紫藍(lán)草紫色素與淀粉粒的吸附作用影響了淀粉的糊化。