QuEChERS-UPLC-MS/MS同時測定動物性食品中24種殘留獸藥的基質效應
李紅麗,吳曉琴,趙博,候美玲,吳彥蕾,黃先亮
(重慶市食品藥品檢驗檢測研究院,重慶,401120)
UPLC-MS/MS因分析效率、準確度和靈敏度高等優點被廣泛應用于獸藥殘留的檢測[1-4]。但由于動物性食品基質復雜,含蛋白質、脂類、肽類、胺類及等內源性干擾物[5-6]及前處理過程中引入的無機鹽、有機酸、塑化劑等外源性雜質[7],會增強或抑制待測物在電噴霧接口處的離子化效率[8-9],對待測物產生一定的干擾,影響檢測的選擇性和靈敏度,從而導致分析結果的準確度和精密度受到不同程度的影響,這一過程稱為基質效應[10-11]。2001年,美國食品和藥物管理局指出,在LC-MS/MS的方法開發和驗證過程中,需評估基質效應[12]。
本文采用改善的QuEChERS前處理法[27]結合UPLC-MS/MS檢測技術,通過離子抑制率(ion suppression,IS)[13-15]對6種不同的動物性食品中24種獸藥的基質效應進行系統性地評價;考察同位素內標[16-17]、基質匹配標準曲線[18-19]對基質效應的補償效果。
1 材料與方法
1.1 儀器、試劑與材料
TSQ Endura三重四極桿串聯質譜儀、Ultimate 3000超高效液相色譜儀,美國Thermo-Fisher公司;VORTEX GENIUS3渦旋儀,德國IKA公司;Milli-Q型全自動超純水機,美國Millipore公司。
乙腈、甲醇、正己烷均為色譜純,德國Merck公司;甲酸(色譜純),德國CNW公司;無水硫酸鈉(分析純),重慶川東化工(集團)有限公司;C18E粉,美國Welch公司。
本實驗室所用的標準品純度除替米考星(tilmicosin,TIL)和諾氟沙星-D5(norfloxacine-D5hydrate,NOR-D5)外純度均在92%以上,TIL純度為80.71%,NOR-D5純度為80.40%。沙拉沙星(sarafloxacin,SAR)、金剛烷胺(amantadine,AMA)、金剛乙胺(rimantadina,RIM)、環丙沙星-D8(ciprofloxacin-D8,CIP-D8)、恩諾沙星-D5(enrofloxacin-d5,ENR-D5)、NOR-D5,Bepure公司;磺胺間二甲氧嘧啶-D6(sulfadimethoxine-D6,SDT-D6)、磺胺鄰二甲氧嘧啶-D3(sulfadoxine,SDX-D3),德國WITEGA公司;金剛烷胺-D15(AMA-D15),德國CNW公司;紅霉素-13C2(erythromycin-13C2,ERY-13C2),美國Sigma-Aldrich公司;其余21種標準品均來自德國DR.Ehrenstorfer。
分別稱取適量標準品,用甲醇配制成1 mg/mL的標準儲備液;準確移取一定量的各標準儲備液,用甲醇稀釋成1 μg/mL的混合標準工作液,現用現配;同法配制內標工作液。
1.2 樣品前處理
稱取動物組織5.00 g(精確至0.01 g)于50 mL離心管中,加入2 mL乙腈飽和正己烷;加入10 mL 0.1%(體積分數)甲酸-乙腈,3 g無水硫酸鈉,加蓋渦旋1 min,超聲5 min,8 000 r/min離心5 min;取中間層提取液于含有2 g C18E的凈化管中,超聲5 min,4 000 r/min離心3 min;準確移取5 mL上清液于氮吹管中,40 ℃氮吹至干,用20%(體積分數)甲醇-水定容至1 mL,渦旋,過0.22 μm有機濾膜,供UPLC-MS/MS測定。
1.3 儀器條件
1.3.1 色譜條件
色譜柱:Thermo-Fisher Hypersil GOLD aQ色譜柱(50 mm×2.1 mm,1.9 μm);柱溫:40 ℃;流速:0.4 mL/min;進樣體積5 μL;流動相A:0.1%(體積分數)甲酸-水溶液,流動相B:乙腈;梯度洗脫程序:0~0.5 min,90%A;0.5~3 min,90%A~10%A;3~4 min,10%A;4.1~5 min,90%A。
1.3.2 質譜條件
離子化模式:電噴霧離子源(ESI),正離子模式;噴霧電壓:3 500 V;鞘氣(Arb):45;輔助氣(Arb):13;吹掃氣(Arb):2;離子傳輸管溫度:350 ℃;蒸發溫度:300 ℃;碰撞氣壓力:氬氣2 mTorr;Q1半峰寬:0.7 Da;Q3半峰寬:0.7 Da;掃描模式:多反應監測(multiple reaction monitoring,MRM)。24種獸藥質譜參數見表1。

表1 各獸藥保留時間及質譜參數Table 1 Mass spectral parameters of various veterinary drugs
1.4 基質效應評價方法
溶劑標準曲線:準確移取適量混合標準工作液,用20%(體積分數)甲醇-水稀釋成5、10、20、50、100、200 ng/mL的混合標準系列溶液。基質匹配標準曲線:分別稱取陰性鯽魚、雞肉、鴨胗、豬肝、牛肉、豬肉5.00 g(精確至0.01 g)按1.2處理,獲得6組不同的空白基質溶液,加入適量混合標準工作液,配制成6組5、10、20、50、100、200 ng/mL的基質匹配混合標準溶液。在1.3的儀器條件下測定,以濃度為橫坐標,色譜峰面積為縱坐標繪制標準曲線。離子抑制率計算如公式(1)所示:
(1)
式中:IS,離子抑制率,%;K1,溶劑標曲斜率;K2,基質匹配標曲斜率。IS>0,基質增強[20];IS<0,基質抑制[21];IS絕對值越大,基質效應越強。
2 結果與分析
2.1 不同基質的基質效應評價
為了考察24種獸藥受基質影響的程度,本實驗選取鯽魚、雞肉、鴨胗、豬肝、牛肉、豬肉6種不同的基質,采用1.2方法進行前處理,用離子抑制率表示24種獸藥在這6種基質中的基質效應,結果如表2所示。結果表明,同一獸藥在不同基質中與不同獸藥在同一基質中的基質效應均不同。這可能與基質中含有蛋白質、脂類和色素等物質有關,這些物質的化學結構與待測物的結構有相似之處,與基質產生共提取現象[22-23],共提取程度不同,基質效應也不同。其中鴨胗和豬肝對其影響比較大,可能是內臟富含碳水化合物、蛋白質、脂肪、煙酸、維生素等,比肌肉組織復雜,對待測物的影響更大,故基質效應也越強。
磺胺甲惡唑(sulfamethoxazole,SMZ)、SDT、磺胺嘧啶(sulfadiazine,SDZ)、磺胺喹惡啉(sulfaquinoxaline,SQX)、SDX、NOR、培氟沙星(pefloxacin,PEF)、ERY、羅紅霉素(roxithromycin,ROX)、TIL多為中強基質效應,需采用內標法或基質匹配標曲定量;剩余14種獸藥多為弱基質效應。根據本實驗室內標獲得的難易程度,對SDT、SDX、CIP、ENR、NOR、ERY、AMA采用內標法校正基質效應,剩余17種獸藥采用基質匹配標準曲線校正基質效應的影響。
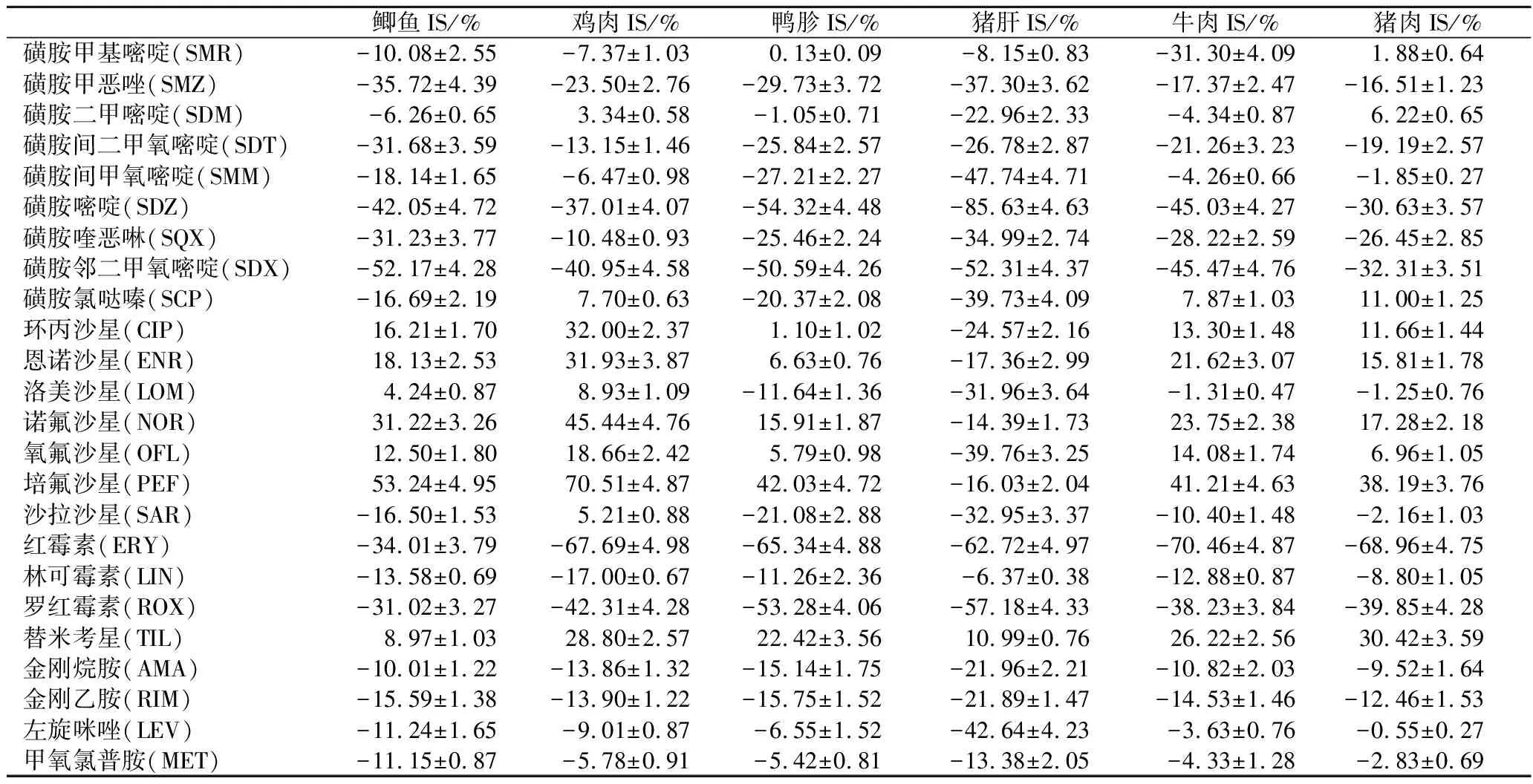
表2 24種獸藥在6種不同基質中的基質效應(n=3)Table 2 Matrix effects of 24 veterinary drugs in six food matrices
2.2 消除或者補償基質效應
同位素內標與基質匹配標準曲線均能有效地補償基質效應[22]。基質匹配標準曲線是用空白基質溶液對標準使用液進行稀釋,獲得系列基質標準工作液,使得樣品溶液與標準品在電噴霧接口處具有相同的離子化條件,從而校正基質效應對定量結果的影響[23]。同位素內標是較理想的內標物,它與待分析物的化學性質非常相似,除了可以消除離子化過程對化合物的影響,同時也可以消除樣品前處理過程的損耗[24],從而使得同位素內標法成為首選的定量方法。
2.2.1 內標法補償基質效應
為了考察加入同位素內標后,SDT、SDX、CIP、ENR、NOR、AMA、ERY的基質效應是否減少,本實驗繪制了它們在鯽魚、雞肉、鴨胗、豬肝、牛肉基質中使用內標前與使用內標后的標準曲線對照圖(圖1)。在使用內標前,不同的基質標曲與溶劑標曲之所以呈現出不同的夾角,是因為同一化合物受不同基質的影響在儀器上的峰面積響應強度不同。響應強度比溶劑中強的為基質增強,在溶劑標曲上方;響應強度比溶劑中弱的為基質抑制,在溶劑標曲下方;與溶劑標曲的夾角越大,表明基質效應越大,反之亦然。加入內標后,各基質標曲與溶劑標曲的夾角明顯減小,說明基質效應得到有效補償。可能的原因是內標法的標曲繪制是橫坐標為待分析物與同位素內標濃度的比值,縱坐標則為兩者在儀器上響應強度的比值,待分析物與其同位素內標受基質的影響基本相同,兩者相比則抵消了這種影響。

圖1 部分獸藥在不同基質中的標準曲線和 使用內標后校正的標準曲線Fig.1 Standard curves of some veterinary drugs in different matrices and calibration curves after using internal standards注:圖A,C,E,G,I,K,M分別為SDT、SDX、CIP、ENR、NOR、AMA、 ERY在不同基質中的標準曲線;圖B,D,F,H,J,L,N分別為SDT、SDX、 CIP、ENR、NOR、AMA、ERY在不同基質中使用內標后校正的標曲; Ci表示溶液中某一獸藥濃度,Ci/CIstd表示溶液中某一獸藥濃度與該 獸藥的同位素內標濃度的比值;Ai/AIstd表示溶液中某一獸藥的峰面積 與該獸藥的同位素內標峰面積的比值
2.2.2 基質匹配標準曲線補償基質效應
雖然同位素內標法可以有效消除基質效應,但同位素內標價格昂貴,且不易獲取。研究表明[25-26],基質匹配標準曲線也可消除基質效應。本實驗將其余17種獸藥的加標結果(加標量為10 μg/kg)分別用溶劑標曲與空白豬肉基質匹配標曲定量,結果如圖2所示。通過空白豬肉基質匹配標曲校正后,17種獸藥的回收率均有不同程度地提高。回收率由(17.03±1.21)%~(66.55±2.54)%提升至(71.10±2.68)%~(89.25±3.14)%。這從定量的角度也說明了待分析物與標準品在電噴霧接口處具有相同的離子化條件時,可以有效地校正基質效應。
2.3 方法驗證
2.3.1 線性關系、檢出限及定量限
本實驗選擇了對24種獸藥基質效應較強的豬肝作為空白基質,加入適量內、外標工作液,配制系列匹配標準溶液,以24種化合物的色譜峰面積為縱坐標,對應的濃度為橫坐標,繪制標準曲線。標準曲線、線性范圍、相關系數、檢出限(limit of detection,LOD)及定量限(limit of quantitation,LOQ),見表3。

圖2 溶劑標準曲線定量結果與空白豬肉基質 匹配標準曲線的比較Fig.2 Comparison of quantitative results by solvent standard curve and negative pork matrix-matched standard curve
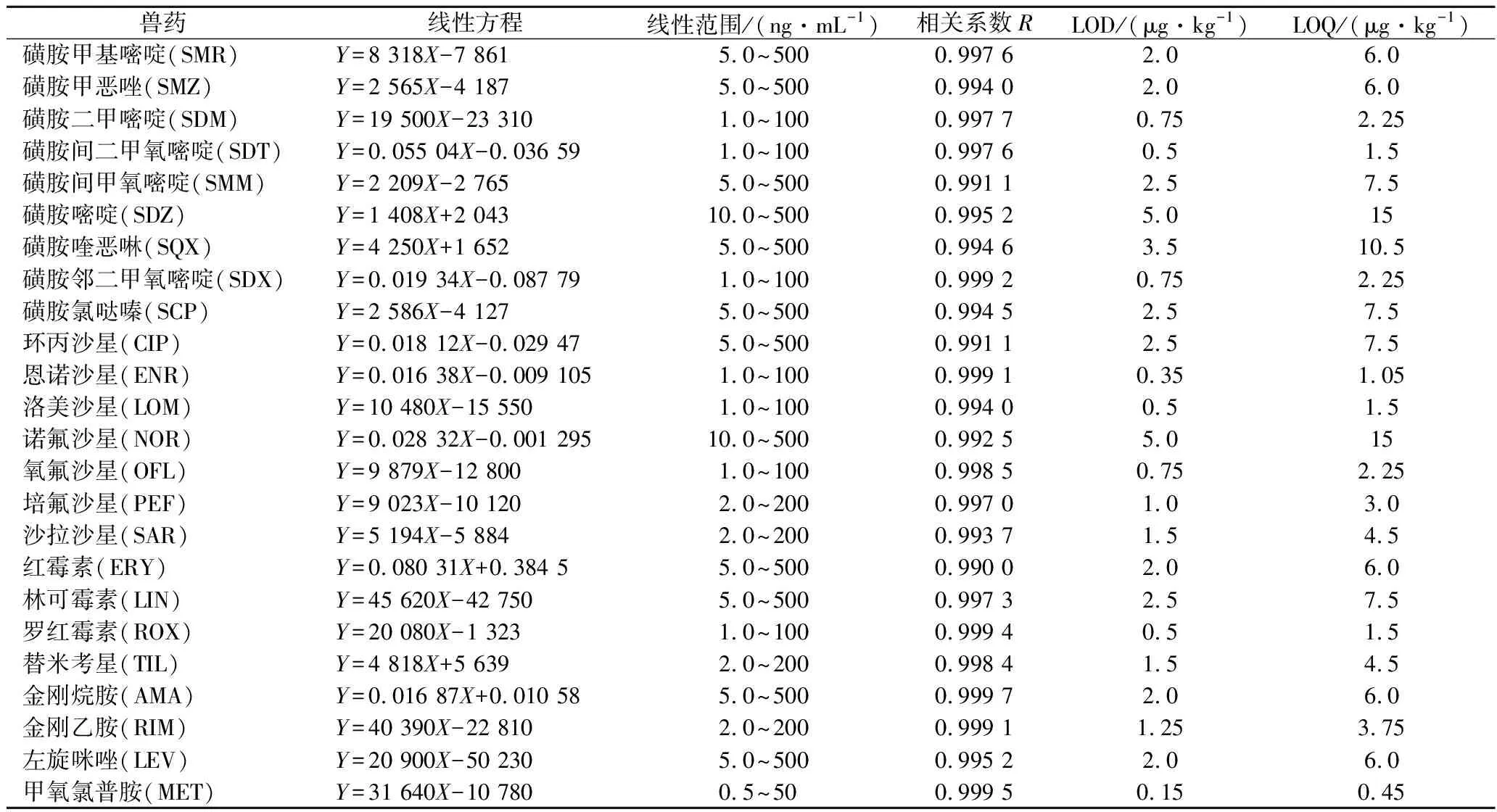
表3 豬肝中24種獸藥的線性方程、線性范圍、相關系數、檢出限及定量限Table 3 Linear equation, linear range, correlation coefficient, LOD and LOQ for 24 veterinary drugs in pork liver
2.3.2 方法的準確度和精密度
取豬肝陰性樣品,對24種獸藥作3水平加標實驗,結果見表4。24種獸藥在豬肝中的回收率為71.6%~109.8%(n=6),相對標準偏差(relative standard deviation,RSD)≤10.6%,該方法符合獸殘檢測要求。
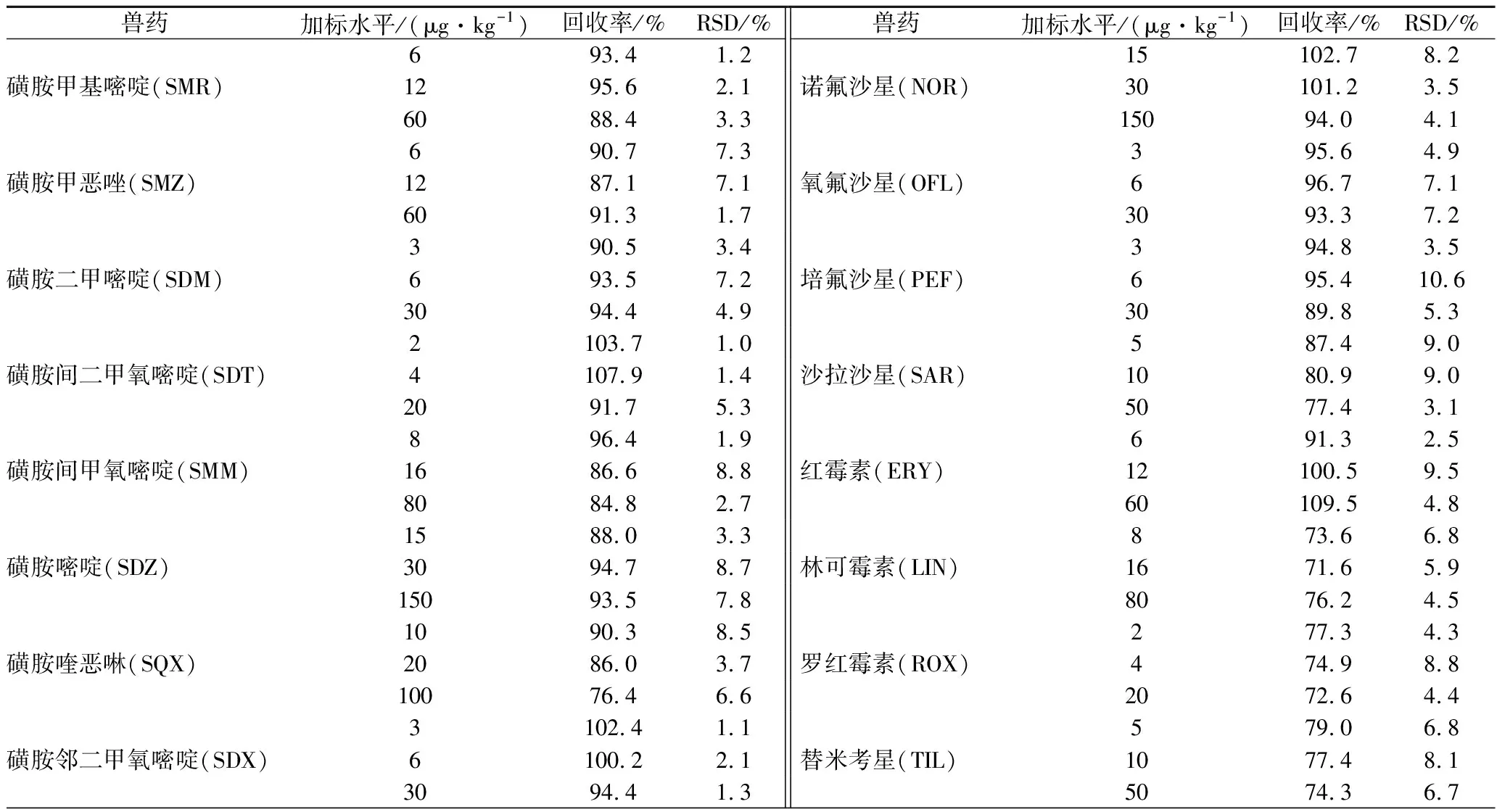
表4 豬肝中24種獸藥回收率和精密度(n=6)Table 4 Recoveries and RSDs of 24 veterinary drugs in pork liver(n=6)
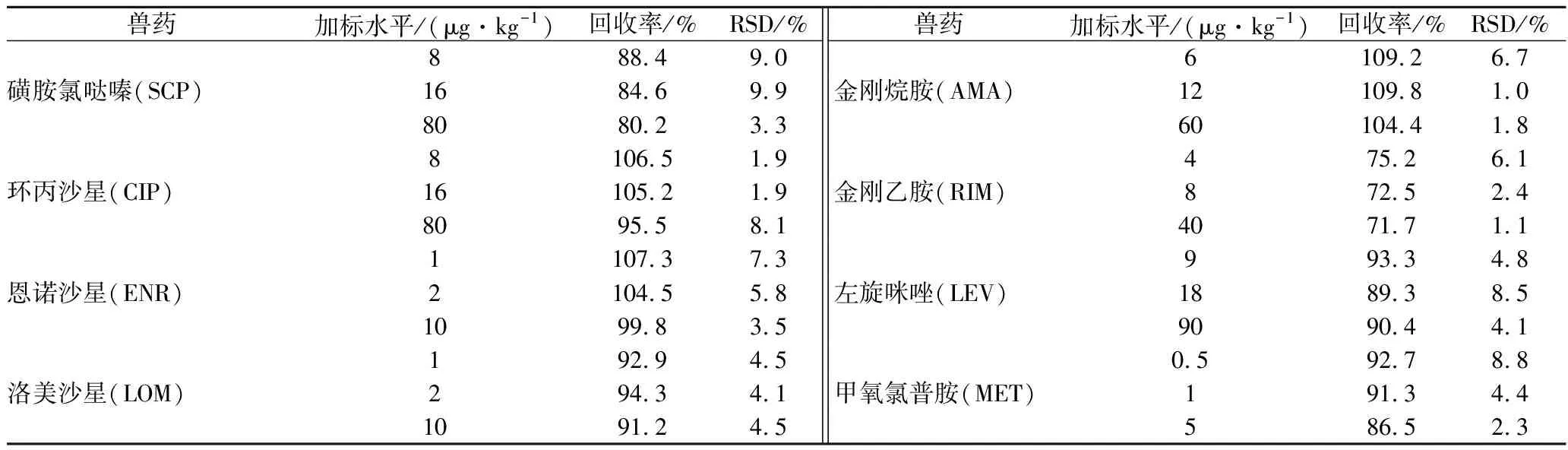
續表4
3 結論
本研究以離子抑制率為衡量指標,系統性地評價了采用QuEChERS-UPLC-MS/MS檢測技術,6種不同的動物性食品基質對24種獸藥的基質效應。結果表明,SMZ、SDT、SDZ、SQX、SDX、NOR、PEF、ERY、ROX、TIL 10種獸藥存在著較強的基質效應,剩余14種獸藥為弱基質效應。采用同位素內標及基質匹配標準曲線能有效地補償基質效應,本研究為動物性食品中多獸殘快速準確檢測提供了一定的參考依據。