麥麩阿魏酰低聚糖對大鼠肝臟抗氧化功能的影響
王文文 段元霄 王 園* 孟子琪 安曉萍 齊景偉
(1.內(nèi)蒙古農(nóng)業(yè)大學(xué) 動物科學(xué)學(xué)院,呼和浩特 010018;(2.內(nèi)蒙古自治區(qū)草食家畜飼料工程技術(shù)研究中心,呼和浩特 010018;(3.內(nèi)蒙古自治區(qū)農(nóng)牧業(yè)科學(xué)院 動物營養(yǎng)與飼料研究所,呼和浩特 010031)
動物機體的正常生理代謝、外源性刺激及內(nèi)源性刺激均會產(chǎn)生自由基(Reactive oxygen species, ROS),大量的自由基累積會損傷DNA、蛋白質(zhì)及脂質(zhì)等生物大分子,產(chǎn)生氧化應(yīng)激。研究發(fā)現(xiàn),氧化應(yīng)激會以肝臟為靶點,損傷肝細胞結(jié)構(gòu)和功能,進而造成機體正常生理功能障礙[1]。此外,肝臟作為抗脂質(zhì)過氧化損傷的中心器官, 其抗氧化能力的高低對機體抵抗氧化應(yīng)激有重要作用。多項研究表明,攝食多糖、多酚和黃酮等生物活性物質(zhì)可提高肝臟抗氧化能力,緩解氧化應(yīng)激,有利于改善動物健康狀況[2-3]。
研究發(fā)現(xiàn),攝食全谷物可以預(yù)防與氧化應(yīng)激相關(guān)的疾病,如心血管疾病、2型糖尿病和癌癥等[4]。因小麥麩皮中富含酚酸類化合物和非淀粉多糖,利用其制備出的麥麩阿魏酰低聚糖(Feruloyl oligosaccharides,F(xiàn)Os),具有良好的抗氧化效果[5]。Zhao等[6]體外試驗結(jié)果發(fā)現(xiàn),從小麥麩皮中制備出4種不同聚合度的FOs,均具有清除DPPH(1,1-diphenyl-2-picrylhydrazyl)自由基、超氧化物自由基和羥自由基的作用。Wang等[7]研究結(jié)果表明,用FOs處理體外培養(yǎng)的人淋巴細胞,可緩解細胞中的DNA氧化應(yīng)激損傷。本課題組前期研究結(jié)果也表明,利用微生物發(fā)酵法制備的FOs有良好的體外抗氧化功能,可有效清除DPPH自由基和羥基自由基[8]。然而,上述關(guān)于FOs的抗氧化作用研究多集中在體外試驗上,其是否會對體內(nèi)肝臟抗氧化能力產(chǎn)生影響鮮有報道。因此,本研究以SD大鼠為模型,分析FOs對其肝臟抗氧化酶活力、抗氧化物質(zhì)谷胱甘肽(Reduced glutathione,GSH)、氧化代謝產(chǎn)物8-羥基脫氧鳥苷(8-hydroxy deoxyguanosine,8-OHdG)、抗氧化相關(guān)基因mRNA表達水平及蛋白表達水平的影響,以期為微生物發(fā)酵法制備的FOs在動物生產(chǎn)中的應(yīng)用及其對肝臟抗氧化機制研究提供理論依據(jù)。
1 材料與方法
1.1 試驗材料
1.1.1麥麩FOs的制備
參照郝希然[8]的方法制備麥麩FOs。以小麥麩皮為原料,利用枯草芽孢桿菌(Bacillussubtilis)、地衣芽孢桿菌D3(BacilluslicheniformisD3)和釀酒酵母(Saccharomycescerevisiae)進行混菌發(fā)酵。發(fā)酵結(jié)束后,將發(fā)酵樣品烘干、粉碎,經(jīng)過水提、去蛋白、分級醇沉等一系列操作得到FOs粗提物。通過大孔樹脂Amberlite XAD-2對FOs粗提物進行分離純化,獲得的FOs的質(zhì)量濃度為2 668.34 nmol/g,其單糖組成主要是阿拉伯糖和木糖,并進行動物試驗。
1.2 試驗方法
1.2.1試驗設(shè)計
試驗選取40只健康斷奶雄性SD大鼠,購于北京維通利華公司(動物質(zhì)量合格證號:1100111911029973),按體重相近的原則完全隨機設(shè)計分為5個組,正常對照組:生理鹽水;陽性對照組:w(Vc)=100 mg/kg;低劑量組、中劑量和高劑量組分別灌胃FOs的劑量分別為:w(FOs)=20 mg/kg,w(FOs)=40 mg/kg,w(FOs)=80 mg/kg,加入Vc和FOs的劑量均以每kg體重為基礎(chǔ),如其中w(Vc)=100 mg/kg表示每kg體重加入Vc的劑量為100 mg,每個處理8只SD大鼠。
1.2.2飼養(yǎng)管理
本研究在內(nèi)蒙古農(nóng)業(yè)大學(xué)動物科學(xué)學(xué)院進行,常規(guī)飼養(yǎng)管理,自由采食、飲水。飼養(yǎng)期21 d,每日定時灌胃生理鹽水、Vc及FOs水溶液1 mL。大鼠基礎(chǔ)飼糧購于江蘇協(xié)同醫(yī)藥生物工程有限公司。
1.3 樣品采集
試驗結(jié)束后,乙醚致暈,剖開腹腔,收集肝臟組織,液氮速凍后將樣品存于-80 ℃冰箱中待測。
1.4 測定指標(biāo)及方法
1.4.1肝臟抗氧化指標(biāo)測定
取適量肝臟組織,加磷酸鹽緩沖液(PBS, 0.01 mol/L, pH 7.4)制備10%(質(zhì)量)組織勻漿,3 000 r/min 離心10 min,取上清液用于抗氧化相關(guān)指標(biāo)測定。總抗氧化能力(Total antioxidant capacity, T-AOC)、過氧化氫酶(Catalase, CAT)、谷胱甘肽過氧化物酶(Glutathione peroxidase, GSH-Px)及超氧化物岐化酶(Superoxide dismutase, SOD)活性測試盒以及谷胱甘肽(Reduced glutathione, GSH)和8-羥基脫氧鳥苷(8-hydroxy deoxyguanosine, 8-OHdG)含量測試盒均購自武漢基因美生物科技有限公司。所有操作均按說明書進行。
1.4.2mRNA表達水平的檢測
采用Trizol法提取肝臟組織總RNA。經(jīng)微孔板分光光度計測得A260 nm和A280 nm比值為1.8~2.0,瓊脂糖凝膠電泳法評價RNA質(zhì)量。參照FastQant RT Kit(with gDNase)說明書分別將各樣品的總RNA進行逆轉(zhuǎn)錄合成cDNA,并以此為模板,使用表1所列的引物,按照 SuperReal PreMix Plus(SYBR Green)說明書進Real-time PCR檢測。以β-肌動蛋白(β-actin)為內(nèi)參,谷氨酸-半胱氨酸連接酶催化亞基(Glutamate cysteine ligase catalytie subunit,GCLC)、醌氧化還原酶1(NAD(P)Hquinoneoxidoreductasel,NQO1)、谷氨酸-半胱氨酸連接酶調(diào)節(jié)亞基(Glutamate cysteine ligase modifiersubunit,GCLM)、血紅素氧合酶(Hemeoxygenasel,HO-1)、CAT、SOD、GSH-Px及Nrf2的相對表達量采用2-ΔΔCt法進行計算。引物由生工生物(上海)股份有限公司合成,詳細信息見表1。

表1 抗氧化基因的引物序列信息Table 1 Information of primer sequences of antioxidant genes
1.4.3蛋白表達水平的檢測
用蛋白裂解液裂解肝臟組織后,取上清液用BCA蛋白濃度試劑盒(Thermo,美國)測定上清液中總蛋白含量,然后在100 ℃下煮沸5 min使樣品蛋白質(zhì)變性,待樣品冷卻至室溫,加入到制備好的聚丙酰胺凝膠中,每孔上樣30 μg總蛋白。80 V恒壓電泳到分離膠頂端,120 V恒壓電泳至溴酚藍接近分離膠底部,直至分離出目的蛋白條帶。隨后在4 ℃、100 V條件下將蛋白轉(zhuǎn)移到硝酸纖維素膜上,室溫下封閉1 h,然后經(jīng)一抗Nrf2抗體和β-actin抗體(1∶1 000,Biorbyt,英國)及二抗山羊抗兔IgG H&L抗體(1∶10 000,Abcam)孵育后,用ECL顯色液進行熒光顯色,置于蛋白凝膠成像儀(GE Healthcare,美國)下成像,利用Image J 軟件進行目的蛋白定量分析,得到肝臟組織中Nrf2和β-actin蛋白表達量。
1.5 統(tǒng)計分析
本研究數(shù)據(jù)采用SAS 9.2統(tǒng)計軟件GLM模型進行統(tǒng)計分析,空白處理組和不同劑量FOs處理組分別進行單因素方差、線性及二次趨勢分析,同時使用contrasts語句進行不同處理間的兩兩比較。試驗結(jié)果均以平均值和標(biāo)準(zhǔn)誤表示,P<0.05表示差異顯著,P<0.01表示差異極顯著。
2 結(jié)果與分析
2.1 不同劑量FOs對大鼠肝臟抗氧化指標(biāo)的影響
由表2可知,灌胃不同劑量的FOs均可極顯著提高SOD和GSH-Px的活性(P<0.01),極顯著減低8-OHdG含量(P<0.01),但對T-AOC,CAT和GSH等抗氧化相關(guān)指標(biāo)無顯著影響(P>0.05)。隨著FOs劑量增加,SOD和GSH-Px活性呈二次方增加,而8-OHdG含量呈線性和二次方下降(P<0.01)。與對照組相比,Vc組大鼠肝臟的CAT,SOD和GSH-Px活性和8-OHdG的含量顯著提高(P<0.05)。與Vc組相比,F(xiàn)Os20組大鼠肝臟的GSH-Px活性和8-OHdG含量極顯著降低(P<0.01);FOs40組大鼠肝臟的T-AOC、CAT活性和8-OHdG含量顯著降低(P<0.05);FOs80組大鼠肝臟的SOD和GSH-Px活性和8-OHdG 含量顯著降低(P<0.05)。此結(jié)果表明,不同劑量的FOs均可提高大鼠肝臟組織中SOD和GSH-Px的活性,均可降低氧化代謝產(chǎn)物8-OHdG的含量。
2.2 不同劑量FOs對大鼠肝臟抗氧化基因mRNA表達的影響
由表3所知,灌胃不同劑量的FOs可提高肝臟GCLC、CAT、SOD和GSH-Px的mRNA相對表達水平(P<0.05),但對GCLM、HO-1和NQO1的mRNA表達水平無顯著影響(P>0.05)。隨著FOs劑量增加,GCLC、NQO1、CAT、SOD和GSH-Px的mRNA表達水平呈二次方增加(P<0.01)。與對照組相比,Vc組大鼠肝臟的CAT和GSH-Px的mRNA表達水平顯著提高(P<0.05)。與Vc組相比,F(xiàn)Os20組大鼠肝臟CAT的mRNA表達水平顯著增加;FOs40組大鼠肝臟GCLC,NQO1,CAT,SOD和GSH-Px的mRNA表達水平顯著增加(P<0.05)。此結(jié)果表明,不同劑量的FOs均可增加抗氧化酶的mRNA表達水平。
2.3 不同劑量FOs對大鼠肝臟Nrf2 mRNA表達的影響
由圖1(a)所知,與對照組相比,40 mg/kg FOs可顯著提高大鼠肝臟Nrf2的mRNA表達水平(P<0.05)。隨著FOs劑量增加,Nrf2的mRNA表達水平呈線性和二次方增加(P<0.01)。與Vc組相比,F(xiàn)Os40組中大鼠肝臟Nrf2的mRNA表達水平極顯著提高(P<0.01)。此結(jié)果提示,40 mg/kg FOs可增加抗氧化信號通路中Nrf2的mRNA表達水平。
2.4 不同劑量FOs對大鼠肝臟Nrf2蛋白表達的影響
由圖1(b和c)所知,與對照組相比,灌胃80 mg/kg FOs可顯著提高大鼠肝臟Nrf2的蛋白表達水平(P<0.05)。隨著FOs劑量增加,Nrf2的蛋白表達水平呈線性增加(P<0.05)。與對照組相比,Vc組中大鼠肝臟Nrf2的蛋白表達水平顯著提高(P<0.05)。此結(jié)果提示,80 mg/kg FOs可增加抗氧化信號通路中Nrf2 的蛋白表達水平。
3 討 論
肝臟是十分重要的代謝器官,極易受到ROS的攻擊,產(chǎn)生氧化應(yīng)激。機體可以通過復(fù)雜的抗氧化體系(酶體系和非酶體系)來清除ROS,緩解氧化應(yīng)激。酶體系統(tǒng)包括GSH-Px、CAT及SOD等[9]。SOD可促進超氧化物向H2O2轉(zhuǎn)化,而GSH-Px和CAT負責(zé)將H2O2轉(zhuǎn)化為水。FOs是由阿魏酸羧基與低聚糖羥基通過酯鍵聯(lián)接而成的一種阿魏酰衍生物,同時具有阿魏酸和低聚糖的生理功能,如抗氧化、調(diào)節(jié)免疫、調(diào)節(jié)腸道菌群及益生等[10]。Wang等[11]研究發(fā)現(xiàn),在杜寒雜交羔羊日糧中添加100~200 mg/kg FOs可提高其血漿中GSH-Px、CAT及SOD的活力。與上述研究結(jié)果相似,本研究表明,灌胃不同劑量的FOs均可提高肝臟組織中SOD和GSH-Px的活性,同時可增加CAT、SOD和GSH-Px的mRNA表達水平,且中劑量組中大鼠肝臟CAT、SOD和GSH-Px的mRNA表達水平高于Vc組。由此推斷,F(xiàn)Os可增加大鼠肝臟抗氧化酶活性,提高機體抗氧化能力,且40 mg/kg FOs的抗氧化效果優(yōu)于Vc。FOs的抗氧化作用可能是由于其含有阿魏酰基團和低聚糖基團,這些基團被證明具有抗氧化特性[12-13]。然而,與Vc組相比,灌胃高劑量(w(FOS)=80 mg/kg)的FOs給大鼠,對其抗氧化相關(guān)基因的mRNA表達量無影響。推測灌胃高劑量的FOs可能會對大鼠肝臟的抗氧化功能產(chǎn)生負面效應(yīng)。此外,Maurya等[14]研究體外試驗結(jié)果表明,低劑量阿魏酸有良好的抗氧化特性,而高劑量則具有促進氧化的作用。
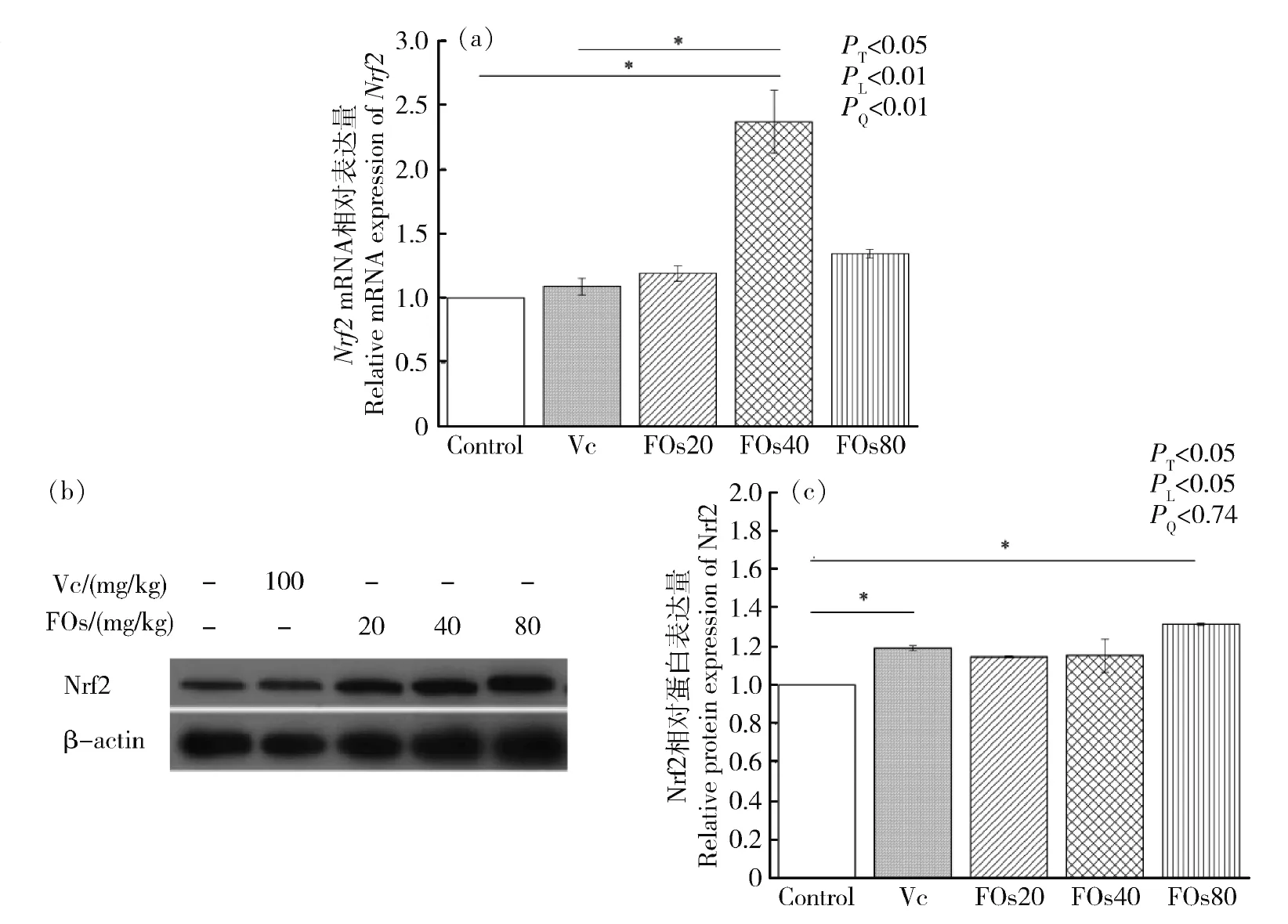
PT,處理效應(yīng);PL,線性效應(yīng);PQ,二次效應(yīng);*,P<0.05PT, treatment effect; PL, linear effect; PQ, quadratic effect; *, P<0.05圖1 不同劑量FOs對大鼠肝臟Nrf2基因表達(a)和蛋白表達的影響(b)和(c)Fig.1 Effect of FOs on the mRNA expression level (a) and protein expression (b) and (c) of Nrf2 in rat liver
非酶體系包括谷胱甘肽(Reduced glutathione, GSH)、維生素C、維生素E、類胡蘿卜素、丙酮酸、類黃酮、膽紅素及微量元素硒等[9]。GSH主要在肝臟合成,可以提供電子,直接清除ROS,也可作為GSH-Px的底物將H2O2轉(zhuǎn)化為水[15]。本研究表明,灌胃不同劑量的FOs一定程度上增加了肝臟GSH的合成,表明其可通過增加GSH的合成提高機體抗氧化能力。8-OHdG是DNA發(fā)生損傷時產(chǎn)生的主要有害代謝產(chǎn)物,是目前公認的評價氧化應(yīng)激指標(biāo)[16]。研究發(fā)現(xiàn),F(xiàn)Os可緩解由H2O2誘導(dǎo)的人淋巴細胞氧化應(yīng)激,保護DNA免受氧化應(yīng)激損傷[7]。本研究發(fā)現(xiàn),與Vc組相比,不同劑量的FOs均可顯著降低大鼠肝臟中8-OHdG的含量,表明其可作為一種抗氧化劑緩解DNA氧化應(yīng)激損傷。由此推測,F(xiàn)Os可通過增加非酶抗氧化劑GSH的含量和降低氧化代謝產(chǎn)物8-OHdG產(chǎn)生提高肝臟抗氧化能力。
Nrf2是目前研究最多的抗氧化信號通路關(guān)鍵因子之一,其可調(diào)控抗氧化酶的表達。當(dāng)氧化應(yīng)激發(fā)生后,Nrf2會被激活進入細胞核與抗氧化反應(yīng)元件(Antioxidant response element, ARE)結(jié)合,促進HO-1、NQO1、GCLC、GCLM、CAT、SOD和GSH-Px等抗氧化相關(guān)靶基因的轉(zhuǎn)錄和表達[17]。HO-1可通過與金屬離子螯合、修飾蛋白巰基及清除自由基等方式防御氧化應(yīng)激[18]。醌類可被NQO1直接被還原成氫醌,進而減少醌類轉(zhuǎn)化產(chǎn)生的氧自由基,從而緩解醌類物質(zhì)代謝引起氧化應(yīng)激損傷[19]。谷氨酸-半胱氨酸連接酶是由催化亞基GCLC和調(diào)節(jié)亞基GCLM組成的二聚體,它可以調(diào)控GSH的合成[20]。已有研究表明,攝食植物提取物可通過提高抗氧化酶的表達水平提高機體抗氧化能力。李涵等[21]研究發(fā)現(xiàn),玉香參附湯能夠降低大鼠心肌組織ROS水平和丙二醛含量,增強CAT、SOD活性,提高NQO1、HO-1蛋白表達量和Nrf2蛋白核轉(zhuǎn)移量。此外,原江水[22]研究發(fā)現(xiàn),白藜蘆醇可提高老齡大鼠肝臟組織中GCLC和GCLM等基因的表達水平。與上述研究結(jié)果相似,本研究發(fā)現(xiàn),灌胃FOs可提高Nrf2、GCLC和NQO1的mRNA表達水平,且中劑量組大鼠肝臟Nrf2、GCLC和NQO1的mRNA表達水平高于Vc組。此外,80 mg/kg FOs可增加抗氧化信號通路中Nrf2的蛋白表達水平。基于上述研究結(jié)果推測,F(xiàn)Os處理大鼠肝臟抗氧化能力的提高可能與Nrf2-ARE信號通路的關(guān)鍵因子Nrf2的激活有關(guān)。
4 結(jié) 論
不同劑量的FOs均可增強肝臟抗氧化酶活性,減少DNA氧化損傷,且可提高Nrf2及其下游抗氧化基因的mRNA表達水平,且以中劑量40 mg/kg BW的使用劑量效果最佳。本研究證實FOs具有良好體內(nèi)的抗氧化活性,有望作為一種抗氧化劑應(yīng)用于保健食品中。
 中國農(nóng)業(yè)大學(xué)學(xué)報2021年9期
中國農(nóng)業(yè)大學(xué)學(xué)報2021年9期
- 中國農(nóng)業(yè)大學(xué)學(xué)報的其它文章
- 留守經(jīng)歷對農(nóng)村兒童長期發(fā)展影響的研究進展
- 區(qū)塊鏈賦能食品供需網(wǎng)創(chuàng)新追溯模式
- 基于農(nóng)地確權(quán)數(shù)據(jù)的流轉(zhuǎn)土地價格與農(nóng)村人口的空間關(guān)系
——以觀音灘鎮(zhèn)為例 - 經(jīng)濟轉(zhuǎn)型背景下城市土地城鎮(zhèn)化格局及影響因素
——以長江經(jīng)濟帶城市為例 - 基于OpenFOAM的豬體空氣阻力系數(shù)模擬計算
- 利用牛糞生產(chǎn)墊料的滾筒結(jié)構(gòu)優(yōu)化
