翹嘴鱖雄性特異NLRP3基因cDNA的克隆及表達分析
歐陽號鋒,韓 崇,盧灝銘,朱巧瑩,馬澤昊,蒲海琦,李水生,張 勇
(中山大學 生命科學學院水生經濟動物研究所暨廣東省水生經濟動物良種繁育重點實驗室,廣州 510275)
0 引言
鱖魚(鱸形目,鮨科,鱖亞科,Sinipercachuatsi)是一類著名的珍貴淡水魚,主要分布在中國、越南和韓國的河流中[1]。根據中國古代詩歌和書籍,鱖魚在幾千年前就已經被用作烹飪食材[2]。鱖魚在中國養殖范圍十分廣泛,近年來,年產量已達到30萬噸。然而,由于翹嘴鱖口感好、味道佳且必需氨基酸和不飽和脂肪酸含量高而廣受消費者歡迎,一直處于供不應求的狀態。因此,提高養殖鱖魚的生產性能迫在眉睫。兩性異形在魚類中普遍存在,如泰國斗魚(Bettasplendens)雄性色彩更加鮮艷[2]。根據多年養殖觀察及相關文獻報道,雌性鱖魚的整體生長性能優于雄性[3]。因此,實現全雌魚養殖將能顯著提高鱖魚養殖產量。此外,病害是鱖魚養殖業最嚴重的威脅,其中,虹彩病毒病是限制鱖魚養殖產量增加的重要因素。
炎癥小體是由核苷酸結合結構域和富含亮氨酸重復序列家族成員以及pyrin和HIN結構域(PYHIN)家族成員形成的多蛋白復合物,主要包括PYD、NACHT、LRR 3 個部分[4]2284。 其中,NLRP3(NACHT,LRR and PYD domains-containing protein 3)炎癥小體一直是免疫炎癥領域中的重要研究對象,其在機體免疫和許多疾病的發生發展過程中發揮重要作用[4]2283。NLRP3是目前發現識別PAMPs和胞內危險信號種類最多的一種炎性小體,其介導的炎癥反應與機體加強對體內外病原微生物的防御和維持自身穩態密切相關。NLRP3的激活因子結構多樣、來源豐富,包括病毒RNA、過量ATP、真菌菌絲、透明質酸、活性氧自由基等;另外,細胞內外的陽離子的跨膜運輸、尿酸鹽結晶以及β-淀粉樣蛋白等也能激活NLRP3,進而引起無菌性炎癥[5]。目前,對魚類中的NLRP3研究很少。有研究表明,斑馬魚NLRP3的整體結構架構與哺乳動物NLRP3相同,且通過引發經典的炎性半胱天冬酶的炎性小體組裝激活和白細胞介素1成熟,確保IL-1的高效分泌來起始宿主先天免疫[6],[7]1121。
本研究以翹嘴鱖為研究對象,通過基因組及轉錄組水平篩選獲得翹嘴鱖雄性特異NLRP3基因序列,基于該基因序列成功開發出兩對翹嘴鱖雄性特異分子標記引物。另外,本研究還克隆得到翹嘴鱖雄性特異NLRP3基因全長蛋白編碼區序列,并進一步通過熒光定量PCR分析方法,研究了NLRP3基因在翹嘴鱖中的組織差異性表達,發現翹嘴鱖NLRP3基因在胃腸中有較高的表達。在不同時期精巢中的差異性表達分析發現NLRP3基因在雄性翹嘴鱖性腺發育早期表達,后期幾乎不表達。 本研究初步探究了NLRP3基因與翹嘴鱖性別決定與分化以及胃腸免疫過程存在的可能關聯,為翹嘴鱖性別決定及免疫研究提供新的思路。
1 材料與方法
1.1 實驗動物
實驗用翹嘴鱖(Sinipercachuatsi)取自廣東梁氏水產種業有限公司,通過土塘進行飼料。麻醉后,所有成熟魚的表型性均通過收集其釋放的配子或觀察雌性或雄性性腺來單獨確定。 解剖后,分別提取3條雄魚的18個組織的樣品,包括:嗅球、端腦、中腦、小腦、延腦、下丘、垂體、心臟、肝臟、腸、胃、性腺、頭腎、腎臟、皮膚、肌肉、鰓、脾臟,液氮速凍保存帶回實驗室,存放于-80 ℃冰箱備用。 同時,提取處于發育不同時期性腺組織樣品放液氮,即孵化后5、10、13、15、30、60、90、180 d。 另外,解剖鑒定性別后,取鰭條放入95%酒精中保存并記錄性別。
1.2 翹嘴鱖雄性特異NLRP3標記驗證及基因克隆分析
采用天根海洋動物基因組提取試劑盒從雌雄鰭條樣本中提取雌雄魚基因組DNA,DNA質量通過瓊脂糖凝膠電泳進行檢測,并用NanoDrop2000核酸蛋白檢測儀對總DNA濃度測定。 根據實驗室已有的基因組數據,通過NR注釋得到雄性特異的NLRP3基因序列,根據特異區段進行雄性特異分子標記引物設計(表1)。 先在6雌魚6雄魚中進行PCR驗證,然后擴大到16雌16雄進行再次驗證。PCR擴增反應條件:95 ℃ 5 min預變性,然后是擴增反應循環95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,循環35個,72 ℃最終延伸5 min。反應體系為5 μL 2Taq Plus Master Mix II(Vazyme,China),每個引物0.5 μL(10 μmol·L-1),DNA模板0.5 μL,ddH2O 3.5 μL。 PCR產物通過1%瓊脂糖凝膠電泳進行檢測。
另外,使用Trizol reagent試劑(Invitrogen,USA)從性腺組織中提取總RNA,總RNA質量用1%瓊脂糖凝膠電泳進行檢測,并使用NanoDrop2000測定總RNA濃度。 根據HiScript III 1st Strand cDNA Synthesis Kit(+gDNA wiper)(諾唯贊,南京)反轉錄試劑盒說明書將1 μg總RNA反轉錄得到cDNA模板。 根據實驗室已有的基因組和性腺轉錄組數據,獲取了NLRP3的基因組和轉錄本序列,根據已知序列兩端信息設計克隆引物,擴增出NLRP3完整蛋白編碼區序列(表1)。 PCR擴增反應條件:95 ℃ 5 min預變性,然后是擴增反應循環95 ℃ 30 s,55 ℃ 30 s,72 ℃ 3 min,循環35個,72 ℃最終延伸5 min,反應體系同上。將擴增得到的PCR產物送北京擎科新業生物技術有限公司進行測序分析。

表1 NLRP3克隆及定量的引物序列
1.3 NLRP3序列同源比對和系統發育分析
使用DNAMAN軟件中多序列比對方法,對如下5種魚類的NLRP3基因的氨基酸序列進行了同源性分析。 這5種魚類分別是:黃鰭鯛(Acanthopagruslatus,XM_037091148)、大黃魚(Larimichthyscrocea,XM_027279461)、尼羅羅非魚(Oreochromisniloticus,XM_005477861)、斑馬魚(Daniorerio,MN088121)以及本研究中的翹嘴鱖(Sinipercachuatsi)。
系統發育分析選取16種魚類,鱸形目的黃鰭鯛(Acanthopagruslatus,XM_037091148)、大黃魚(Larimichthyscrocea,XM_027279461)、加州鱸(Micropterussalmoides,XM_038698023)、尼羅羅非魚(Oreochromisniloticus,XM_005477861)、尼加拉瓜湖始麗魚(Archocentruscentrarchus,XM_030752535)、河鱸(Percafluviatilis,XM_039776706)、金頭鯛(Sparusaurata,XM_030410776)、白梭吻鱸(Sanderlucioperca,XM_035996640)、斑馬擬麗魚(Maylandiazebra,XM_004562477)、鮭形目的虹鱒(Oncorhynchusmykiss,XM_021587565)、鯡形目大西洋鯡魚(Clupeaharengus,XM_031560888)、鲉形目的蔭平鲉(Sebastesumbrosus,XM_037794798)、鳉形目的底鳉(Fundulusheteroclitus,XM_012852651)、黑點青鳉(Oryziasmelastigma,XM_024277246)、合鰓魚目的大刺鰍(Mastacembelusarmatus,XP_026179754)以及外類群鯉形目的斑馬魚NLRP12(Daniorerio,XP_017211428),使用MEGA 7軟件鄰接法(neighbor-joining)對上述序列進行系統發育分析,構建翹嘴鱖NLRP3基因系統發育樹,自展值設為1 000。
1.4 組織表達檢測
先根據HiScript III RT SuperMix for qPCR(+gDNA wiper)(諾唯贊,南京)反轉錄試劑盒說明書將所需組織1 μg RNA反轉錄得到cDNA模板。 然后采用β-actin基因作為內參基因,對翹嘴鱖雄性特異NLRP3基因在18個組織的表達水平進行實時熒光定量PCR(qRT-PCR)檢測。 qRT-PCR在LightCycle 480系統(Roche,使用AceQ qPCR SYBR Green Master Mix)(諾唯贊,南京)。 所有的PCR反應包含cDNA 1 μL,每個引物0.2 μL(10 μmol·L-1),AceQ qPCR SYBR Green Master Mix 5 μL,ddH2O 3.6 μL。熱循環條件包含1個初始變性步驟95 ℃ 2 min,然后95 ℃ 10 s,60 ℃ 20 s,72 ℃持續20 s,循環40次。所有PCR反應均設3個重復,并進行溶解曲線分析確定擴增特異性。反應與檢測方法參考黃景軍[8]。
1.5 性腺表達檢測
使用上述反轉錄試劑盒對早期性腺RNA模板進行反轉錄,在Roche Light Cycler 480(Roche,德國)實時熒光定量PCR 儀上進行qRT-PCR分析,檢測NLRP3基因在性腺發育不同時期的表達,以β-actin 作為內參基因。反應體系和反應條件同上[8]。
1.6 數據處理
采用2-ΔΔCT方法計算NLRP3基因的相對表達量,實驗數據通過SPSS 21.0軟件單因素方差分析(One-way ANOVA),選擇Duncan多重檢驗,進行差異顯著性分析,P<0.05則表示差異顯著。 所得數據結果用平均值±標準差(Mean±SD)表示。
2 結果與分析
2.1 翹嘴鱖雄性特異NLRP3基因鑒定與cDNA克隆分析
通過基因組和轉錄組水平檢索分析,本研究成功鑒定出1個雄性特異NLRP3基因序列,基于該序列設計得到2對雄性特異擴增引物M1和M2,首先在6雌6雄個體中實現雄性特異擴增,分別得到890 bp和951 bp的產物(圖1),之后在16雌16雄進行擴大驗證,結果證明,M1和M2只在雄性中特異擴增(圖2),進一步說明該NLRP3基因是雄性特異的。
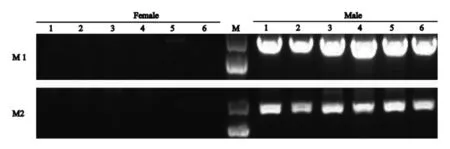
圖1 6只雌、雄魚的PCR檢測和遺傳性別鑒定
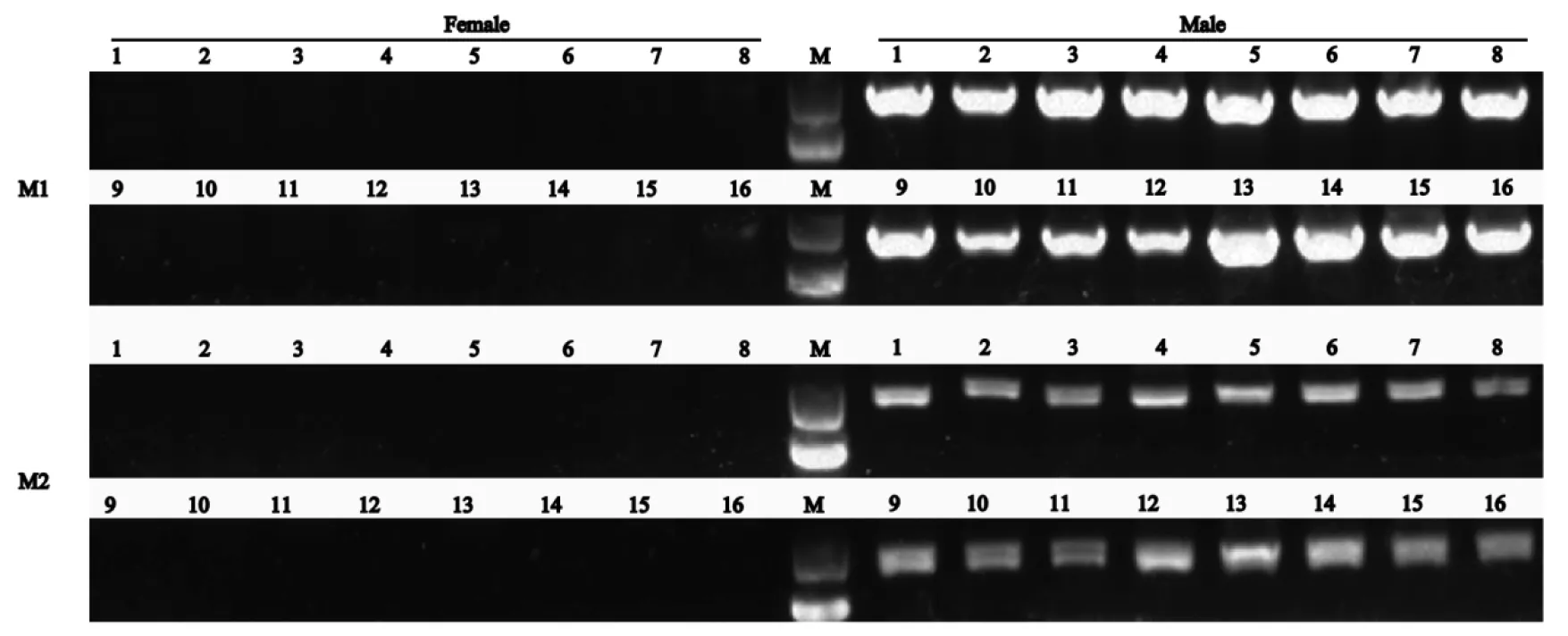
圖2 16只雌、雄魚的PCR檢測和遺傳性別鑒定
此外,通過PCR測序,本研究成功克隆得到NLRP3基因完整蛋白編碼區序列(圖3),從圖3可知,該基因蛋白編碼區全長3 915 bp,共編碼1 305個氨基酸。等電點為6.35,相對分子質量為146 266.05 Da。

圖3 翹嘴鱖雄性特異NLRP3基因的cDNA ORF核酸序列及對應的氨基酸序列
2.2 翹嘴鱖雄性特異NLRP3基因同源性分析
得到翹嘴鱖NLRP3編碼蛋白的氨基酸序列后,通過Blast從NCBI數據庫中找到多條其他魚類中NLRP3基因的氨基酸序列,通過比對和結構域分析發現,翹嘴鱖雄性特異NLRP3存在pyrin結構域(PYD)、NACHT結構域、多個Leucine-rich repeats(LRR)結構域以及SPla and the RYanodine Receptor(SPRY)結構域(圖4)。 其中,NACHT結構域保守性最高。

圖4 5種魚類中NLRP3蛋白氨基酸序列的多重比對
2.3 翹嘴鱖雄性特異NLRP3基因的進化樹分析
通過鄰接法(Neighbor joining)構建了多種魚類NLRP3基因氨基酸序列的系統發育樹,從圖5可知,由NLRP3基因構建的系統發育樹得出翹嘴鱖與鱸形目的加州鱸(Micropterussalmoides)最先聚為一支,后與白梭吻鱸和河鱸(Percafluviatilis)等聚到一起,之后與金頭鯛(Sparusaurata)、黃鰭鯛(Acanthopagruslatus)等聚在一起,與傳統分類基本一致。

圖5 翹嘴鱖NLRP3基因的系統進化樹
從GenBank中選出的其他物種基因的序列號:黃鰭鯛(Acanthopagruslatus,XM_037091148)、蔭平鲉(Sebastesumbrosus,XM_037794798)、加州鱸(Micropterussalmoides,XM_038698023)、尼加拉瓜湖始麗魚(Archocentruscentrarchus,XM_030752535)、河鱸(Percafluviatilis,XM_039776706)、金頭鯛(Sparusaurata,XM_030410776)、白梭吻鱸(Sanderlucioperca,XM_035996640)、斑馬擬麗魚(Maylandiazebra,XM_004562477)、大黃魚(Larimichthyscrocea,XM_027279461)、虹鱒(Oncorhynchusmykiss,XM_021587565)、大西洋鯡魚(Clupeaharengus,XM_031560888)、底鳉(Fundulusheteroclitus,XM_012852651)、黑點青鳉(Oryziasmelastigma,XM_024277246)、尼羅羅非魚(Oreochromisniloticus,XM_005477861)、大刺鰍(Mastacembelusarmatus,XP_026179754)、斑馬魚(Daniorerio,XP_017211428)。
2.4 翹嘴鱖雄性特異NLRP3基因在不同組織中的表達分析
通過組織分布定量檢測,發現性成熟翹嘴鱖雄性特異NLRP3基因在所有組織均有檢測到表達,但大多數組織中表達量很低,如小腦、延腦、頭腎、精巢、皮膚、腎臟和脾臟等。而在胃、腸、肝臟以及肌肉中表達相對較高(圖6)。
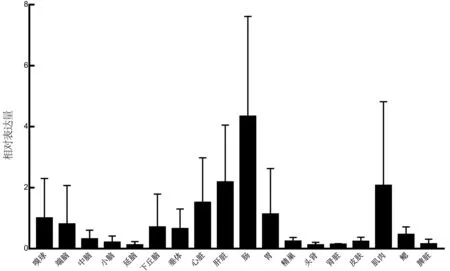
組織
2.5 翹嘴鱖雄性特異NLRP3基因在性腺發育不同階段中的表達分析
通過對NLRP3基因在性腺發育不同階段進行檢測,結果發現,NLRP3基因僅在性腺發育早期有較高的表達,60 d后表達量極其微小,而且NLRP3基因在30 d前表達量呈現先逐漸上升后下降的趨勢,而30 d之前為翹嘴鱖性別分化的關鍵時期。因此推測,NLRP3基因可能參與翹嘴鱖精巢早期發育過程(圖7)。
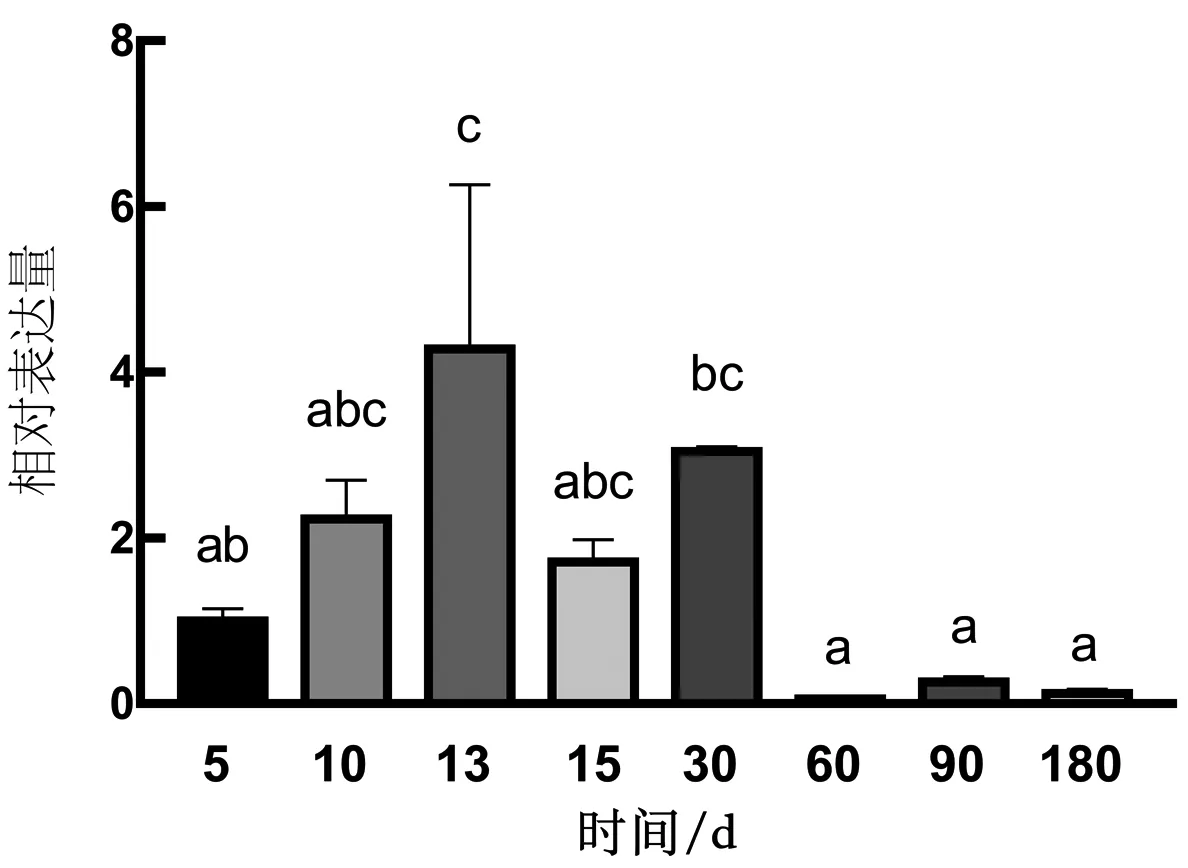
圖7 翹嘴鱖NLRP3基因在雄魚不同發育階段的表達模式
3 討論
我國是水產養殖大國,養殖產量約占全世界水產養殖產量的70%。近年來,隨著魚類養殖業的快速發展,優良水產養殖品種的缺乏已成為制約我國魚類養殖健康可持續發展的重要障礙。鱖魚是我國重要的淡水養殖魚類,有生長快、肉質好等特點,深受廣大養殖戶及消費者的喜愛[1]。近年來,鱖魚在國內養殖產業發展迅速,廣東省養殖產量最大,約占全國產量的1/3。鱖魚有1個重要特點,即生長呈現性別二態性,在成魚養殖階段,雌魚生長比雄魚快約10%~20%[9-10]。因此,探索鱖魚性別生長二態性的調控機制,對于創制單性鱖魚苗種以及提高鱖魚養殖產量具有重要的理論和現實意義。
本研究基于已有的基因組和轉錄組數據,首次發現了1條翹嘴鱖雄性特異的NLRP3基因,并基于該基因序列成功開發出兩對雄性特異分子標記,進一步支持翹嘴鱖性別決定系統為XY性別型[11]。 由于翹嘴鱖雌性生長快于雄性,因此,根據以往的鯉魚[12]和黃姑魚[13]全雌種群繁殖方法,最關鍵的就是培育并篩選遺傳基因型為XX的生理雄魚。LIU S等[14]指出雄激素投喂能夠誘導翹嘴鱖XX雌魚性逆轉為生理雄魚。因此,利用上述分子標記將XX生理雄魚篩選出來,即可用于和XX正常雌魚交配,從而培育得到全雌翹嘴鱖。
此外,本研究還在早期性腺樣本克隆得到NLRP3基因的全長蛋白編碼區序列,表明其在早期發育過程中能夠正常表達。另外,通過序列比對分析發現該序列具有NACHT,LRR和PYD等多種結構域,NACHT 可將ATP水解為二磷酸腺苷ADP 并釋放能量,調控NLRP3下游蛋白;PYD 結構域可以與其他蛋白PYD 結構域結合,從而激活下游反應;LRR 結構域具有高度保守的亮氨酸重復序列,激活后可通過離子能與無絲分裂基因A相關蛋白激酶7(NIMA related kinase 7,NEK7)結合,還能夠介導炎癥小體運輸及病原識別[4]2284,[6],表明翹嘴鱖雄性特異NLRP3基因具有識別刺激因子并引發機體的炎癥反應及抗病免疫反應過程的潛在能力[7]1135。系統發育分析也顯示翹嘴鱖雄性特異NLRP3基因能夠與鱸形目中加州鱸、白梭吻鱸、河鱸、金頭鯛以及黃鰭鯛的NLRP3基因聚在一起,進一步說明NLRP3基因具有較高的保守性。
組織分布定量分析表明NLRP3基因在翹嘴鱖胃腸中表達量相對較高。同樣,Masanort T等[15]指出,相比脾臟等免疫器官,豬的NLRP3基因在腸免疫組織表達量更高;另外,有研究表明,NLRP3在無脊椎動物刺身體腔中的表達量也比較高[16]。胃腸道作為第1道防線,直接接觸病原微生物,因此筆者認為,翹嘴鱖NLRP3基因能夠直接參與胃腸道抗菌免疫過程。然而,該基因為雄性特異基因,只在雄性翹嘴鱖中表達,這表明雄性翹嘴鱖或許在抗病免疫中相較于雌性具有一定優勢,這需要進一步研究來證實。另外,不同發育階段表達分析結果顯示,NLRP3在性別分化早期呈現先上升后下降的表達趨勢,在性腺發育后期幾乎無表達。根據本實驗室已有結果發現,翹嘴鱖在孵化后15 d,傳統性別相關基因在雌雄魚中表達水平出現明顯分化,如Dmrt1和Amh在雄魚中開始高表達,Foxl2和Cyp19a1a在雌魚中高表達,而NLRP3表達高峰出現在孵化后13 d。因此,推測NLRP3可能參與了這些性別相關基因的早期調控,但具體如何調控尚不清晰。有研究表明,虹鱒免疫基因干擾素調節因子9(IRF9)是虹鱒的性別的決定基因,且只在性腺發育早期表達[17]。因此筆者推測,該雄性特異NLRP3基因雖然是免疫相關基因,但也可能參與翹嘴鱖早期性別分化及發育過程。
(責任編輯:潘學峰)

