成像流式細胞術在檢測巨噬細胞吞噬腫瘤細胞中的應用
方亦龍,韓大飛,檀學文,許 振,蔣海峰,涂佳杰,魏 偉
經典流式細胞檢測技術可以從細胞分子水平上通過抗原-抗體特異性結合原理對單個細胞或亞細胞層面進行精準、快速的高通量定量分析。該技術可以在短時間內分析成千上萬個細胞,獲得每個細胞的散射光信號和熒光信號,從而得到細胞群體的各種統計數據。目前,經典流式細胞術利用Cytomics FC500型流式細胞儀等設備可用于檢測巨噬細胞吞噬腫瘤細胞的能力,但缺少相關的細胞形態、細胞結構和亞細胞水平信號分布的信息。而成像流式細胞術是一種新型檢測技術,不僅具有經典流式細胞術的特點,還可實現單個細胞高分辨率的數字成像及細胞的可視化,獲得細胞形態學、胞內分子分布、細胞間信號轉導和細胞狀態的變化等數據信息,包括細胞間相互作用、吞噬、凋亡、自噬、核易位和形態變化等。該實驗運用成像流式檢測技術,以miR-22對巨噬細胞吞噬膠質瘤細胞的影響作為檢測指標,與經典流式細胞術進行比較,為檢測腫瘤細胞的吞噬能力提供新的方法。
1 材料與方法
1.1 材料
1
.1
.1
細胞株 小鼠單核巨噬細胞RAW264.7和小鼠膠質瘤細胞GL261購自中國科學院細胞庫。1
.1
.2
試劑與儀器 DMEM高糖培養基、DMEM-F12培養基、磷酸鹽緩沖液(phosphate buffered saline,PBS)、胎牛血清(fetal bovine serum,FBS)購自美國BI公司;胰蛋白酶、青-鏈霉素購自上海碧云天生物技術研究所;lipofectamine 2000購自美國Thermo Fisher公司;miR-22 mimics、陰性對照mimics(NC mimics)由上海吉瑪制藥技術有限公司合成;熒光染料CFSE購自上海貝博生物科技有限公司;CD11b-VioBlue購自德國Miltenyi Biotec公司;Cytomics FC500流式細胞儀購自美國貝克曼公司;ImageStreamX Mark Ⅱ成像流式細胞儀購自德國默克密理博公司;SIGMA 3-30 K低溫高速離心機購自上海納騰儀器有限公司。1.2 方法
1
.2
.1
細胞培養 將小鼠單核巨噬細胞RAW264.7、小鼠膠質瘤細胞GL261置于37 ℃、5% CO恒溫培養箱中培養,并用含有10%FBS和1%青-鏈霉素的培養基進行換液、傳代。當培養瓶中細胞密度長至80%左右時開始進行相關實驗。1
.2
.2
細胞轉染 以1×10/ml的密度將RAW264.7細胞接種于6孔板中,待細胞貼壁后設為對照組(NC mimics組)和miR-22 mimics組。當融合率達80%時,按照lipofectamine2000說明書進行轉染。轉染48 h用于后續實驗。1
.2
.3
流式細胞術檢測吞噬 GL261細胞在培養瓶中消化,用染色工作液重懸,至細胞濃度大約1×10個/ml,在37 ℃培養箱孵育20 min后離心收集細胞。RAW264.7細胞與CFSE標記的GL261細胞在37 °C、5%CO濕潤環境中按3 ∶1的比例混合培養6 h,后將細胞重懸于100 μl PBS中,并在4 °C下用抗小鼠CD11b標記40 min。洗滌細胞,重懸于100 μl PBS中,用Cytomics FC500流式細胞儀進行檢測。每個檢測指標設3個復管,重復3次。1
.2
.4
成像流式細胞術檢測吞噬 細胞處理同上,用ImageStreamX Mark Ⅱ成像流式細胞儀進行檢測。吞噬比例分析:首先對單陽性樣本進行軟件自動熒光補償,選擇分析吞噬所需的智能模塊(內化),設定標記RAW264.7細胞(Ch07)和GL261細胞(Ch02)的檢測通道,通過調整對焦好的單個細胞,將RAW264.7細胞作為核轉位分析對象,GL261細胞(Ch02)設定為陽性的細胞群,軟件自動劃定吞噬GL261的細胞并計算統計結果。每個檢測指標設3個復管重復3次。1.3 統計學處理
相關性分析采用線性回歸和2個配對樣本的非參數檢驗。一致性評價采用Bland-Altman法,繪制Bland-Altman圖的橫坐標(Average)為(Mark Ⅱ+FC500)/2, 縱坐標(Bias)為(Mark Ⅱ-FC500)/[(Mark Ⅱ+FC500)/2]。組間比較采用t
檢驗,以P
<0.05為差異有統計學意義。2 結果
2.1 兩種流式細胞術檢測巨噬細胞吞噬能力
2
.1
.1
經典流式細胞術檢測巨噬細胞吞噬能力的情況 為了觀察經典流式細胞術檢測效果,利用Cytomics FC500流式細胞儀檢測RAW264.7細胞吞噬GL261細胞的情況,結果如圖1所示,在散點圖中,PB450單陽為CD11b標記的單個巨噬細胞,FTTC單陽為CFSE標記的膠質瘤細胞,雙陽為吞噬完成的巨噬細胞和膠質瘤細胞。與對照組比較,miR-22 mimics組RAW264.7細胞吞噬腫瘤細胞能力增加, 差異有統計學意義(t
= 5.291,P
<0.05)。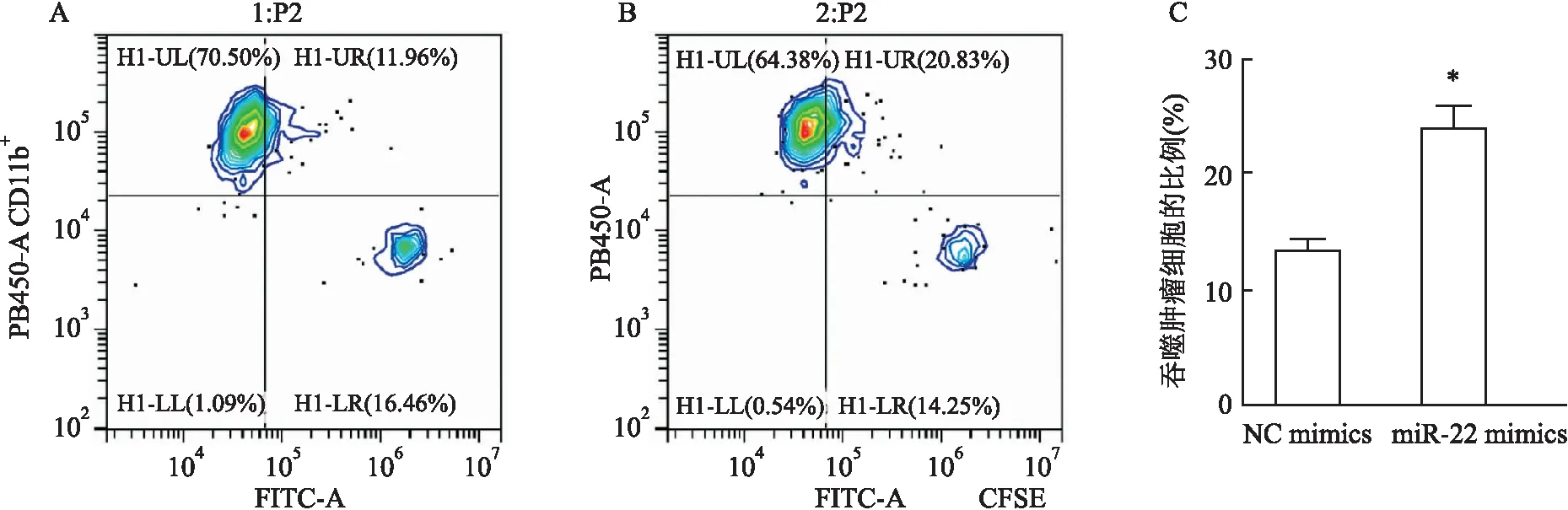
圖1 經典流式細胞術檢測RAW264.7細胞吞噬GL261細胞的情況A:NC mimics組吞噬GL261細胞的比例;B:miR-22mimics組吞噬GL261細胞的比例;C:RAW264.7細胞轉染NC mimics和miR-22 mimics之后吞噬GL261細胞比例的統計圖;與NC mimics組比較:*P<0.05
2
.1
.2
成像流式細胞術檢測巨噬細胞吞噬能力的情況 為了觀察成像流式細胞術檢測效果,利用ImageStreamX Mark Ⅱ成像流式細胞儀檢測RAW264.7細胞吞噬GL261細胞的情況,結果如圖2。調整聚焦好的單個細胞見圖2A,將RAW264.7細胞作為核轉位分析對象,GL261細胞(Ch02)設定為陽性的細胞群見圖2B,軟件自動劃定吞噬GL261的細胞并計算統計結果,見圖2C-2E。與對照組比較,miR-22 mimics組RAW264.7細胞吞噬腫瘤細胞能力增加(t
=9.720,P
<0.05),差異有統計學意義,與經典流式細胞術的結果一致。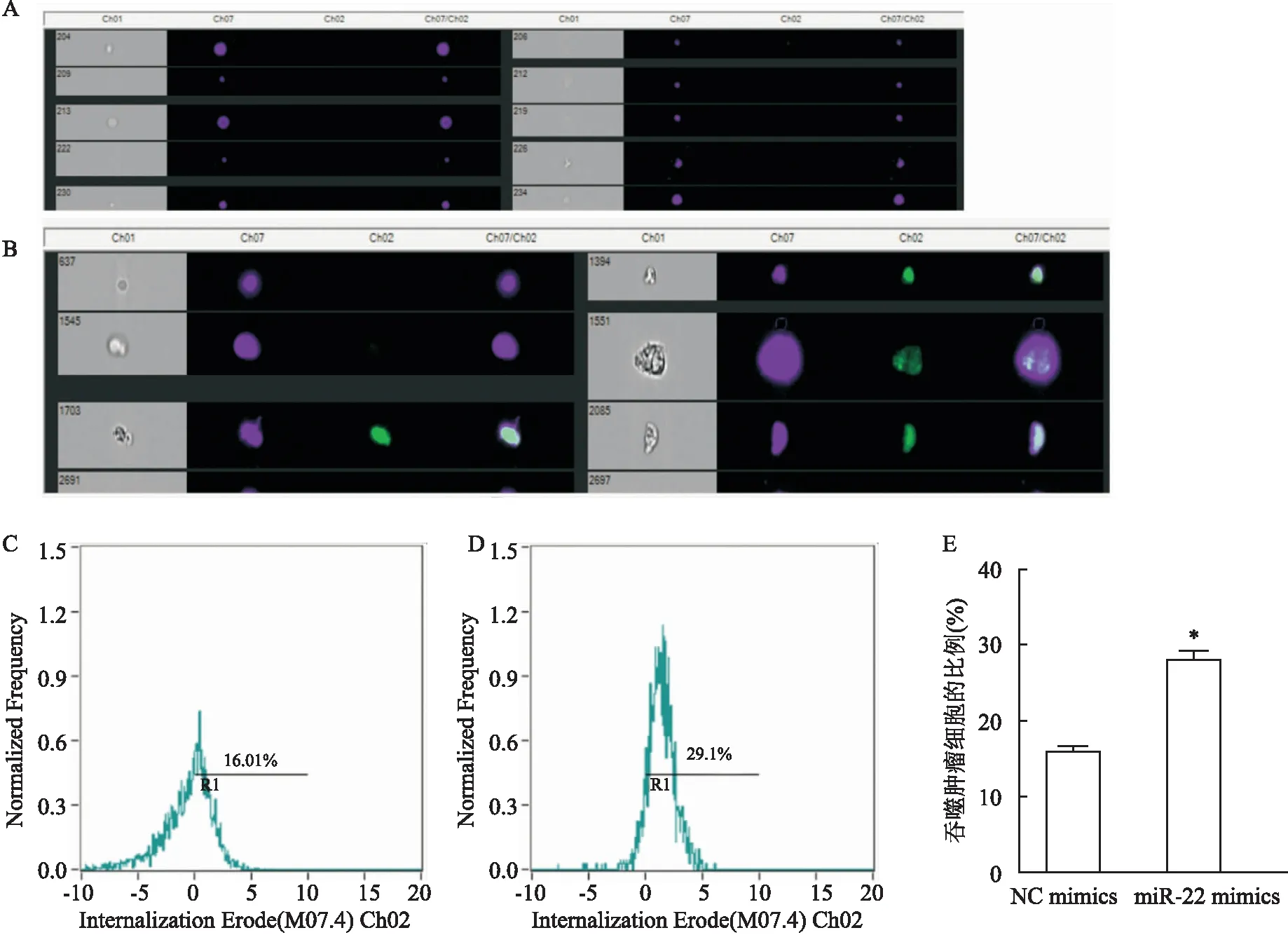
圖2 成像流式細胞術檢測RAW264.7細胞吞噬GL261細胞的情況(n=3)A:聚焦好的單個細胞;B:RAW264.7細胞設定為核轉位分析對象(Ch07),GL261細胞(Ch02)設定為陽性的細胞群;C:NC mimics組吞噬GL261細胞的比例;D:miR-22mimics組吞噬GL261細胞的比例;E:RAW264.7細胞轉染NC mimics和miR-22 mimics之后吞噬GL261細胞比例的統計圖;與NC mimics組比較:*P<0.05
2
.1
.3
相關性和一致性 為了觀察經典流式細胞術和成像流式細胞術檢測巨噬細胞吞噬能力的相關性和一致性,利用Cytomics FC500流式細胞儀和ImageStreamX Mark Ⅱ成像流式細胞儀檢測RAW264.7細胞轉染NC mimics和miR-22 mimics之后吞噬GL261細胞的結果。結果的判定系數R均大于0.8,斜率在1.154~1.457,截距在2.434~-1.135之間,Z值分別為-3.824和-3.724,P
<0.05,相關性良好,見表1。Bland-Altman分析顯示, 兩種方法檢測RAW264.7細胞轉染NC mimics和miR-22 mimics之后吞噬GL261細胞的百分比的偏倚分別為4.289%和8.073%,偏倚的標準差分別為0.493 6%和0.711 5%,95%一致性界限分別為(3.321%,5.256%)和(6.679%,9.468%),Bland-Altman圖如圖3所示,一致性界限范圍較窄。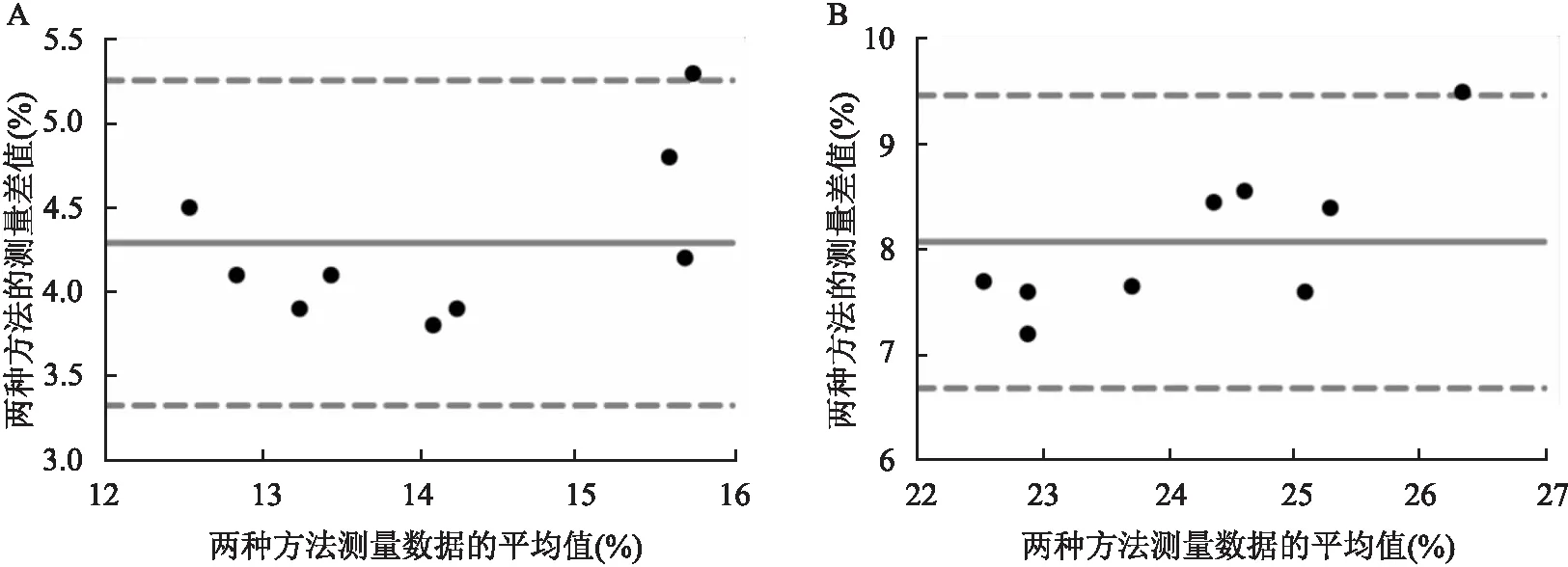
圖3 經典流式細胞術和成像流式細胞術檢測RAW264.7細胞轉染NC mimics和miR-22 mimics之后吞噬GL261細胞比例的偏倚值圖A:經典流式細胞術和成像流式細胞術檢測RAW264.7細胞(NC mimics組)吞噬GL261細胞比例的偏倚值;B:經典流式細胞術和成像流式細胞術檢測RAW264.7細胞(miR-22mimics組)吞噬GL261細胞比例的偏倚值

表1 經典流式細胞術和成像流式細胞術檢測技術的相關性分析(n=3)
2.2 成像流式細胞術觀察RAW264.7細胞對GL261細胞進行吞噬的過程
與經典流式細胞術不同的是,成像流式細胞術可以結合圖像清晰地觀察到巨噬細胞對腫瘤細胞的吞噬過程,適用于需要對吞噬過程準確研究的實驗。利用ImageStreamX Mark Ⅱ成像流式細胞儀觀察巨噬細胞吞噬腫瘤細胞的過程,如圖4所示:綠色熒光標記的是GL261膠質瘤細胞,紫色熒光標記的是RAW264.7巨噬細胞。未吞噬膠質瘤細胞的單個巨噬細胞代表圖見圖4A,吞噬完成的巨噬細胞和膠質瘤細胞代表圖見圖4B。圖4C可見巨噬細胞正在進行吞噬過程的細胞圖像,可見巨噬細胞與膠質瘤細胞之間吞噬杯的形成。
圖4 成像流式細胞術觀察RAW264.7細胞對GL261細胞進行吞噬的過程A:未吞噬膠質瘤細胞的單個巨噬細胞代表圖;B:吞噬完成的巨噬細胞和膠質瘤細胞代表圖;C:巨噬細胞正在進行吞噬過程的細胞圖像
3 討論
通過吞噬作用這一過程,巨噬細胞能夠捕獲和消除轉化的惡性細胞,并將腫瘤來源的抗原呈遞給T細胞并激活下游的適應性免疫應答。近年來腫瘤的免疫治療取得了巨大的進步,通過體外基因編輯技術重新喚醒巨噬細胞對腫瘤細胞毒性作用從而對腫瘤起到治療效果。本實驗利用兩種不同流式細胞技術檢測miR-22對巨噬細胞吞噬膠質瘤細胞的影響,同時獲取細胞圖像,為進一步評價miR-22對提升吞噬細胞吞噬腫瘤細胞的能力以及更好地選擇實驗方法提供依據。
從實驗結果可以看出,經典流式細胞術和成像流式細胞術檢測巨噬細胞吞噬能力的相關性和一致性較好,但兩者結果差異有統計學意義 (P
<0.05)。除了人為的操作原因外,也可能是由于使用不同的儀器和不同的配套試劑所致。不過在實驗過程中,由同一人在同樣操作下上機檢測,注意樣本的充分混勻、適合的樣本抗體比例、正確的設門分析和適當的電壓補償調節等細節因素,兩種方法測得百分比結果的差異可以控制在較小范圍內。經典流式細胞術因其具有上樣速度快(上機時間平均只需1 min)、操作簡單并適用多種標本的檢測等優點,應用廣泛。然而,對于這種經典流式細胞術,細胞只是散點圖上的一個點,而不是真實的細胞圖像,并且缺少相關的細胞形態、細胞結構和亞細胞水平信號分布的信息,因此局限于不要求細胞結構的分析;并且細胞圈門以及熒光強度的調節需要專業人員調試后方可使用,其結果受到人為操作因素影響較大。成像流式細胞術因其操作簡便,獲取信息多,是近年來快速發展的新型流式細胞技術,它建立在傳統的流式細胞術基礎之上,結合了熒光顯微成像技術,具有多個檢測通道,可以對通過流動室中的每個細胞進行成像,實現了對細胞圖像進行多參數量化分析,獲得全新的細胞形態統計學數據。雖然上樣速度慢于經典流式細胞術,每管平均時間需3 min,并且選用的洗液為無鈣、鎂離子的PBS,需要更高的成本,但成像流式細胞分析儀的優點很多:使用簡單,無需專用耗材,直接在機器上用1.5 ml離心管,不需要使用專用的流式管;檢測和分析方案建立方法操作簡單易學;可自動調節熒光強度,電壓補償可在檢測完成后調整;細胞用量很少,上樣體積只需20~200 μl即可,可適用于樣本細胞較少或者珍貴樣本的流式檢測;樣本利用率和回收率很高,上樣過后的細胞仍可以回收用于其他實驗如提蛋白或者提RNA等;特別重要的是,通過成像技術在分析數據時,可區分假陽性細胞,提高樣本檢測的正確率。因此對于吞噬細胞對腫瘤細胞或者病原體吞噬的研究,如只需要對吞噬統計學結果進行分析,選擇上樣簡單、速度快的經典流式細胞術即可,如需要對吞噬過程準確研究或者樣本量稀少的實驗可選擇成像流式術。成像流式既能提供細胞群的統計數據,又可以結合圖像清晰觀察到巨噬細胞對腫瘤細胞的吞噬過程,有望在吞噬能力的分析和觀察中得到更為廣泛的關注。綜上,成像流式細胞術可在同等操作下獲得更多實驗結果,但實驗儀器的選擇還要取決于具體的實驗條件、實驗目的、檢測指標等要求。

