基于大數據的藥物警戒研究:美國食品藥品監督管理局的最新研究進展及對我國的啟示
沈春英,仇茂珍,顧 萌,相小強,韓 冰,袁 靜*
(1.復旦大學附屬閔行醫院藥劑科,上海 201199;2.上海市閔行區市場監督管理局藥化科,上海 201199;3.復旦大學藥學院臨床藥學與藥事管理系,上海 201203)
世界衛生組織(World Health Organization,WHO)對藥物警戒(pharmacovigilance)的定義是:“發現、評估、理解和預防藥品不良反應或其他任何藥物相關問題的科學和活動”[1]。建立完善的藥物警戒體系對健全藥物監管法律、法規和體制,開展臨床實踐和公共衛生計劃都極為必要。例如,由于數據分析等問題,羅非昔布在上市后5年才確認其心臟藥品不良反應(ADRs)并撤出市場,導致了大量患者因心血管事件而猝死。有研究表明,如果可以采集1億名使用羅非昔布的患者信息,在3個月內即可發現該藥物誘發心血管疾病的風險[2]。該事件也引起了人們對大數據用于藥物上市后監測的重視。
近年來,隨著電子信息技術的發展,基于大數據的藥物警戒研究成為可能。自20世紀90年代以來,電子病歷(electronic medical record,EMR)系統已在美國和歐洲部分國家逐漸普及,使獲取醫療大數據成為可能。EMR是典型的大數據,通常包括數百萬人的醫療信息,符合大數據的“5V”特征,即體量大(volume)、生成速度快(velocity)、多樣性(variety)、價值性(value)和真實性(veracity)。
本文旨在介紹美國食品藥品監督管理局(Food and Drug Administration,FDA)在藥物警戒領域的最新研究動向,為我國藥物警戒系統的完善提供啟示和參考。
1 美國FDA的藥物警戒系統
美國藥物警戒工作由FDA的藥品審評與研究中心(Centre for Drug Evaluation and Research,CDER)負責,采用主動和被動相結合的方法監測ADRs。美國藥品不良事件報告系統(FDA adverse event reporting system,FAERS)主要收集來自MedWatch自愿報告系統的數據和醫藥企業強制上報的數據[3]。除了用于自發報告的數據庫外,FDA近年來還通過其他數據來源,主動收集ADRs數據。
自2008年5月起,FDA啟動了“哨點倡議(sentinel initiative)”[4]。“哨點倡議”旨在探索利用大型電子病歷信息庫進行藥物警戒研究的可行性,以及作為現有被動監測體系(FAERS)的有效補充。在“哨點倡議”成功后,FDA于2016年2月正式建立“哨點系統”。哨點系統中電子健康數據(electronic health records, EHRS)的主要來源是醫療保險賬單,其次來自醫療記錄。目前,其多站點分布式數據庫是世界上最大的用于醫療器械安全性評估的數據庫。根據FDA對哨點系統最新的戰略規劃,還將嘗試納入國家患者中心臨床研究網絡(PCORnet)等其他數據源[5],旨在應用大數據等開發哨點系統的新功能。
在哨點系統中,FDA通過“主動風險識別與分析(active risk identification and analysis,ARIA)”系統來收集貫穿藥品全生命周期的安全信息,并根據其優先等級進行分類,最后自動識別安全問題。哨點實施中心會將FDA篩選的安全問題制成單一的分析程序,繼而交給其合作機構。目前,該中心已有18家合作機構,包括醫院、大學、政府等非盈利科研機構。合作機構會在各自獨立的分布式系統中提取相關數據并獨立進行分析與評估。在獨立的分析過程中,各機構利用通用數據模型(common data model,CDM)實現以相同的標準化計算機程序對數據進行處理。各合作機構所得的分析結果由哨點實施中心進行標準化處理后進一步綜合處理和評估,最后反饋給FDA,由FDA決定是否將評估結果向公眾發布以及是否采取進一步的行動。該風險信號評估流程的優勢是,分布式數據系統和通用數據模型可以在最大限度地保護患者的個人信息的基礎上,同時整合各個科研機構在數據分析上的優勢,以保證數據分析的準確性和高效性。截至2018年,哨點系統已分析了超過3億人的數據,成為FDA上市藥物安全性監測工具庫的核心,對保障公眾用藥安全,提高公眾的生活質量具有重要意義[6]。
2 我國的藥物警戒系統研究現狀
2016年,我國啟動了ADRs監測哨點建設試點工作。經過不懈的努力,我國的藥物警戒工作已初顯成效。2019年8月,我國新修訂的《中華人民共和國藥品管理法》首次將藥物警戒制度寫入法律,標志著我國藥物警戒制度的建設與發展進入新篇章。但與美國和歐洲部分國家相比,仍存在一定的差距。2019-12-01,新修訂的《中華人民共和國藥品管理法》正式施行,標志著我國藥品管理進入新時代。在新版《中華人民共和國藥品管理法》中,第十二條第二款中明確規定了“國家建立藥物警戒制度,對藥品不良反應及其他與用藥有關的有害反應進行監測、識別、評估和控制”。該制度立足于藥品全生命周期的全方位藥品安全監管制度,其建立健全是我國醫藥產業與國際接軌的剛需。2020年1月,國家藥品不良反應監測中心組織制定的《上市許可持有人藥品不良反應報告表(試行)》發布。2020年6月,為確保有效開展藥品上市后ADRs及其他與用藥有關的有害反應的監測、識別、評估和控制工作,國家藥品不良反應監測中心發布《藥物警戒委托協議撰寫指導原則(試行)》。藥物警戒相關法律的相繼頒布,意味著我國對藥物警戒工作的重視程度提升,將不斷推進藥物警戒制度的建設與發展。同時,藥物警戒制度的入法,也對藥品安全監管提出了全新的挑戰。
我國藥物警戒系統的機構設置可分為行政組織和技術組織。行政組織即國家藥品監督管理局和地方藥品監督管理局,技術組織即國家藥品不良反應監測中心和34個省級藥品不良反應監測中心。目前,我國也已初步形成主動和被動相結合的監測系統, 主動監測平臺是藥品不良反應監測平臺,被動監測平臺是中國醫院藥物警戒系統(Chinese hospital pharmacovigilance system,CHPS)。藥品不良反應監測平臺分為四級,分別為國家、省、市和縣。這種層級分明、層層上報的機構設置符合我國幅員遼闊、人口眾多的國情。根據國家藥品監督管理局最新發布的《國家藥品不良反應監測年度報告(2020年)》,2020年全國ADRs監測網絡收到ADRs報告共計167.6萬份,相較于2019年的151.4萬份有較大提升[7]。截至2020年底,我國ADRs報告累計達到1687萬份。在縣級ADRs報告比例方面,相較于2019年的97.4%,2020年增加為98.3%;報告人職業中,非醫藥從業者占比從2019年的5.8%上升至2020年的6.3%,反映了我國ADRs監測工作發展良好,藥物警戒意識普及率提高。
我國在2016年成立了基于CHPS的哨點聯盟。該聯盟旨在打造一個藥品安全智能監管平臺,對真實世界的藥品安全性進行更為科學的預測和分析。CHPS 主動采集哨點醫療機構報告的ADRs,解決了以往上報模式中存在的漏報率高、信息不完整等缺點,實現了對醫療機構ADRs信息的線上生成、審核、上報、反饋和分析。目前,全國已有366家醫療機構加入了該聯盟。美國FDA和中國國家藥品監督管理局對ADRs的監測模式見表1。
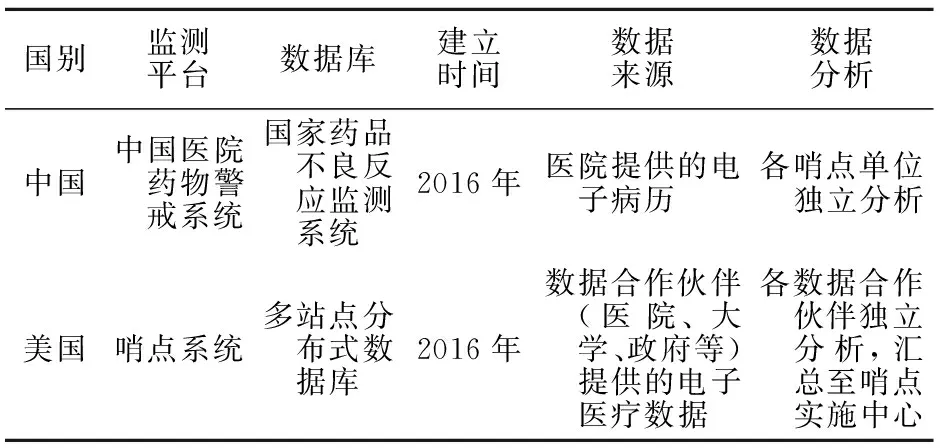
表1 美國食品藥品監督管理局和中國國家藥品監督管理局的主動監測模式比較
現階段,我國藥物警戒工作面臨的挑戰主要是三個方面:數據質量問題、數據分析能力和與國際接軌的挑戰。(1)數據質量問題:高質量的ADRs報告是對藥物安全性數據進行科學分析、獲得安全性信息并采取相應措施的重要條件。現階段,由于我國大多數藥企的藥物警戒體系建設還處于初級階段,所報告的ADRs存在專業術語不規范、信息缺失以及數據的可溯源性差等不足。(2)數據分析能力:目前,我國在藥物警戒工作中的主要著力點還集中在ADRs數據的采集,對數據的分析關注較少。國家藥品監督管理局近年來已積累了海量的ADRs數據,但在對這些大數據進行有效的數據挖掘并采取及時的藥品風險預測方面還需要進一步的提升。(3)與國際接軌的挑戰:我國的ADRs報告來源于不同的醫療機構和藥企,由于缺乏統一的信息填寫標準,影響了對多方數據的整合分析以及與外國藥物警戒系統數據的分享交流。在統一標準的前提下,獲得更多的ADRs數據是發現某種藥物罕見、嚴重ADRs的重要途徑。
3 小 結
美國的哨點系統在藥物警戒方面的成功是基于高水平的、不斷發展的數據挖掘和分析系統。因此,針對我國藥物警戒數據庫在哨點數目、上報范圍、數據來源等方面存在的問題有以下幾點建議。
3.1 擴大覆蓋面 2016年,哨點聯盟的建立彌補了我國在藥物警戒主動監測方面的缺乏,但在人口覆蓋率上還存在不足。美國哨點系統覆蓋率在2017年就已超過美國人口的一半[8]。雖然我國目前哨點聯盟所包含的醫療機構已有366家,但人口覆蓋率仍較低,不足以解決我國眾多人口中存在的用藥安全性問題。因此,未來應呼吁更多的哨點機構加入,并納入國內現有的醫療衛生數據庫來增加藥品安全信息數據量,從而提高藥品安全性監管及風險預測的準確性。
3.2 增加數據來源 FDA的經驗顯示了將多個數據源結合起來進行藥物警戒研究的巨大潛力。盡管如此,整合多個數據庫是極富挑戰性的,需要一定的專業知識。美國最近的經驗提供了如何從不同數據庫中提取、處理和存儲統一數據的范例,以及在進行多數據庫安全分析時應該采用哪種工作模式,如何解釋結果等[9]。
3.3 加強數據分析能力 目前,CHPS系統主要側重于不良事件(adverse event, AE)上報,雖大幅提高了上報率,但在數據分析方面還有所欠缺。正在開發的CHPS v2.0系統將增加數據采集和清洗、信息脫敏和上報、分析及管理等功能,有望提高數據分析能力。同時,現有的數據分析模式是各個哨點獨立進行,因此較難監測不常見的ADRs。相比之下,美國FDA能夠根據各哨點提供的ADRs信息,篩選出高度可疑的ADRs,并整合全國的科研力量專攻特定的安全問題,更加高效。因此,我國應加強各哨點之間的數據共享,建立分布式數據系統。除此之外,我國還應嘗試引入多學科交叉科研團隊,如美國哨點項目中有保險公司、高校、醫院和研究機構,鼓勵團隊將大數據和數據科學領域的最新進展應用于藥物警戒研究。
3.4 與國際接軌 2017年,醫渡云和重慶醫科大學成立了我國首個醫學大數據研究院,開啟了國內醫療領域對大數據利用的探索。在此發展方向上,對EMR進行規范化管理非常重要。2017年6月,我國國家藥品監督管理局加入了國際人用藥品注冊技術協調會(ICH)。因此,全力推進ICH各項指導原則,尤其是將EMR以E2B(R3)格式錄入數據庫,不僅是提升ADRs監測的關鍵點,也是與國際藥物警戒系統進行數據交流的前提。采取標準化EMR后,我國哨點聯盟可以借鑒美國經驗,實行分布式管理模式,各哨點單位獨立管理各自數據庫,設立國家數據管理中心再對其進行統一管理,以實現ADRs信息的高效、規范化處理。

