CaCl2的水解反應(yīng)對固態(tài)SiO2顯微特征的影響
高運(yùn)明,黃振彪,何 林,李光強(qiáng)
(武漢科技大學(xué) 鋼鐵冶金及資源利用省部共建教育部重點(diǎn)實驗室,武漢 430081)

目前熔鹽對SiO2顯微結(jié)構(gòu)影響的報道僅見于楊娟玉等[12]在1 173 K下對CaCl2熔鹽與納米SiO2顆粒壓制的電極片的相互作用的研究。他們發(fā)現(xiàn)SiO2電極片在熔鹽中浸泡30 min后相組成和化學(xué)組成均沒有改變,但在納米尺寸效應(yīng)和熔鹽的助熔作用下,結(jié)構(gòu)和形貌變化很大,電極片由納米顆粒組成的燒結(jié)多孔體轉(zhuǎn)變?yōu)楸舜讼噙B的網(wǎng)狀多孔體。外加電壓促使熔融或者半熔融SiO2表面先電解形成Si核,然后Si核再與熔鹽以及熔融或者半熔融SiO2形成新的3PI;隨著熔融或者半熔融SiO2不斷還原,Si核進(jìn)一步長大并形成Si納米線。
CaCl2熔鹽因具有電導(dǎo)率高、穩(wěn)定性好、價格低、綠色環(huán)保等優(yōu)點(diǎn)而成為電解固態(tài)SiO2制備Si的研究中最常用的介質(zhì)[2-15]。但CaCl2鹽在空氣中極易吸收水分而潮解,為避免水分對電解行為的干擾,在CaCl2鹽升溫或熔化過程中往往需要嚴(yán)格的脫水操作,這無疑增加了處理成本;另一方面,目前關(guān)于CaCl2鹽水解反應(yīng)的認(rèn)識很有限[16-17],導(dǎo)致在升溫或熔化過程中的脫水操作實際上并不統(tǒng)一[4,8-12,18]。筆者擬研究微米級SiO2壓制的圓柱樣與脫水不完全的CaCl2熔鹽的相互作用,利用SEM-EDS及X射線衍射(XRD)等手段,結(jié)合有關(guān)熱力學(xué)理論分析,考察水解反應(yīng)下SiO2圓柱樣顯微特征的變化及其原因,為后續(xù)研究中指導(dǎo)CaCl2鹽脫水處理以及調(diào)控電解產(chǎn)物Si的形貌、結(jié)構(gòu)提供參考。
1 實 驗

將浸泡后的圓柱樣放入超聲波清洗儀中,用蒸餾水清洗30 min,圓柱樣保持完整;然后再將其放置于真空干燥箱中373 K烘干。按圖1(a)分離烘干后的圓柱樣,噴金處理后利用SEM-EDS顯微表征圓柱樣外表面以及靠近鉬絲部位、斷面中心和邊部等部位(觀察取樣位置如圖1(b)所示)。由于浸泡后的圓柱樣質(zhì)量較小,未進(jìn)行XRD等其他檢測。為了對比,對SiO2原料粉末以及燒結(jié)后的SiO2圓柱體進(jìn)行SEM-EDS形貌觀察、成分分析以及XRD物相檢測;對CaCl2原料也進(jìn)行了XRD檢測。
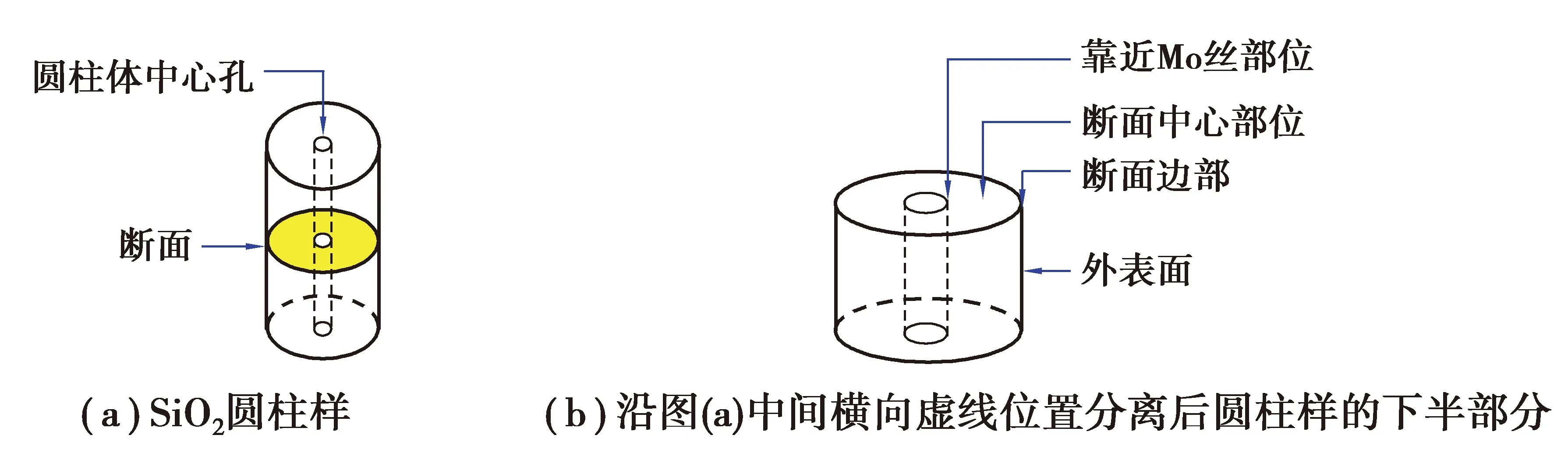
圖1 SiO2圓柱樣在熔鹽中浸泡后取樣位置示意圖Fig. 1 Diagram of the sampling position of the SiO2 cylinder after immersion in the melt
2 結(jié)果與討論
2.1 原料物相及燒結(jié)后的顯微特征

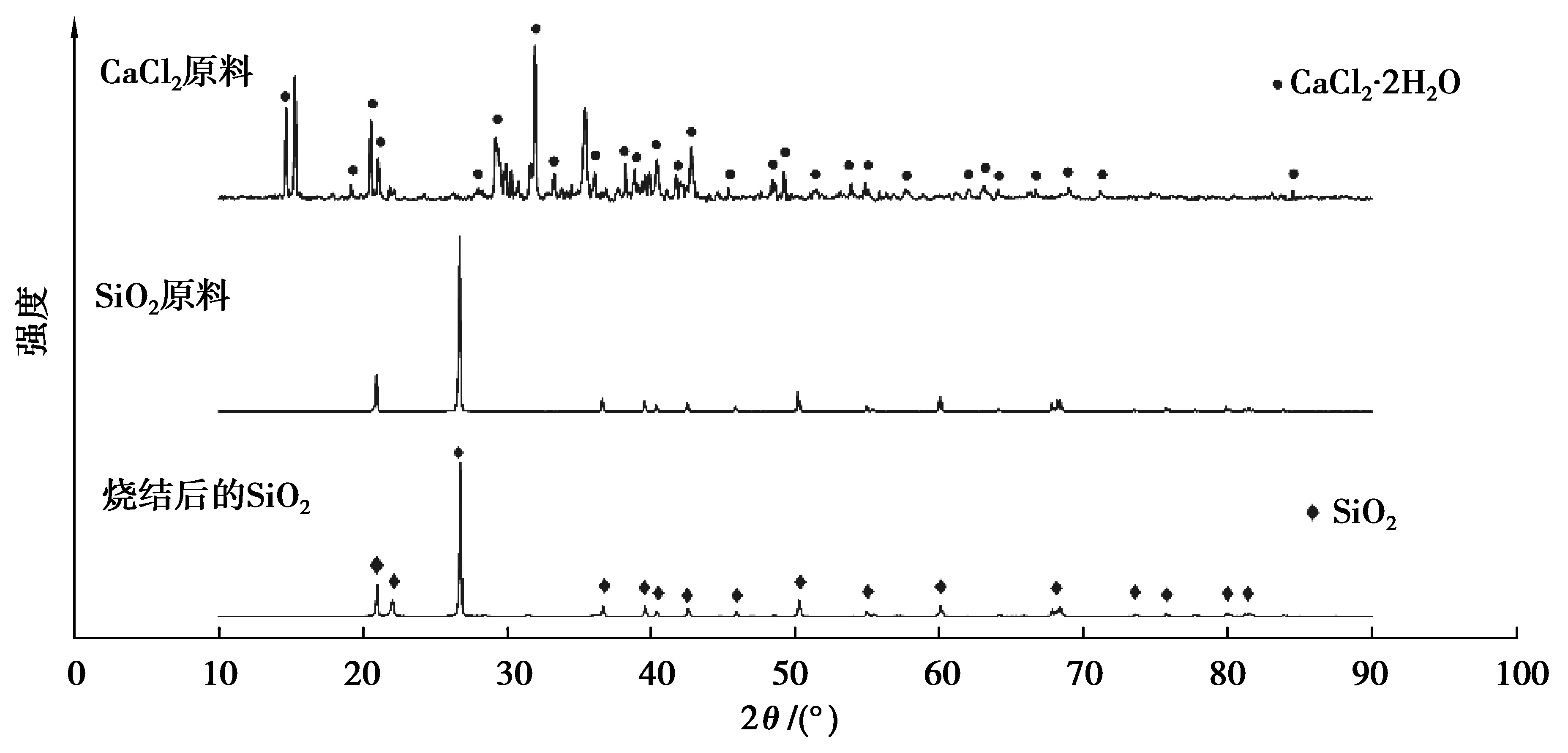
圖2 CaCl2和SiO2原料及燒結(jié)后SiO2的XRD圖譜Fig. 2 XRD patterns of CaCl2 and SiO2 raw materials and SiO2 cylinder after sintering
圖3為SiO2燒結(jié)前后的SEM形貌及其放大圖。SiO2原料(圖3(a))粉末比較松散,顆粒尺寸大小不一,一般在5~50 μm之間;壓制和高溫?zé)Y(jié)后顆粒變得緊密,小顆粒變多,且容易附著在大顆粒表面(圖3b),表明SiO2原料在壓制和燒結(jié)后有些大顆粒已碎裂變小。由于顆粒存在輕微軟熔現(xiàn)象,彼此甚至輕微粘連在一起(圖3c),但顆粒仍能保持各自的形狀。另外,SiO2燒結(jié)前后經(jīng)EDS檢測,成分沒有任何變化。

圖3 SiO2的SEM圖Fig. 3 SEM images of SiO2
2.2 浸泡后的顯微特征
2.2.1 浸泡1 h


圖4 SiO2圓柱樣在熔鹽中浸泡1 h后的SEM圖Fig. 4 SEM images of SiO2 cylinder after immersion in the melt for 1 h

表1 圖4中SiO2圓柱體有關(guān)位置點(diǎn)的EDS成分分析

續(xù)表1
在靠近鉬絲部位(圖4(b)和4(e)),雖總體上仍保持顆粒狀態(tài),但相比于燒結(jié)樣(圖3(b)和3(c)),形貌有少許變化,一些大顆粒表面鑲嵌有很多半圓珠狀的小顆粒(圖4(e))。經(jīng)EDS分析(表1),小半圓珠狀物質(zhì)組成主要包含Si、O以及極少量Ca元素,Ca的存在表明熔鹽已開始沿鉬絲與圓柱樣中心之間的空隙滲透進(jìn)來。因CaO已在圓柱體表層參與反應(yīng),隨熔鹽滲透進(jìn)來的CaO濃度很低。結(jié)合SiO2-CaO相圖[19]判斷,小半圓珠應(yīng)為SiO2及反應(yīng)生成的很少量CS組成。表面光滑的大顆粒仍為SiO2相,基本不含CS。可以推測,浸泡時附著在大顆粒表面上已經(jīng)輕微軟熔的小顆粒SiO2,在熔鹽助熔作用下,顆粒棱角進(jìn)一步軟熔或SiO2直接微量溶解[20];同時在熔鹽中少量CaO作用下,小顆粒表面SiO2因生成少量CS而溶解,二者共同作用導(dǎo)致SiO2小顆粒的不規(guī)則棱角以及微小顆粒的溶解、消失。由于小顆粒處于溶解有SiO2和CS的熔鹽環(huán)境中,當(dāng)溫度下降時,熔鹽中SiO2和CS可在凝固的軟熔小顆粒SiO2表面飽和析出,形成小半圓珠,并幾乎半鑲嵌在大顆粒表面。上述物理化學(xué)作用導(dǎo)致靠近鉬絲部位的SiO2小顆粒形貌發(fā)生小許變化,但成分變化不大。在外力作用下,有少數(shù)半圓珠脫落,在大顆粒表面還留下相應(yīng)的凹坑痕跡(圖4(e))。
在SiO2圓柱樣斷面中心部位(圖4(c)和4(f)),仍基本維持燒結(jié)后的顆粒形貌。因滲透進(jìn)入的CaCl2熔鹽量更少,上述小顆粒圓珠化的傾向雖然少量存在(表1),但形貌變化不及靠近鉬絲部位明顯。
2.2.2 浸泡2 h



圖5 SiO2圓柱樣在熔鹽中浸泡2 h后的SEM圖Fig. 5 SEM images of SiO2 cylinder after immersion in the melt for 2 h

表2 圖5中SiO2圓柱體有關(guān)位置點(diǎn)的EDS成分分析
圓柱樣靠近鉬絲(圖5(e)和5(f))以及斷面中心部位(圖5(g)和5(h))的顆粒形貌也有明顯變化。雖然大部分仍是SiO2顆粒,但由于浸泡時間較長,有較多熔鹽滲入,導(dǎo)致局部形態(tài)和組成已開始變化。如靠近鉬絲的位置點(diǎn)(圖5(f)點(diǎn)1)已生成了新相CS,斷面中心部位已有位置點(diǎn)(圖5(h)點(diǎn)1和3)少量片狀化,存在CS相以及清洗后殘留的CaCl2(參見表2);另外,小顆粒也存在小半圓珠化,并且附著或鑲嵌在大顆粒表面。
可見,浸泡2 h后的圓柱樣表面進(jìn)一步形成C2S相,并富集有過量CaO,導(dǎo)致形貌和結(jié)構(gòu)變化更大;而內(nèi)部(靠近鉬絲部位及斷面中心)因熔鹽滲透較少,CaO含量較低,顆粒形貌變化相對較小,僅局部有CS相生成。但相比浸泡1 h,圓柱樣內(nèi)部變化更明顯。
2.3 討論
2.3.1 硅酸鹽形成的熱力學(xué)分析


表3 1 173 K溫度下與生成硅酸鹽有關(guān)的熱力學(xué)數(shù)據(jù)
在非標(biāo)準(zhǔn)態(tài)下,利用式(1),可計算生成各硅酸鹽時的CaO平衡活度。溶解在CaCl2熔鹽中的CaO活度以純固態(tài)CaO為標(biāo)準(zhǔn)態(tài);假設(shè)SiO2及各種硅酸鹽不溶于熔鹽,或即使它們在熔鹽中有少許溶解,其濃度也能達(dá)到飽和,選擇它們各自的純固態(tài)物質(zhì)為標(biāo)準(zhǔn)態(tài)時,其活度均為1。

(1)

aCaO=γCaOxCaO。
(2)
文獻(xiàn)中關(guān)于CaO在CaCl2熔鹽中達(dá)到飽和(1 173 K時其飽和濃度達(dá)20 mol%)時的γCaO有2個類似公式:
RTlnγCaO=8 669+6.146T[21],
(3)
RTlnγCaO=6 961+5.06T[22]。
(4)
當(dāng)T=1 173 K時,式(3)和(4)計算的γCaO值分別為5.1和3.8,二者差別不大,均表明CaCl2-CaO熔體相對理想溶液呈現(xiàn)明顯的正偏差。假設(shè)γCaO與xCaO無關(guān),將CaO飽和時的γCaO值代入式(2)可得到對應(yīng)的xCaO,并進(jìn)一步轉(zhuǎn)換成wCaO,結(jié)果見表3。
可見在CaCl2熔鹽中生成各硅酸鹽所對應(yīng)的CaO平衡活度很低,生成CS時對應(yīng)的CaO活度最小,僅1.2×10-4(對應(yīng)的質(zhì)量分?jǐn)?shù)平均為0.001 4%),生成C2S時的CaO活度較大,也僅為1.0×10-3(對應(yīng)的質(zhì)量分?jǐn)?shù)平均為0.012%)。
參加反應(yīng)的CaO只能來源于CaCl2鹽的水解反應(yīng)(稍后分析),并且很容易達(dá)到形成各硅酸鹽所需的活度。圓柱體外表面同時存在多種硅酸鹽,可能與外表面局部CaO活度不均勻以及硅酸鹽逐級形成有關(guān),另外也存在外表層局部脫落和冷卻過程中C2S與SiO2進(jìn)一步反應(yīng)轉(zhuǎn)變?yōu)镃S的可能(表3)。這些熱力學(xué)分析與上述浸泡實驗觀察結(jié)果基本一致。
2.3.2 硅酸鹽理論分解電壓計算


表4 在1 173 K標(biāo)準(zhǔn)態(tài)下體系內(nèi)相關(guān)反應(yīng)的ΔG和組元的E

(5)

可見相比于固態(tài)SiO2,硅酸鹽電解制備Si的分解電壓都增大了,其中CS的分解電壓增大約0.2 V,而其他硅酸鹽分解電壓增大約0.3 V,顯示SiO2轉(zhuǎn)變?yōu)楣杷猁}后電解變得困難。為此,在外加大電壓電解條件下,不僅使硅鈣合金或鈣金屬也可能被還原出來,污染產(chǎn)物硅[4-5,9,15,23],而且也影響到產(chǎn)物硅的形貌和長大[9,20]。因此,在采用FFC工藝制備硅的過程中,應(yīng)盡量避免各種固態(tài)硅酸鹽生成,以降低CaCl2熔鹽中固態(tài)SiO2全部還原的難度。
2.3.3 CaCl2鹽的水解反應(yīng)
室溫下CaCl2因暴露在空氣中不可避免含有一定量的自由水和結(jié)晶水,自由水通過蒸發(fā)可有效脫除,而結(jié)晶水(參見圖2)需先高溫分解、然后蒸發(fā)脫除。考慮動力學(xué)因素,升溫過程中含水CaCl2完全脫水較為困難。一般認(rèn)為在升溫過程或在熔融狀態(tài)下CaCl2鹽與H2O有2種生成CaO的水解反應(yīng)機(jī)理[16]。
第1種:
CaCl2+ H2O = CaO + 2HCl(g)。
(6)
第2種:
CaCl2+ 2H2O = Ca(OH)2+ 2HCl(g),
(7)
Ca(OH)2= CaO + H2O。
(8)
從熱力學(xué)上看,第2種機(jī)理中反應(yīng)式(7)(8)疊加,即轉(zhuǎn)化為第1種機(jī)理反應(yīng)式(6),因此這里主要從熱力學(xué)上分析實驗過程中第1種水解反應(yīng)。

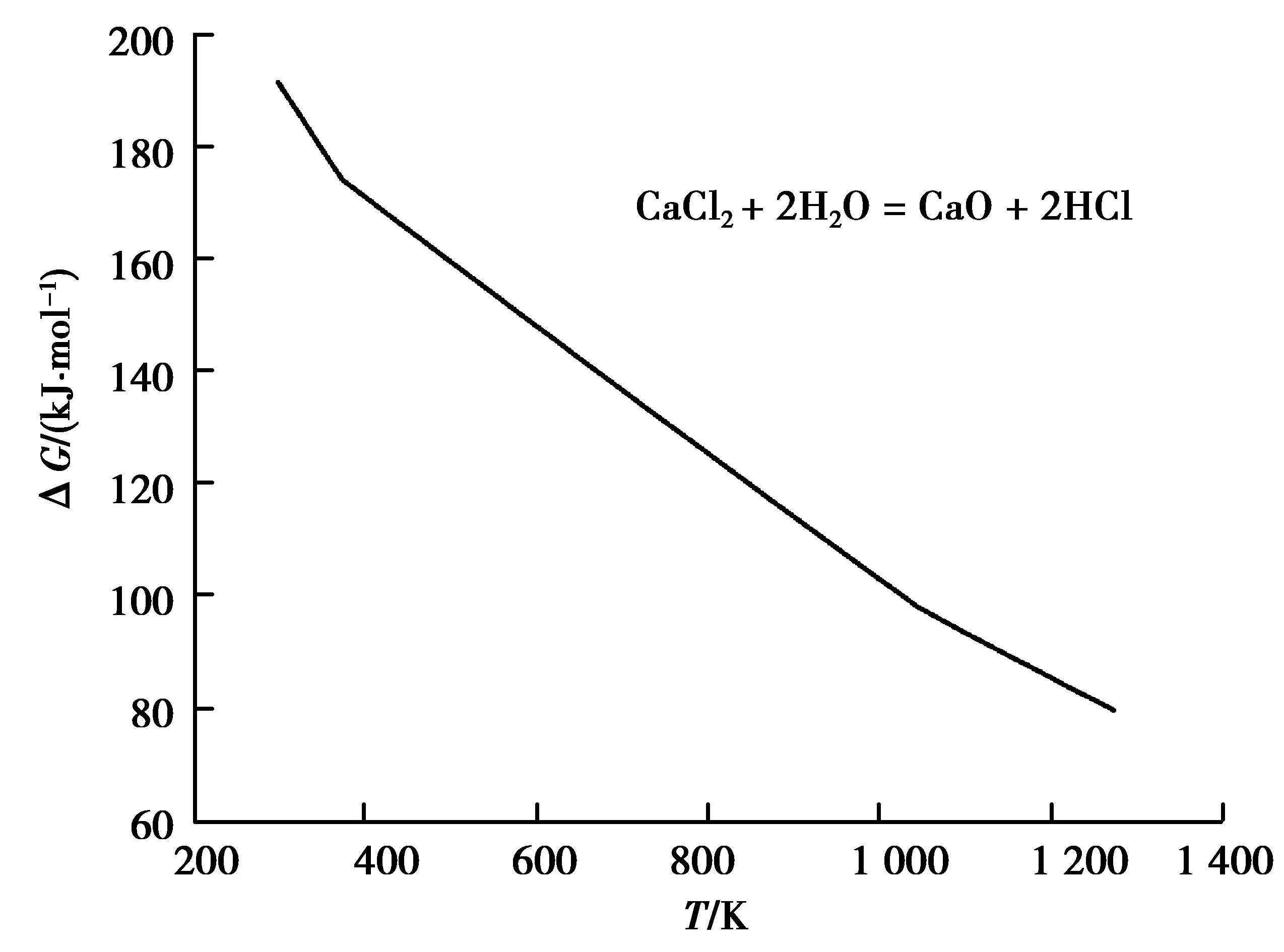
圖6 反應(yīng)(6)的ΔGθ-T的關(guān)系Fig. 6 Relationship between ΔG0 and T of the reaction (6)
利用式(9)可進(jìn)一步獲得反應(yīng)(6)在不同溫度、非標(biāo)準(zhǔn)態(tài)下的H2O與HCl的平衡分壓(即pH2O和pHCl)的對應(yīng)關(guān)系,這里選取473, 773, 973, 1 173 K等4個溫度下比較,如圖7。在前3個溫度下CaCl2和CaO均為固態(tài)(此時CaCl2和CaO的活度為1),在溫度1 173 K為熔體狀態(tài)(假設(shè)CaCl2和溶解的CaO活度均為1)。

圖7 反應(yīng)(6)的pH2O與pHCl的平衡關(guān)系Fig. 7 Equilibrium relationship between pH2O and pHCl of the reaction (6)

(9)

從圖7中可知,溫度越低,平衡線上相同的pH2O對應(yīng)的pHCl也越低。平衡線以下區(qū)域為水解區(qū)(即CaO生成區(qū))。在某溫度下脫水過程中,固態(tài)CaCl2鹽表層初始水蒸氣分壓往往較大甚至飽和,當(dāng)HCl的分壓很低(例如初始?xì)夥?時,水解反應(yīng)(6)即可正向進(jìn)行,并可達(dá)到平衡。平衡線以上區(qū)域為H2O穩(wěn)定區(qū),此時可采取抽真空或在流動氣氛下降低水蒸氣分壓脫水。但由于水解反應(yīng)(6)中1 mol的H2O蒸氣可生成2 mol的HCl氣體,抽真空或在流動氣氛操作會導(dǎo)致水解平衡反應(yīng)向正方向(即生成CaO方向)移動。又由于反應(yīng)(6)為吸熱反應(yīng)(FactSage熱力學(xué)軟件數(shù)據(jù)),溫度越高,其正向進(jìn)行程度(平衡常數(shù))越大,特別是在高溫熔體狀態(tài)CaO活度遠(yuǎn)小于1的條件下更容易水解生成CaO。考慮動力學(xué)因素,低溫下的水解反應(yīng)即使能進(jìn)行也將很緩慢,在相對低溫下不抽真空或采取抽真空或流動氣氛的脫水操作是合理的[4,8-12,18,26]。高溫熔體預(yù)電解雖可繼續(xù)脫除殘余水分[9,12,15,20-21,26](參見表4),但在預(yù)電解之前CaCl2可能已經(jīng)水解,并生成了CaO;當(dāng)然,預(yù)電解對脫除熔鹽中其他雜質(zhì)仍有利。因此,在低溫下充分脫水對于抑制水解反應(yīng)、控制CaO的生成更重要。
由于水分是從表面到內(nèi)層逐步脫除的,鑒于CaCl2在約517 K后才失去全部結(jié)晶水[25],為嚴(yán)格控制CaCl2鹽高溫水解產(chǎn)生CaO,建議加強(qiáng)CaCl2原料在573 K以下的低溫長時間保溫或緩慢升溫的脫水操作。
本實驗中盡管在473 K的干燥箱內(nèi)對CaCl2鹽進(jìn)行了低溫真空(真空度小于133 Pa)脫水操作,但轉(zhuǎn)移到高溫爐的過程又暴露在空氣中,且實驗中并沒有特意在高溫爐內(nèi)氬氣(僅用硅膠干燥)流動氣氛下再次進(jìn)行長時間低溫保溫或緩慢升溫的脫水操作,導(dǎo)致CaCl2鹽脫水不完全,高溫水解生成了CaO,并溶于CaCl2熔鹽,CaO擴(kuò)散至SiO2圓柱體表面發(fā)生反應(yīng),并伴隨熔鹽滲透擴(kuò)散,在圓柱體表面和內(nèi)部分別與SiO2形成了各種硅酸鹽。上述熱力學(xué)計算已經(jīng)表明,在圓柱體外表面由于CaO的活度(濃度)大,容易生成高鈣硅酸鹽,如C3S2或C2S;在內(nèi)部由于CaO的活度(濃度)小,則可能生成低鈣硅酸鹽,如CS。對于僅內(nèi)置陰極集流體的SiO2圓柱體在外加電壓時,依據(jù)3PI還原理論[14-15],外表面形成的硅酸鹽層只能在最后階段還原,硅酸鹽層的持續(xù)存在可在一定程度上阻礙CaCl2熔鹽向圓柱體內(nèi)部的擴(kuò)散和3PI的形成,同時也降低內(nèi)部SiO2還原產(chǎn)生的O2-向外傳遞的速度,最終使SiO2圓柱體陰極還原速度減慢、還原難度增加。
3 結(jié) 論
1)在1 173 K的CaCl2熔鹽中浸泡不同時間后,SiO2圓柱樣外表面形貌、組成、結(jié)構(gòu)變化較大,內(nèi)部形貌變化較小。形貌、結(jié)構(gòu)發(fā)生變化的主要原因是SiO2與熔鹽中溶解的CaO作用,逐級生成多種硅酸鹽。外表面CaO濃度高,可生成C2S或C3S2;內(nèi)部則可能生成CS,也會受到滲透熔鹽的輕微助熔作用。
2)熱力學(xué)計算表明,SiO2圓柱樣在CaCl2熔鹽中生成硅酸鹽所需CaO的活度很低。生成CS時CaO的活度僅為1.2×10-4;生成C2S時CaO的活度也僅為1.0×10-3。SiO2轉(zhuǎn)變?yōu)楣杷猁}后,理論分解電壓增大,電解還原難度增加,還原速度也減慢。
3)在CaCl2熔鹽中生成各種硅酸鹽所需的CaO來自鹽的水解反應(yīng)。溫度越高,水解反應(yīng)越容易進(jìn)行。為嚴(yán)格控制CaCl2鹽中的CaO含量,宜加強(qiáng)CaCl2原料在低溫(一般在573 K以下)下不抽真空或在真空或干燥流動氣氛下長時間保溫或緩慢升溫的脫水操作。

