肺動脈順應性在急性呼吸窘迫綜合征中的價值
孟 超,范志強,佟 慶,朱桂軍,朱 輝
(1.河北省秦皇島市第一醫院 內科ICU,河北 秦皇島,066000;2.河北醫科大學第四醫院 重癥醫學科,河北 石家莊,050010)
急性呼吸窘迫綜合征(ARDS)是一種呈肺容積減少、肺順應性降低等生理特征的疾病,病因復雜,治療難度較大,病死率高,嚴重危害人們生活質量和身心健康[1-2]。ARDS患者不僅存在肺泡病變,也存在肺循環異常,其中以肺動脈高壓為基本特征之一,嚴重者可導致右心衰竭[3]。正壓機械通氣雖為ARDS目前主要治療手段之一,但治療過程中易增加肺循環阻力,進而引起急性肺動脈高壓,甚至造成右心衰竭[4]。目前,臨床評價右心功能方法尚不完備,因此探討評估右心功能的可靠指標對ARDS患者臨床診治大有裨益。研究[5]顯示,肺動脈順應性是反映肺循環狀態的重要指標,而肺血管結構和機能狀態是決定左心前負荷和右心后負荷的主要因素,故其還可反映大小動脈血管結構和機能狀態。此外,ARDS患者右室功能障礙與預后關系密切,右心衰竭還可對預后造成不利影響,但關于三者在ARDS中的相互關系尚不明確[6]。基于此,本研究以肺動脈順應性作為主要檢查指標,探究其與ARDS患者右心功能及短期預后間的關系,現報告如下。
1 資料與方法
1.1 一般資料
選取2017年6月—2019年6月收治的135例ARDS患者作為觀察組,其中男76例,女59例,平均年齡(58.31±8.24)歲,根據30 d預后情況分為死亡組89例、生存組46例。選取同期健康體檢者46例為對照組,其中男25例,女21例,平均年齡(56.16±6.87)歲。納入標準:① 患者均符合中華醫學會呼吸學會制定的ARDS診斷標準[7];② 年齡≥18歲者;③ 急性起病,明確診斷ARDS時間<24 h,氧合指數[pa(O2)/FiO2]≤200 mmHg者,胸部X攝片為雙肺斑片狀陰影,肺動脈嵌頓壓<18 mmHg者。排除標準:① 臨床資料不全者;② 合并嚴重心、肺、肝、腎功能不全者;③ 妊娠期、腫瘤終末期、自身免疫性疾病者。所有受試者知情同意并簽訂知情同意書。
1.2 方法
肺動脈順應性相關指標檢測:所有入組患者檢查前均給予純氧吸入30 min,并完成動脈血氣檢查,包括酸堿度(pH值)、平均動脈壓(MAP)、動脈血二氧化碳分壓[pa(CO2)]、動脈血氧分壓[pa(O2)]、pa(O2)/FiO2,然后在ARDS患者確診24 h內進行超聲檢查,檢查前保證患者充分鎮靜,采用GE Vivid 7彩色多普勒超聲診斷儀,頻率1.7~3.4 MHz,自然組織諧波功能。二維超聲測量房間隔缺損最大徑(DL)及最小徑(DS),并計算房間隔缺損面積指數(ASD-AI)=(DL/2)×(DS/2)×π/體面積(BSA);多普勒超聲測量房間隔跨缺損最大分流速度,依據公式將ASD-AI化為肺動脈順應性指數(PACI)=分流壓差(PGASD)/ASD-AI。測定肱動脈壓為體循環壓(Ps),得肺動脈收縮壓(PASP)(mmHg)=Ps-PGASD。
右心功能檢測:采用西門子3.0T Verio超導型磁共振掃描儀、32通道心臟相控陣線圈及呼吸門控、心電門控。應用心臟電影成像序列,右心室二腔心、四腔心及短軸位電影CMR圖像則采用二維快速穩態進動采集序列。掃描右心室基底段至心尖段在內的心室短軸、長軸以及四腔心層面。掃描結束后將MRI數據傳入后處理工作站(Argus,Syngo;西門子公司),載入全部基底段至心尖段心室短軸電影圖像,選取心室舒張/收縮末期圖像,手動描繪右心室舒張/收縮末期所有圖像的心內/外膜,記錄右心室射血分數(RVEF)、心室舒張末期容積(RVEDV)、心室收縮末期容積(RVESV)和每搏輸出量(RVSV)等心功能指標。
1.3 統計學分析
2 結 果
2.1 觀察組和對照組患者肺動脈順應性、右心功能及一般資料比較
2組患者年齡、性別、pH值、RVSV水平比較,差異無統計學意義(P>0.05);觀察組患者PASP、ASD-AI、RVEDV、pa(CO2)水平均高于對照組,差異有統計學意義(P<0.05),PACI、RVEF、RVESV、MAP、pa(O2)、pa(O2)/FiO2水平均低于對照組,差異有統計學意義(P<0.05)。見表1。
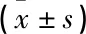
表1 觀察組和對照組肺動脈順應性、右心功能及一般資料比較
2.2 ARDS患者肺動脈順應性與右心功能相關性分析
ARDS患者PACI與右心功能指標RVEF、RVESV及pa(O2)/FiO2呈正相關(r=0.510、0.612、0.524,P<0.05);PACI與RVEDV呈負相關(r=-0.547,P<0.05)。見表2。

表2 ARDS患者肺動脈順應性與右心功能
2.3 不同近期預后情況ARDS患者PASP、ASD-AI、PACI水平比較
根據ARDS患者近期預后結果進行分組,死亡組患者PASP、ASD-AI水平高于生存組,PACI、pa(O2)/FiO2水平低于生存組,差異有統計學意義(P<0.05)。見表3。
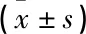
表3 不同近期預后結果ARDS患者PASP、ASD-AI、PACI水平比較
2.4 PACI對ARDS患者近期預后的診斷價值
ROC曲線結果顯示,肺動脈順應性對ARDS患者短期預后診斷的曲線下面積(AUC)為0.844,敏感性為70.8%,特異性為80.4%,95%可信區間(CI)為0.776~0.913,見圖1。

3 討 論
臨床研究[8]認為,肺泡上皮、肺毛細血管內皮通透性異常增加是引起ARDS基本病理生理改變的主要原因,同時存在肺泡水腫或塌陷,造成通氣與血流比例嚴重失調,尤以肺內分流異常增加最為顯著,最終可引起嚴重低氧血癥。ARDS對肺循環也會造成不利影響,肺血管痙攣和肺微小血栓形成引發肺動脈高壓,并進一步導致急性肺源性心臟病(ACP)[9]。隨著對ARDS病理生理研究的深入,機械通氣策略不斷改進,病死率有所控制但仍居高不下[10-11]。研究[12]顯示,初期檢測的pa(O2)/FiO2尚不可作為判斷ARDS預后的關鍵指標,故尋找能對ARDS預后進行判斷的指標尤為重要。
肺動脈順應性是影響室間隔缺損合并肺動脈高壓的重要環節。正常情況下,肺循環是一個低阻力、低壓力、高容量的系統,肺血管中血流量增加時則其被動擴張,以保持壓力不變,而增加至正常值3倍以上時,則肺血管進行主動調節[13]。研究[14]顯示,內皮依賴的縮血管反應增強及舒張反應減弱是導致血管張力增高的主要原因,進而發生的肺血管重構與肺動脈順應性下降又進一步促進肺動脈阻力增高。肺動脈順應性與肺動脈高壓的關系已有較多研究,肺動脈高壓即為ARDS患者的突出病理生理改變,因此探究肺動脈順應性在ARDS中的作用具有意義[15]。正常情況下,人心臟左右室收縮是同步的,左室壓力高于右室壓力[16]。ARDS患者由于本身病變及高呼吸末正壓急性同期,導致右心后負荷急劇增加及收縮延遲,進而使收縮末期跨室間隔壓力梯度逆轉,如超聲心動圖顯示室間隔變平甚至凸向左室[17]。研究[18]證實,經3 d機械通氣后,ARDS患者出現急性右心室擴張。以往為保持ARDS患者血碳酸正常,應用大潮氣量(13 mL/kg)導致ACP發生率升高,相應病死率也有所上升[19]。而應用小潮氣量可限制肺拉伸,不僅能顯著降低患者病死率,還可保護右心功能[20]。因此,臨床治療中應注意保護ARDS患者的右心功能,以改善預后。本研究對ARSD患者PACI變化進行觀察分析,結果顯示,ARDS患者PASP、ASD-AI、RVEDV、pa(CO2)水平均顯著高于對照組,PACI、RVEF、RVESV、MAP、pa(O2)、pa(O2)/FiO2水平均顯著低于對照組,提示ARDS患者肺動脈順應性下降,影響收縮壓恢復,而且房間隔缺損也影響左向右分流量,兩者呈正相關,進而導致右心系統容量負荷明顯增加,進一步加重ARDS病變。PACI與右心功能相關性分析結果顯示,ARDS患者PACI與右心功能指標RVEF、RVESV及pa(O2)/FiO2呈正相關,與RVEDV呈負相關,提示肺動脈順應性與右心功能相關,肺動脈順應性與右心功能正相關。此外,本研究結果還顯示,生存組患者PASP、ASD-AI水平顯著低于死亡組,PACI水平顯著高于死亡組,可見預后較好患者的肺動脈高壓進程相對較慢,提示可通過檢測上述3項指標來預測患者的預后情況。ROC結果顯示,PACI對ARDS患者短期預后的診斷的AUC為0.844,敏感度為70.8%,特異性為80.4%,95%CI為0.776~0.913,提示PACI能夠較好判斷ARDS患者預后,可作為ARDS潛在預后判斷指標。
綜上所述,ARDS患者PACI降低,右心功能下降,兩者有一定相關性,且PACI能夠較好判斷ARDS患者短期預后情況。但本研究樣本量較小,納入對象僅限本地區,且未結合患者右心功能恢復情況,研究結果存在局限性,后續研究將不斷完善,并深入探討可判斷患者遠期預后的可靠指標。

