糖尿病視網膜病變患者血清因子表達情況及其與病變分期的關系
胡 歡,周玉玲,張 勇,咼 明
(1.湖北科技學院附屬浠水醫院 眼科,湖北 黃崗,438200;2.鄂東醫療集團黃石市中心醫院/湖北理工學院附屬醫院 眼科,湖北 黃石,435000;3.湖北省荊州市中心醫院,湖北 荊州,434000)
糖尿病作為代謝性疾病之一,其臨床特點主要為慢性高血糖、合并胰島素分泌或(和)作用異常導致蛋白質、脂肪代謝紊亂。糖尿病視網膜病變(DR)為糖尿病患者常見的一種微血管并發癥,中國是DR患病人數最多的國家之一,糖尿病患者的DR發生率高達43.1%[1],DR防治工作任重道遠。腦源性神經營養因子(BDNF)屬于神經營養素家族,其在神經系統發育中能加速神經元分化、生長[2]。細胞外超氧化物歧化酶(ec-SOD)是細胞外超氧化物的主要酶清除劑,其與氧化應激所致的血管疾病密切相關[3]。血管生成素(Ang)是一組分泌型細胞因子,包括Ang-1、Ang-2、Ang-3和Ang-4[4]。目前,DR的具體發生機制尚未完全闡明,涉及細胞凋亡、非特異度炎癥、氧化應激等多種病理生理過程[5]。近年來,隨著細胞分子生物學研究的不斷深入,細胞因子在DR發病過程中所發揮的作用逐漸受到廣泛關注,但關于血清ecSOD、BDNF、Ang-2與DR相關性的研究尚較少。本研究探討了血清ecSOD、BDNF、Ang-2在DR患者中的表達情況及其與DR分期的關系,旨在為DR的預防和診治提供參考依據,現報告如下。
1 資料與方法
1.1 一般資料
選取2019年1—12月湖北科技學院附屬浠水醫院眼科收治的126例糖尿病患者作為研究對象。納入標準:① 2型糖尿病患者,診斷符合《我國糖尿病視網膜病變臨床診療指南(2014年)》[6]中的相關診斷標準,眼底檢查發現視網膜有滲出、出血、微血管瘤、新生血管者;② 對本研究知情且簽署知情同意書者。排除標準:① 1型糖尿病、妊娠糖尿病等除2型糖尿病之外的其他糖尿病患者;② 合并慢性或急性感染、肝腎功能障礙、血液系統疾病及急性糖尿病并發癥者;③ 伴有高血壓視網膜病變、視網膜分支靜脈阻塞等視網膜出血所引起的眼底病者。根據免散瞳眼底照相檢查結果及中華醫學會糖尿病性視網膜病變分期標準將糖尿病患者分為無糖尿病視網膜病變(NDR)組40例、單純型糖尿病視網膜病變(BDR)組44例、增殖型糖尿病視網膜病變(PDR)組42例。另選取同期健康體檢者40名納入對照組,體檢者空腹糖耐量均未見異常,且無其他眼部病史,無糖尿病家族病史。4組受檢者性別、年齡、糖尿病病程、體質量指數(BMI)、冠心病、高血壓和高血脂情況比較,差異均無統計學意義(P>0.05),具有可比性,見表1。本研究經醫院倫理委員會審核批準。
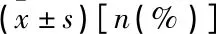
表1 4組一般資料比較
1.2 方法
抽取所有受檢者清晨空腹狀態下肘靜脈血約6 mL,以3 000轉/min速率離心10 min,吸取上清液置于Effendof管,并于-80 ℃保存待檢。采用全自動生化分析儀(西門子ADVIA)檢測空腹血糖(FBG)、糖化血紅蛋白(HbA1c)水平。采用酶聯免疫吸附法檢測血清ecSOD、BDNF、Ang-2水平,ecSOD試劑盒購于上海雙贏生物科技有限公司(貨號SY-10028,批號2019S122),BDNF試劑盒購于美國Promega公司(貨號ac32337,批號GR52423-1),Ang-2試劑盒購于深圳晶美生物工程有限公司(貨號YM-S0028,批號20190332),所有操作均按試劑盒說明書嚴格執行。DR患者入院后均接受積極治療。
1.3 觀察指標
比較4組受檢者一般資料和血清ecSOD、BDNF、Ang-2、FBG、HbA1c水平。分析血清ecSOD、BDNF、Ang-2與DR分期的關系。采用受試者工作特征(ROC)曲線評估血清ecSOD、BDNF、Ang-2單獨及聯合檢測對DR的診斷價值。
1.4 統計學分析

2 結 果
2.1 4組FBG、HbA1c水平比較
NDR組、BDR組、PDR組的FBG、HbA1c水平均高于對照組,差異有統計學意義(P<0.05);NDR組、BDR組、PDR組的FBG、HbA1c水平組間比較,差異無統計學意義(P>0.05)。見表2。
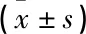
表2 4組FBG、HbA1c水平比較
2.2 4組血清ecSOD、BDNF及Ang-2水平比較
NDR組、BDR組、PDR組的血清ecSOD、BDNF、Ang-2水平高于對照組,BDR組、PDR組的血清ecSOD、BDNF、Ang-2水平高于NDR組,PDR組的血清ecSOD、BDNF、Ang-2水平高于BDR組,差異有統計學意義(P<0.05)。見表3。
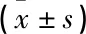
表3 4組血清ecSOD、BDNF、Ang-2水平比較
2.3 DR分期與血清ecSOD、BDNF、Ang-2水平的相關性分析
Spearman相關性分析發現,DR分期與血清ecSOD、BDNF、Ang-2水平均呈正相關(P<0.05)。見表4、圖1。

表4 DR分期與血清ecSOD、BDNF、Ang-2水平相關性分析

2.4 血清ecSOD、BDNF、Ang-2對DR的診斷價值
ROC曲線評估結果顯示,ecSOD診斷DR的AUC為0.836,截斷值為113.43 ng/mL,敏感度、特異度分別為73.02%、95.00%;BDNF診斷DR的AUC為0.774,截斷值為1.66ng/mL,敏感度、特異度分別為71.25%、94.55%;Ang-2診斷DR的AUC為0.862,截斷值為1.69 μg/L,敏感度、特異度分別為80.16%、90.00%;聯合檢測診斷DR的AUC為0.904,敏感度、特異度分別為91.27%、98.03%。見表5、圖2。

表5 血清ecSOD、BDNF、Ang-2單獨或聯合檢測對DR的診斷價值

3 討 論
微血管病變是糖尿病患者常見的慢性并發癥之一,常累及腎臟及視網膜微血管,其中以DR和糖尿病腎病較為常見。臨床調查[7]結果顯示,2010年DR患病人數高達1.26億,而到2030年將升高至1.92億。目前,臨床尚缺乏有效的PDR治療方法,因此明確發病機制對防治DR具有重要的臨床意義。近年來,越來越多的臨床學者致力于研究Ang-2、超氧化物歧化酶(SOD)、神經營養因子(NTF)在糖尿病及其并發癥中的作用機制,旨在為糖尿病并發癥的預防和診治提供參考依據。
缺血缺氧誘導大量新生血管形成是PDR的主要病理機制[8]。Ang是機體新生血管形成過程中一種不可或缺的血管生長因子,其中Ang-1、Ang-2是特征性的血管生長因子[9]。高氧誘導的視網膜新生血管小鼠模型中,Ang-2表達顯著升高[10]。研究[11]報道,Ang-2在視網膜神經節內核層及細胞層表達,糖尿病大鼠視網膜中Ang-2表達水平顯著高于對照組。BDNF是神經生長因子家族成員,在調節中樞神經系統突觸功能及保護神經元方面起著關鍵作用[12]。國外研究[13]發現,DR患者血清BDNF水平較糖尿病非視網膜病變者及健康對照組患者顯著升高。相關研究[14]指出,BDNF可一定程度促進眼內新生血管形成。本研究認為,這是由于DR時視網膜神經膠質細胞受損,反饋調控BDNF水平升高,屬于機體的一種保護反應。血清SOD是一種分解超氧陰離子的酶,包含3種亞型,即線粒體、胞質表達的錳SOD和銅/鋅SOD,定位于胞膜及細胞外基質的SOD,ecSOD因其特殊定位能有效清除細胞外的超氧陰離子,在氧化應激所引起的糖尿病治療中具有廣闊的應用前景[15]。國外研究[16]表明,ec-SOD能夠促進BDNF和相關轉錄因子表達,在神經系統修復中發揮重要作用。本研究結果顯示,糖尿病患者血清ecSOD、BDNF、Ang-2水平高于對照組,且血清ecSOD、BDNF、Ang-2水平隨著DR分期加重而不斷升高,差異有統計學意義(P<0.05)。DR發生時,視網膜屏障流動性與通透性改變,導致多種功能受損,DR患者血清Ang-2表達水平升高,并協調促進病理性的視網膜新生血管生成[17],同時視網膜微血管內皮細胞與周細胞共同保持血管結構的完整性[18],ecSOD經巨噬細胞及平滑肌細胞合成與分泌,在血管內膜及內皮細胞中高表達[19],協同升高的SDNF共同修復DR患者視網膜神經組織損傷,維持視網膜微環境穩態。血清ecSOD、BDNF、Ang-2三者的產生機制雖然不同,但其在功能上有密切聯系。本研究Spearman相關性分析結果顯示,DR分期與血清ecSOD、BDNF、Ang-2水平呈正相關(P<0.05),ROC曲線結果提示血清ecSOD、BDNF、Ang-2對DR均具有診斷價值,表明血清ecSOD、BDNF、Ang-2在DR疾病的發生與發展中發揮著不容忽視的作用。因此,臨床診治DR時,若患者血清ecSOD、BDNF、Ang-2水平不斷升高,需警惕DR程度進一步加重。
綜上所述,血清ecSOD、BDNF、Ang-2均參與了DR疾病的發生與發展,并與病情分期密切相關,動態監測血清ecSOD、BDNF、Ang-2水平有助于評估DR患者視網膜病變程度。但其具體作用機制目前尚未明確,且本研究未對治療后DR患者的ecSOD、BDNF、Ang-2水平進行比較分析,有待在后續研究中進一步探討。

