秦皮乙素調控miR-486-5p表達抑制高糖誘導的腎小管上皮細胞炎癥損傷的機制研究
成 濤,王桂林,張秀容,張 濤,唐前容
(四川省宜賓市第二人民醫院 急診科,四川 宜賓,644000)
腎小管上皮細胞損傷可引起腎間質纖維化,是導致糖尿病腎病、急性腎損傷等腎臟疾病的主要原因和病理過程,其損傷機制包括氧化應激、腎組織炎癥及免疫反應等,研究腎小管上皮細胞損傷機制對防治糖尿病腎病具有重要意義[1-2]。研究[3]表明中醫藥在防治腎小管上皮細胞損傷及炎癥反應方面有獨特的療效。秦皮是在中國資源豐富且有巨大價值的中藥材,其含有香豆素類、木脂素類及環烯醚萜類等多種化學成分,具有抗菌、抗炎、抗腫瘤等作用[4]。秦皮乙素(Esc)屬于香豆素類成分,研究[5]報道Esc可減輕多柔比星誘導H9C2細胞的凋亡。Esc可通過上調細胞內抗氧化酶類物質活性來保護視網膜色素上皮細胞ARPE-19免受氧化損傷,表明Esc具有抗細胞損傷的作用[6]。目前,Esc對高糖誘導的腎小管上皮細胞炎癥損傷的影響及機制尚不清楚。
研究[7]顯示微小核糖核酸(miRNA)具有調控細胞凋亡的生物學特性,還參與炎癥損傷等病理過程。研究[8]報道miR-486-5p可誘導炎癥和細胞凋亡,從而促進急性肺損傷的發展。下調miR-486-5p可通過靶向核因子E2相關因子1(NRF1)減輕脂多糖誘導的軟骨細胞ATDC5中的炎癥性損傷、氧化應激和細胞凋亡,說明miR-486-5p可通過調節炎癥反應來影響細胞損傷[9]。目前,miR-486-5p對高糖誘導的腎小管上皮細胞炎癥損傷的影響以及Esc是否調控miR-486-5p的表達尚不清楚。本研究探討Esc對高糖誘導的腎小管上皮細胞炎癥損傷的影響,分析其相關機制與miR-486-5p的關系,現報告如下。
1 材料與方法
1.1 細胞與試劑材料
腎小管上皮細胞HK-2(美國ATCC);DMEM培養基(美國Hyclone公司);D-葡萄糖、Esc(美國Sigma-Aldrich公司);白細胞介素-6(IL-6)、腫瘤壞死因子-α(TNF-α)酶聯免疫吸附試劑盒(ELISA)(艾美捷科技有限公司);凋亡檢測試劑盒(北京百奧萊博科技有限公司);RIPA蛋白裂解液(上海貝博生物公司);SYBR Premix ExTaqTM試劑盒(日本Takara公司)。
1.2 細胞處理與分組
腎小管上皮細胞HK-2隨機分為對照(Con)組,高糖(HG)組,Esc低、中、高濃度(HG+Esc-L、M、H)組、HG+anti-miR-NC組、HG+anti-miR-486-5p組、HG+Esc+miR-NC組、HG+Esc+miR-486-5p組。Con組采用葡萄糖濃度為5.5 mmol/L的培養基培養HK-2細胞;HG組采用葡萄糖濃度為25.0 mmol/L的培養基培養HK-2細胞;HG+Esc-L、M、H組分別采用20.0、40.0、80.0 μmol/L Esc和25.0 mmol/L葡萄糖處理;HG+anti-miR-NC組、HG+anti-miR-486-5p組將anti-miR-NC、anti-miR-486-5p分別轉染至HK-2細胞,而后采用25.0 mmol/L葡萄糖處理;HG+Esc+miR-NC組、HG+Esc+miR-486-5p組將miR-NC、miR-486-5p分別轉染至HK-2細胞,而后采用80.0 μmol/L Esc和25.0 mmol/L葡萄糖處理。
1.3 ELISA法檢測IL-6、TNF-α水平
取培養48 h的各組細胞上清液,按照各自試劑盒說明書操作,最后采用酶標儀檢測450 nm處吸光度值(OD450 nm)。繪制標準曲線,根據樣品OD值在標準曲線上查出相應的濃度。
1.4 流式細胞術檢測細胞凋亡
離心收集各組細胞,將細胞用預冷PBS洗滌,加入300.0 μL的結合緩沖液懸浮細胞;加入5.0 μL的膜聯蛋白V-異硫氰酸熒光素(Annexin V-FITC)混勻,再加入5.0 μL的碘化丙啶(PI)染色;避光孵育10 min;上流式細胞儀檢測細胞凋亡率。
1.5 蛋白質印跡(Western blot)法檢測蛋白表達
收集各組細胞,加入適量RIPA裂解液提取總蛋白,進行SDS-PAGE電泳分離蛋白,然后轉膜,封閉后加入cleaved-caspase3、cleaved-caspase9抗體(1∶800),4 ℃孵育過夜,棄掉一抗,加入辣根過氧化物酶(HRP)標記的二抗(1∶1 500),室溫孵育2 h,顯色,Quantity One分析蛋白條帶灰度值,計算蛋白的相對表達量。
1.6 實時熒光定量聚合酶鏈式反應(RT-qPCR)檢測miR-486-5p表達水平
提取各組腎小管上皮細胞的總RNA,反轉錄成cDNA,以U6為內參進行PCR擴增,相對表達量采用2-△△Ct法計算。本研究中miR-486-5p上游引物序列為:5′-TCCTGTACTGAGCTGCCC-3′;下游引物序列為:5′-CTGCAGGGTCCGAGGT-3′。U6上游引物序列為:5′-CTCGCTTCGGCAGCACA-3′;下游引物序列為:5′-GCTTCACGAATTTGCGTGTCAT-3′。
1.7 統計學分析

2 結 果
2.1 Esc對高糖誘導的腎小管上皮細胞炎癥因子表達的影響
與Con組比較,HG組腎小管上皮細胞中IL-6、TNF-α水平升高,差異有統計學意義(P<0.05);與HG組比較,HG+Esc-L、M、H組腎小管上皮細胞中IL-6、TNF-α水平逐漸降低,差異有統計學意義(P<0.05)。見表1。

表1 Esc對高糖誘導的腎小管上皮細胞炎癥因子表達的影響
2.2 Esc對高糖誘導的腎小管上皮細胞凋亡的影響
與Con組比較,HG組腎小管上皮細胞的凋亡率及cleaved-caspase3、cleaved-caspase9蛋白表達水平升高,差異有統計學意義(P<0.05);與HG組比較,HG+Esc-L、M、H組腎小管上皮細胞的凋亡率及cleaved-caspase3、cleaved-caspase9蛋白表達水平逐漸降低,差異有統計學意義(P<0.05)。見圖1、表2。


表2 Esc對高糖誘導的腎小管上皮細胞凋亡的影響
2.3 Esc對高糖誘導的腎小管上皮細胞miR-486-5p表達的影響
與Con組比較,HG組腎小管上皮細胞中miR-486-5p表達水平升高,差異有統計學意義(P<0.05);與HG組比較,HG+Esc-L、M、H組腎小管上皮細胞中miR-486-5p表達水平逐漸降低,差異有統計學意義(P<0.05)。見表3。
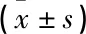
表3 Esc對高糖誘導的腎小管上皮細胞miR-486-5p表達的影響
2.4 抑制miR-486-5p表達對高糖誘導的腎小管上皮細胞炎癥損傷的影響
與HG+anti-miR-NC組比較,HG+anti-miR-486-5p組腎小管上皮細胞中miR-486-5p表達、IL-6及TNF-α水平、細胞的凋亡率以及cleaved-caspase3、cleaved-caspase9蛋白表達水平均降低,差異有統計學意義(P<0.05)。見圖2、表4。


表4 抑制miR-486-5p表達對高糖誘導的腎小管上皮細胞炎癥損傷的影響
2.5 上調miR-486-5p表達減弱了Esc(80.0 μmol/L)對高糖誘導的腎小管上皮細胞炎癥損傷的作用
與HG+Esc+miR-NC組比較,HG+Esc+miR-486-5p組腎小管上皮細胞中miR-486-5p表達水平、IL-6及TNF-α水平、細胞的凋亡率以及cleaved-caspase3、cleaved-caspase9蛋白表達水平均升高,差異有統計學意義(P<0.05)。見圖3、表5。


表5 上調miR-486-5p表達減弱了Esc對高糖誘導的腎小管上皮細胞炎癥損傷的作用
3 討 論
腎小管上皮細胞能夠分泌多種炎癥因子進入到腎間質,加速其炎癥進程;腎小管上皮細胞受損后可直接參與腎間質纖維化,炎癥反應和纖維化均在腎臟疾病的進展中起關鍵作用[10-11]。研究[12]報道Esc可拮抗單核細胞衍生的巨噬細胞浸潤刺激的肺纖維化和肺泡上皮屏障破壞。Esc可減輕炎性細胞浸潤以及促炎性細胞因子TNF-α、IL-6、白介素-1β(IL-1β)的生成,改善脂多糖誘導的小鼠急性肺損傷[13-14]。本研究采用不同濃度Esc作用于高糖誘導的HK-2細胞,結果顯示,IL-6、TNF-α水平逐漸降低,細胞的凋亡率及cleaved-caspase3、cleaved-caspase9蛋白表達水平逐漸降低,表明Esc呈濃度依賴性地抑制高糖誘導的HK-2細胞炎癥反應及凋亡。
研究[15]報道miR-486-5p下調并通過靶向胰島素樣生長因子1(IGF-1)保護心肌細胞免受缺氧誘導的細胞損傷。研究[16]顯示miR-486-5p通過直接靶向叉頭盒O類轉錄因子1(FOXO1)抑制髓核細胞的炎癥反應、基質降解和凋亡。本研究結果顯示,高糖誘導的HK-2細胞中miR-486-5p表達水平升高;抑制miR-486-5p表達后,高糖誘導的HK-2細胞中IL-6、TNF-α水平降低,細胞的凋亡率及cleaved-caspase3、cleaved-caspase9蛋白表達水平降低,表明抑制miR-486-5p表達可抑制高糖誘導的HK-2細胞炎癥反應及凋亡。此外,本研究發現Esc可降低miR-486-5p的表達水平;過表達miR-486-5p和Esc同時處理后,IL-6、TNF-α水平升高,細胞的凋亡率及cleaved-caspase3、cleaved-caspase9蛋白表達水平顯著升高(P<0.05)。上述結果顯示,Esc可通過下調miR-486-5p表達抑制高糖誘導的腎小管上皮細胞炎癥損傷。

