以腸系膜上動脈為導向的腹腔鏡下完整結腸系膜切除治療右半結腸癌的可行性及近期效果
朱瀟逸 沈展 阮航 沈錦敏
2009年德國學者Hohenberger等[1]提出完整結腸系膜切除(complete mesocolic excision,CME)的理念,此后CME逐漸成為右半結腸癌根治術的標準術式。但是Hohenberger教授闡述的CME手術,對于右半結腸癌完整系膜的內側切緣定位尚不明確,目前國內外學術界仍存在爭議,主流觀點仍是將右半結腸癌清掃范圍的內側界局限于腸系膜上靜脈(superior mesenteric vein,SMV)[2]。但有研究表明,結腸淋巴流向中淋巴管伴隨動脈分布,淋巴管結構與動脈結構密切相關[3],以SMV為清掃內側界顯然與這一原則相違背。國內相關研究顯示,右半結腸D3淋巴結清掃以腸系膜上動脈(superior mesenteric artery,SMA)為內側界(作為CME右半結腸系膜信封的內口),近期手術效果良好[4-5]。筆者也非常認可右半結腸癌CME術的內側界以SMA為界,于2018年5月至2021年2月施行以SMA為導向的右半結腸癌CME+D3根治術32例,并取得了良好的手術效果,現報道如下。
1 對象和方法
1.1 對象 選取2018年5月至2021年2月由樹蘭(杭州)醫院肛腸外科同一手術組實施尾側入路、以SMA為導向的腹腔鏡下右半結腸癌CME+D3根治術的患者32例,其中男18例,女14例;年齡35.0~85.0[65.0(42.8,73.8)]歲;BMI 18.5~36.6[24.3(22.6,25.9)]kg/m2;腫瘤位于回盲部9例,升結腸17例,結腸肝曲及橫結腸近肝曲6例;根據美國癌癥聯合委員會第7版TNM分期系統,術前臨床分期Ⅰ期(T2N0M0)5例,Ⅱ期16例,Ⅲ期11例。入組標準:(1)經術前檢查證實為進展期右半結腸癌,且腫瘤評估為可切除,無遠處轉移;(2)無明顯手術禁忌證且患者接受腹腔鏡手術。排除標準:(1)因腸梗阻或穿孔等原因行急診手術者;(2)術前因腸梗阻行腸內支架植入者;(3)術前行新輔助化療者;(4)腹腔內嚴重粘連而影響顯露者。本研究經本院醫學倫理委員會審查通過,所有患者簽署知情同意書。
1.2 手術方法 氣管插管,全麻,患者取平臥分腿位,采用五孔法于臍下4~5 cm處置入10 mm Trocar為腔鏡孔,左鎖骨中線肋緣下約3 cm處置入10 mm Trocar為主操作孔,左側髂前上棘與臍連線中點、右側鎖骨中線肋緣下約3 cm及右下腹麥氏點處分別置入5 mm Trocar為輔助操作孔。主刀醫生立于患者左側,行常規探查腹腔后,實施尾側入路、以SMA為導向的手術方式,具體步驟如下:(1)層面拓展。顯露并切開膜橋[末端回腸系膜與后腹膜之間的“黃白交界線”,見圖1a(插頁)],向頭側拓展右結腸系膜后間隙(右側Toldt間隙),分離顯露Henle干及其結腸支后停止,見圖1b(插頁);(2)淋巴結清掃。先在SMV左側緣表面以蘸染美藍的電凝鉤作一標記線,再于SMA中線表面以超聲刀劃一標記線,兩標記線之間淋巴結即為SMA周圍淋巴結,見圖1c(插頁)。根據回結腸動脈(ileocolic artery,ICA)的走形選擇2種不同的清掃順序:①對于ICA走形于SMV后方(本組20例),先打開SMV遠端靜脈鞘,根部鉗夾、離斷回結腸靜脈(ileocolic vein,ICV),再于SMV后方由助手向右側牽拉ICA血管干,于ICA根部鉗夾、離斷,清掃203組淋巴結,見圖1d(插頁);以SMA血管鞘表面分布的滋養血管為標志,在SMA血管鞘外間隙分離并顯露右結腸動脈(right colic artery,RCA)及中結腸動脈(middle colic artery,MCA),清掃 213及 223組淋巴結,根部結扎RCA及MCA主干或其右支;最后分離顯露Henle干各分支,離斷其結腸支。②對于ICA走形于SMV及ICV前方(本組12例),先沿SMA中線表面標記線由尾側向頭側分離,在SMA血管鞘外間隙分離并顯露 ICA、RCA 及 MCA,見圖 1e(插頁);清掃 203、213、223組淋巴結,根部結扎ICA、RCA及MCA主干或其右支,見圖1f(插頁);向右翻頁式掀起右結腸系膜前葉及淋巴脂肪組織,鞘內裸化SMV主干,顯露ICV根部后鉗夾、離斷,見圖1g(插頁);其余操作同ICA走形于SMV后方組,清掃后見圖1h(插頁)。(3)轉向結腸上區,在橫結腸系膜及胃背側系膜形成的融合筋膜間隙內分離(橫結腸近肝曲及肝曲癌患者需自胃網膜血管弓內走行,清掃第6組淋巴結,根部離斷胃網膜右動脈)。(4)中上腹正中作5 cm切口進腹,切口保護套保護切口,將右半結腸提出體外,整塊切除右半結腸標本,將末端回腸與橫結腸行側側吻合。臺下檢查標本,沿SMV左側標記線剪開結腸系膜,將SMA周圍淋巴結單獨送檢。
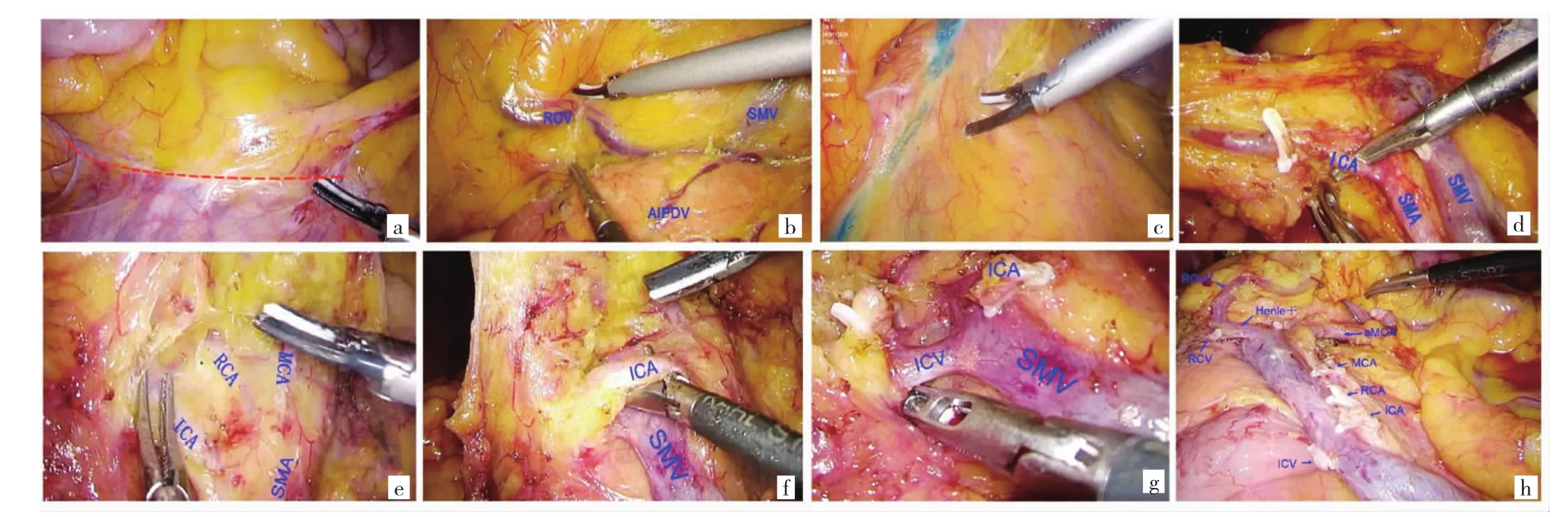
圖1 淋巴結清掃步驟(a:顯露膜橋;b:顯露Henle干及其結腸支;c:SMV左側緣沾染美藍的電凝鉤標記線,SMA中線位置作為切除線;d:ICA 從SMV、ICV后方走行;e:SMA血管鞘外間隙分離、顯露ICA、RCA及MCA;f:ICA從SMV前方走行;g:離斷ICA,顯露ICV;h:SMA導向清掃后;SMA為腸系膜上動脈;SMV為腸系膜上靜脈;ICA為回結腸動脈;RCA為右結腸動脈;MCA為中結腸動脈;aMCA為副中結腸動脈;ICV為回結腸靜脈;RCV為右結腸靜脈;RGeV為胃網膜右靜脈;AIPDV為胰十二指腸下前靜脈)
1.3 觀察指標 包括手術時間、術中出血量、術后病理檢查結果、淋巴結清掃情況、術后肛門排氣時間、術后腹腔引流量、引流管留置時間、術后短期并發癥、術后住院時間、術后30 d再住院率、術后復發轉移情況、術后生存率等指標。
2 結果
2.1 術中情況 全部患者手術無中轉開腹,手術時間150.0~250.0[195.0(172.5,210.0)]min,術中出血量10.0~200.0[50.0(31.3,60.0)]ml。
2.2 術后病理檢查結果 術后病理分期Ⅰ期(T2N0M0)4例,Ⅱ期15例,Ⅲ期13例,與術前臨床分期符合率78.1%(25/32)。術后病理類型為低分化腺癌8例,中分化腺癌15例,高分化腺癌6例,黏液腺癌3例。每例患者術后淋巴結清掃數目為 15~107[25(17,42)]枚,其中單獨送檢 SMA 旁淋巴結 0~6[3(2,4)]枚,有 1 例患者出現淋巴結轉移(2/4枚),術后病理分期為T4aN2aM0。
2.3 術后恢復情況 術后肛門排氣時間24~96[36(24,48)]h,術后住院時間為 7~22[10(9,12)]d,術后腹腔引流量為 180~2 500[550(388,635)]ml,引流管留置時間為 6~14[8(7,10)]d。4 例患者術后出現乳糜漏(乳糜試驗陽性),均給予禁食、腸外營養、生長抑素靜脈維持或低脂高蛋白飲食而治愈,平均住院時間較無并發癥者延長5.5 d;3例患者出現胃癱,其中2例女性患者分別施行標準右半結腸切除術及擴大右半結腸切除術,1例男性患者施行標準右半結腸切除術,均給予胃腸減壓、促進胃動力藥物及留置空腸營養管行腸內營養治療而痊愈,平均住院時間較無并發癥者延長13.5 d。術后并發癥總發生率為18.8%(6/32,其中有1例先發生淋巴漏,在進食后發生胃癱)。術后30 d內無再入院患者。
2.4 隨訪結果 本組患者術后獲得隨訪28例,隨訪時間2~36個月。隨訪期間有2例患者出現肝臟轉移,目前仍在治療中;2例患者出現多發遠處轉移,分別于術后22、30個月死亡;其余24例患者均健康生存,其中1例SMA周圍淋巴結轉移患者無病生存已超半年。
3 討論
根據日本結直腸癌學會對中央組淋巴結的定義,中央組淋巴結分布于動脈起點的周圍,故以SMV左側為內側界不能有效地清掃位于結腸動脈起點處的淋巴結,無法滿足清掃中央組淋巴結的要求[6],這與胃癌、直腸癌以動脈為導向的淋巴清掃原則也不一致。孫躍明等[7]、周樂其等[8]報道以SMA左側作為右半結腸CME淋巴結清掃的內側界,可獲得更多的淋巴結清掃總數,手術安全可行,但術后乳糜漏發生率較高。刁德昌等[4]報道開展以SMA中線為淋巴結清掃的內側界22例,清掃淋巴結數目13~55枚(中位數為26枚),SMA旁淋巴結0~8枚(中位數為4枚),其中1例患者SMA旁淋巴結轉移(1枚)。筆者也支持以SMA中線為CME內側界的止點,原因如下:(1)在解剖學上以SMA中線為淋巴清掃內側界,已經可以做到ICA、RCA及MCA根部第3站淋巴結的徹底清掃;(2)將清掃范圍擴大至SMA左側緣極易損傷小腸系膜根部淋巴管,從而導致術中或術后嚴重淋巴漏。在本組患者中,以SMA為導向清掃SMA周圍淋巴結,每例患者0~6枚(中位數為3枚),其中1例出現淋巴結轉移,這表明以SMA為導向清掃淋巴結具有一定的腫瘤學意義。
術前清晰了解SMA、SMV及其屬支的空間關系十分重要,有學者通過腸系膜血管三維CT檢查對相關血管進行評估,效果滿意[9]。由于腸系膜血管三維CT重建價格較為昂貴、預約時間較長,難以在臨床廣泛應用。筆者在臨床實踐工作中發現,通過全腹部增強CT橫斷位及冠狀位就可以對ICA與SMV、SMA與SMV的相對空間關系作出精準評估,術中尋及SMA、SMV的主干并辨認清楚ICA、ICV走形后,SMA及SMV的其余屬支可在手術過程中由SMA、SMV的尾側向頭側逐一分離、顯露,由干及支,并不困難。筆者依據ICA與SMV的相對空間關系分為2種類型:(1)ICA從SMV后方走行(本組20例),是臨床中相對多見的類型,此類型患者SMA尾側端一般位于SMV左側、左后方或正后方,需先分離顯露SMV尾側端,清掃并根部離斷ICV后,于SMV后方向右側牽拉顯露ICA主干并于其根部離斷,再轉向腹側沿SMA中線向頭側清掃;(2)ICA從SMV前方走行(本組12例),是臨床中相對少見的類型,此類型患者SMA尾側端一般位于SMV左側、左前方或正前方,筆者認為此類型患者施行SMA導向難度低于SMV導向,尤其部分SMA主干遠端位于SMV正前方的患者,由于SMV尾側端完全處于SMA正后方,優先尋找SMV尾側端十分困難,若施行SMV導向清掃而術前又疏于對血管的評估,反而增加術中風險,筆者也是因為術中遇到過此種情況后改行SMA導向淋巴結清掃。
在臨床實際工作中,沿SMA主干中線清掃右半結腸癌術后較常見的并發癥是乳糜漏和胃癱。乳糜漏的發生既往文獻報道較多[4-8],本文不再贅述。目前國內相關文獻對胃癱的發生報道較少,本組中有3例患者發生胃癱,這3例BMI均<20 kg/m2且無明確胃部疾病史,其中1例采取擴大右半結腸切除術,另2例采取標準右半結腸切除術。根據本組少量病例,筆者發現胃癱易發生于消瘦無力型患者,與性別無關,其發生的外科因素似乎與223組淋巴結的徹底清掃、橫結腸系膜根及胰頸胰體前間隙的廣泛游離以及幽門下淋巴結的清掃等導致胃周區域較大范圍的游離相關,而不僅僅是目前普遍認為的由清掃幽門下淋巴結時離斷胃網膜右動靜脈導致,需要進一步擴大樣本的研究證實。筆者的經驗是若術后造影證實胃癱,應盡早放置空腸營養管給予腸內營養,以盡快改善患者營養狀況,以便于及早采取下一步可能的輔助治療。
綜上所述,以SMA為導向的腹腔鏡下CME治療右半結腸癌安全可行,能清掃更多的淋巴結,近期效果良好。依據ICA與SMV的空間關系進行分型,程序化、套路化的清掃SMA及SMV周圍淋巴結,手術難度并未明顯增加,尤其對于回結腸動脈走行于SMV前方者,施行該手術更加容易、安全。但術后淋巴漏及胃癱發生率似乎有所升高,但均可在短期內采取保守方式治愈,臨床可行性較高。

