MIRA-LFD鑒別肉制品中鴨源性成分的方法研究
尚柯,張敏,張彪,王巍,段慶梓,張玉,雍溶,葉梅*
(1.成都市食品藥品檢驗研究院,四川 成都 611135;2.湖南大學生物學院,湖南 長沙 410012)
隨著市場全球化及貿易自由化的不斷發展,消費者對肉制品產品質量和真實性越來越重視,肉制品安全提升到一個新的高度[1-2],食品領域經濟利益驅動型摻假行為對食品安全和食品貿易造成嚴重危害[3]。目前,肉制品的摻假主要表現為原料肉摻假、組織替換等[4],這些真實性問題不但侵害了消費者利益,而且給肉制品食用安全帶來潛在危害,同時也可能帶來宗教信仰和道德標準方面的風險[5]。因此,肉制品動物源性成分檢測變得越來越重要,核酸檢測可以從樣品中檢測出痕量目標分子,具有靈敏性和特異性等諸多優勢,已成為食品真實性研究中必要的技術手段[6],并在檢測領域中得到廣泛應用。但是,傳統的核酸檢測技術對實驗室環境、儀器及人員要求較高,無法滿足現場檢測監管需求。近年來,重組酶聚合酶擴增技術(recombinase polymerase amplification,RPA)[7]發展迅速[8],在醫療診斷[9-11]、農業[12-14]、食品[15-16]等方面的應用越來越廣泛,該技術的快速發展促進了核酸檢測在現場中的應用,因不需要高溫變性、退火等步驟,對精密儀器依賴程度大大降低,是實現現場即時檢測的有效技術手段。
多酶恒溫快速擴增技術(multienzyme isothermal rapid amplification,MIRA)是在RPA技術基礎上發展起來的一種新型恒溫核酸擴增方法,在37℃條件下,重組酶和引物形成蛋白/單鏈核苷酸的復合體Rec/ss-DNA,在輔助蛋白和單鏈結合蛋白(single strand DNA-binding protein,SSB)的幫助下,侵入雙鏈DNA模板;在侵入位點形成D-loop區域,并開始對DNA雙鏈進行掃描;待找到與引物互補的目的區域后,復合體Rec/ssDNA解體的同時,聚合酶也結合到引物的3′末端,開始鏈的延伸,依賴核酸內切酶(nfo酶)的作用,加入根據模板設計的特異性分子探針,結合膠體金核酸檢測試紙條(lateral flow dipstick,LFD)從而實現擴增產物快速檢測,該方法與側流式膠體金法有機結合,不僅能達到簡捷、靈敏、特異的檢測目的,而且能更好地為現場動物源性成分檢測提供可視化應用服務。多酶恒溫快速擴增技術原理見圖1。
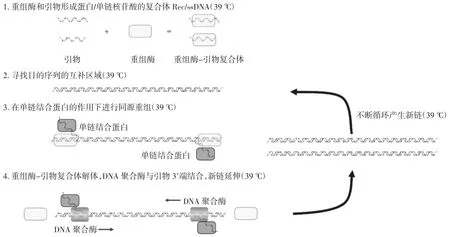
圖1 多酶恒溫快速擴增技術原理圖Fig.1 Schematic diagram of multienzyme isothermal rapid amplification
MIRA技術在用于鴨源性檢測方面具有多項優勢[17]:在特殊酶的作用下,DNA模板不需要高溫循環變性擴增,對儀器的要求大大降低[18];具有快速反應的特點,樣本與試劑一接觸便開始反應,20 min內即可獲得檢測結果[19];可檢測單鏈DNA與雙鏈DNA,檢測范圍較廣[20];目前商品化試劑盒較多,操作簡便,無需復雜的培訓即可開展檢測工作。因此,MIRA技術用于鴨源性檢測具備良好的適用性。
本研究旨在提高肉制品中鴨源性成分檢測方法的可操作性,建立健全肉制品動物源性的檢測方法,針對鴨肉制品建立專屬性多酶恒溫側流式擴增技術(MIRA-LFD)檢測方法,為鴨源性成分現場檢測提供技術支撐。
1 材料與儀器
1.1 材料與試劑
動物基因組提取試劑盒:上海捷瑞生物工程有限公司;DNA恒溫快速擴增試劑盒:濰坊安普未來生物科技有限公司;側流式膠體金試紙條:德國Milenia Biotec公司;引物及探針:生工生物工程(上海)股份有限公司。
1.2 儀器與設備
Milli-Q Academic實驗室超純水儀:美國Millipore公司;MM400行星球磨儀:德國Retsch公司;Cen-trifuge 5427 R高速冷凍離心機:德國Eppendorf公司;ME2002E電子天平:瑞士Mettler Toledo公司;BSA224S電子天平:德國賽多利斯公司;MK3渦懸振蕩器:德國IKA公司;P330核酸蛋白定量儀:德國Implen公司;Thermo-Shaker BG-100干式恒溫器:杭州瑞誠儀器有限公司;GelDoc-It凝膠成像儀:美國UVP公司。
1.3 樣品信息
本試驗所用樣品包括豬、牛、羊、雞、鴨、鵝、狐貍、貂、貓、海貍鼠共10個物種。樣品采自養殖廠、研究所、農貿市場、電商、超市等。所有樣品通過合成引物[21-22]進行線粒體基因測序驗證,保證樣品的真實性[23]。
2 試驗過程
2.1 引物探針設計
鴨源性CYTB基因序列和核糖體12S基因序列來自Genbank網站(登錄號為L07521.1和U59666.1),并上傳至網站進行序列對比,對比結果見圖2和圖3。
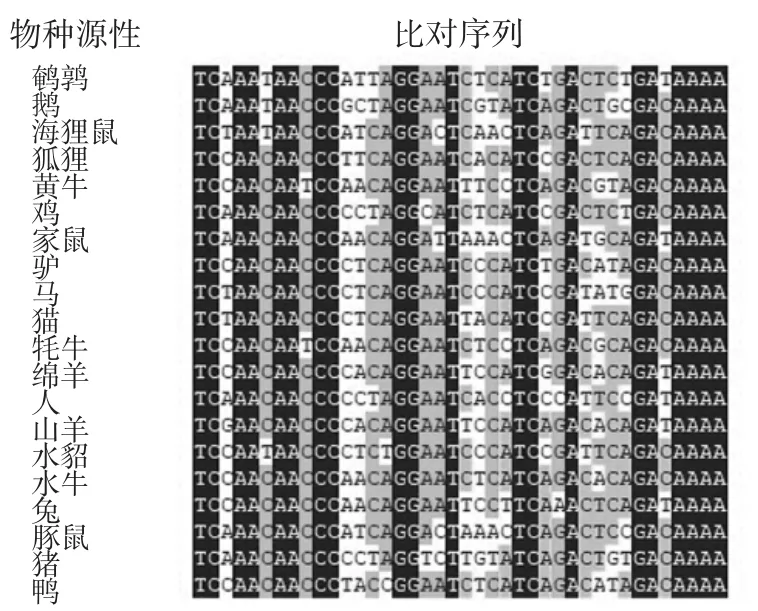
圖2 鴨CYTB基因比對結果Fig.2 Comparison of duck CYTB gene
圖2~圖3對比結果表明CYTB基因和核糖體12S基因對于鴨源性檢測有良好的特異性,可用于設計鴨源性檢測的特異MIRA引物和探針。在引物設計時,選擇堿基排布隨機性高、鳥嘌呤和胞嘧啶所占比率在30%~70%之間的引物序列,并且在下游引物的5′端標記生物素(biotin)修飾基團;對于MIRA法的探針序列,應避免回文序列、內部二級結構和連續的重復堿基,長度一般在 46 nt~52 nt,在 5′端修飾一個 6-羧基熒光素(6-carboxyfluorescein,FAM)標記,在距 5′端約30 nt序列位置上標記一個四氫呋喃(tetrahydrofuran,THF),作為核酸內切酶的識別位點,另外THF距離3′末端約15 nt,并且3′末端標記一個C3-spacer修飾基團。
根據以上設計原則,共設計11條引物及所對應的2條探針,引物名稱及序列如表1所示。

表1 引物探針信息Table 1 Details of primers and probe
按照不同目的片段來源將這些引物探針分為a組(CYTB基因)和b組(核糖體12S),在a組和b組內對這些引物和探針開展3×3試驗,共15個組合,以期獲得最適合的引物探針。引物探針正交組合見表2。
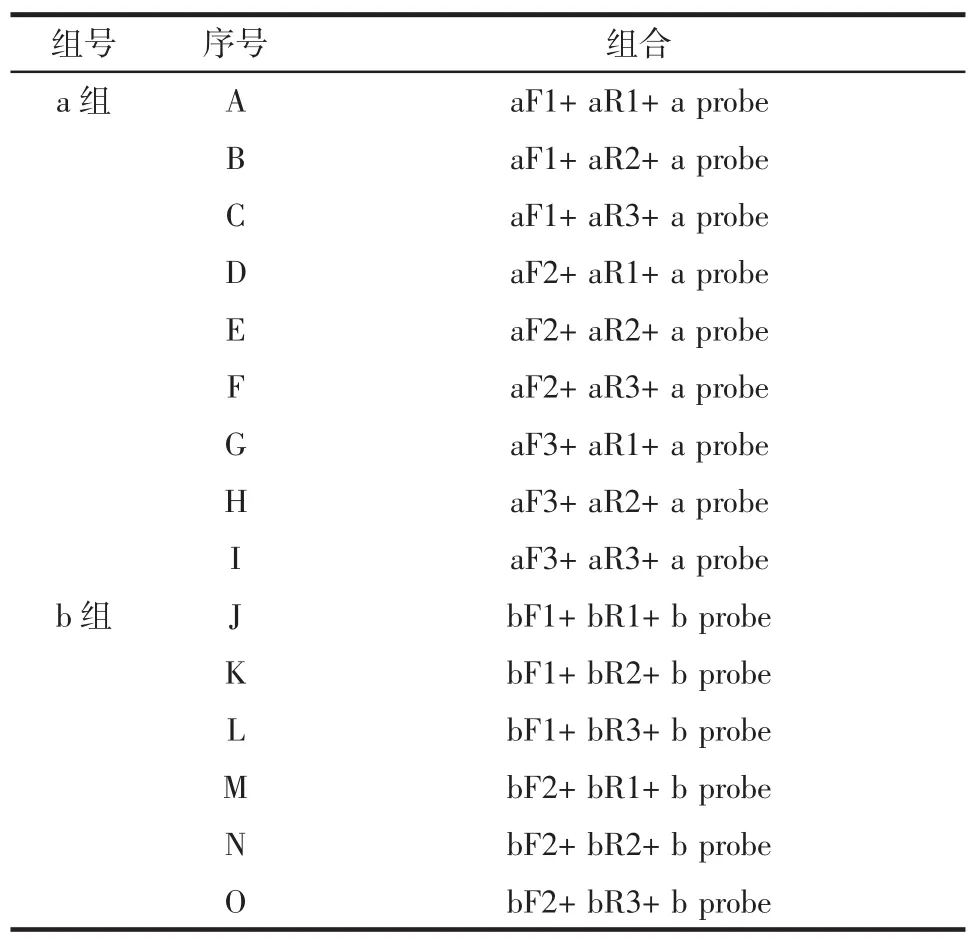
表2 引物探針正交組合Table 2 Orthogonal combinations of primers and probe
2.2 MIRA-LFD方法建立
2.2.1 DNA提取
按照DNA提取試劑盒說明書對樣品進行基因組提取,用核酸蛋白定量儀確定DNA提取的效率與純度,進行OD260/OD280值測定,測得值均在1.7~2.0之間,表明可用于后續試驗。
2.2.2 陽性對照試驗
MIRA陽性對照反應體系(50 L)包括29.4 L的A緩沖液,1.0 μL鴨源性核酸模板和2.5 μL B緩沖液,每套引物各 0.25 μL,并用去離子水補齊 50 μL,設立以去離子水為DNA模板的空白對照組;同時以MIRA試劑盒提供的正對照模板單元作為試驗質控對照。正對照體系配制:正對照模板加入2 μL,引物加入4 μL正對照引物Mix(包含上/下游引物),其它組分如上體系配制。產物用3%瓊脂糖凝膠做水平電泳,并用凝膠成像系統拍照記錄結果。
2.2.3 空白對照試驗
MIRA-LFD 空白對照反應體系(50 μL)包括29.4 μL 的 A 緩沖液,1.0 μL 去離子水和 2.5 μL B 緩沖液,每套引物各 0.25 μL,探針 0.075 μL,并用去離子水補齊50 μL。其中,空白對照為去離子水。
2.2.4 陰性對照試驗
MIRA-LFD陰性對照反應體系(50μL)包括29.4 μL的A緩沖液,1.0 μL陰性對照核酸模板和2.5 μL B緩沖液,每套引物各 0.25 μL,探針 0.075 μL,并用去離子水補齊50 μL。其中,陰性對照分別為豬、牛、羊、雞、鵝、狐貍、貂、貓和海貍鼠樣品提取的DNA模板。
2.3 檢出限試驗
稱取200 mg左右的鴨肉和雞肉組織,分別轉移至2.0 mL的離心管中。然后向每個離心管加入400 mg ACL溶液(由DNA提取試劑盒提供)和20 mg的蛋白酶K溶液(由DNA提取試劑盒提供)。充分振蕩混勻,置于55℃過夜裂解,直至樣品裂解完全。檢出限試驗樣品信息見表3。
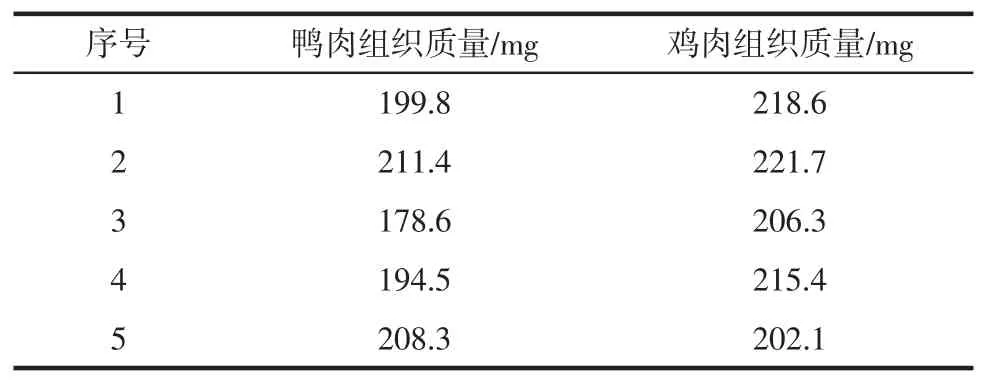
表3 檢出限試驗樣品信息Table 3 Sample information of detection limit experimental
樣品完全裂解后,按照如下公式計算1 mg相應的組織材料所對應的裂解液質量(x),以鴨肉組織裂解液為樣品,以雞肉組織裂解液為本底配制10%、1%、0.1%和0.01%(質量比)的模擬樣本。分別對這些模擬樣本進行DNA提取,依照建立的方法進行試驗。
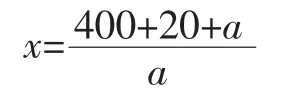
式中:x為1 mg相應的組織材料所對應的裂解液質量,mg;a為供試樣品組織質量,mg。
2.4 MIRA-LFD與熒光定量PCR結果對比
熒光定量 PCR反應[24]采用 25 μL體系,包括12.5 μL的 2×MasterMix,上游引物 FP(5′-GGCCACACAAATCCTCACAG-3′,900 nmol/L)、下游引物 RP(5′-TGTGTTGGCTACTGAGGAGAAA-3′,900 nmol/L)和探針(5′-FAM-CCTACTGGCTATGCACTACACCGCAGACTAMRA-3′,250 nmol/L)各 2.0 μL,所用 DNA 模板與2.3中相同,用去離子水補齊25 μL。熒光定量PCR反應條件 50℃ 2 min→95℃ 10 min→40×(95℃ 15 s→60℃1 min)收集熒光信號。檢測結束后,根據擴增曲線和循環閾值(cycle threshold,Ct)讀取結果。
3 試驗結果
3.1 陽性對照試驗結果
鴨CYTB基因陽性對照正交試驗比對結果見圖4。鴨核糖體12S陽性對照正交試驗比對結果見圖5。
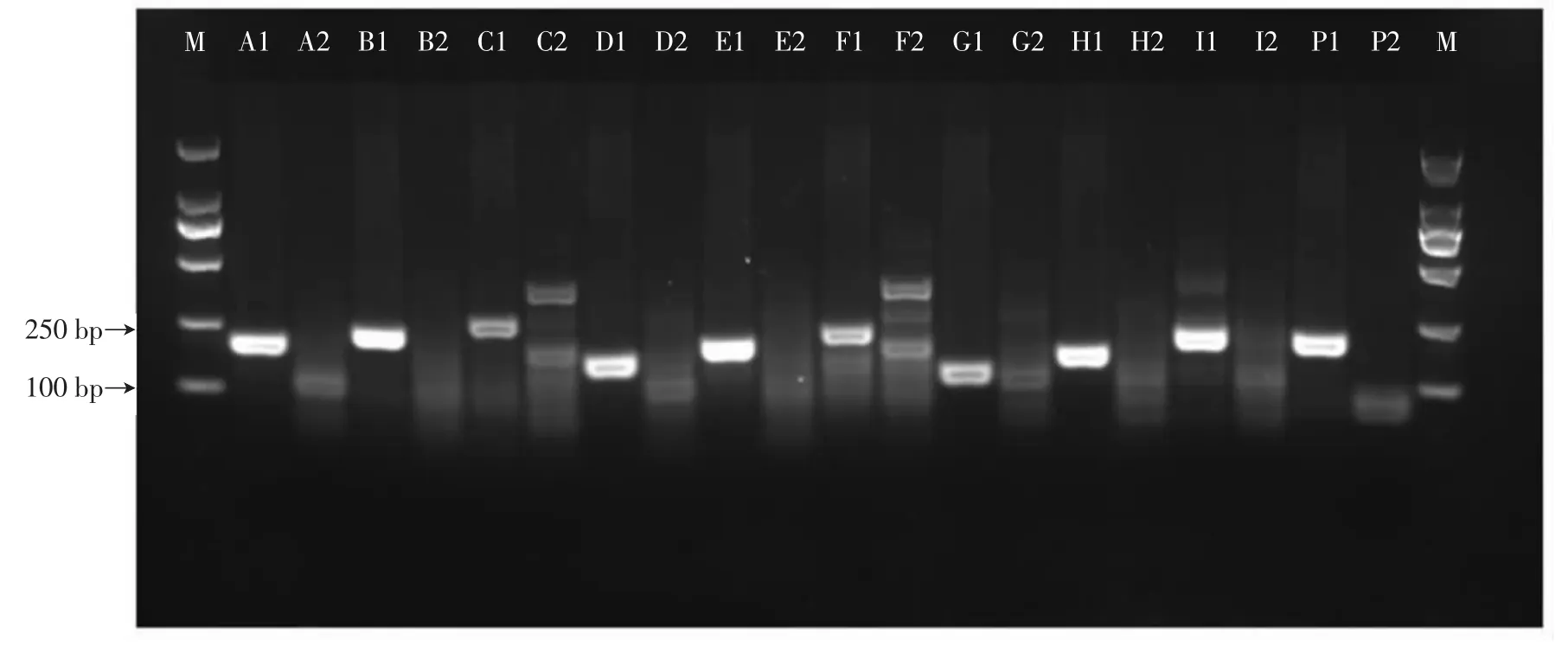
圖4 鴨CYTB基因陽性對照正交試驗比對結果Fig.4 Comparison results of duck CYTB gene positive control by orthogonal experiment

圖5 鴨核糖體12S陽性對照正交試驗比對結果Fig.5 Comparison of duck ribosomal 12S gene positive control by orthogonal experiment
由圖4、圖5可知,比較表2中的15套引物與試劑盒配套陽性對照結果,15對引物組合陽性對照均出現條帶,但其中C、F組合空白對照結果出現明顯引物二聚體,因此篩選其它13對組合與相應的探針進行空白對照試驗。
3.2 空白對照試驗結果
向陽性對照試驗篩選出的13對引物加入其相對應探針進行MIRA-LFD反應,試驗結果如圖6所示。
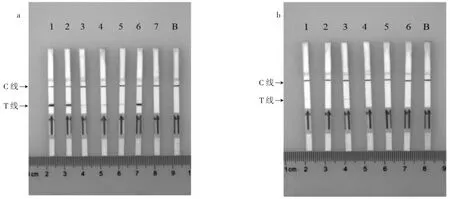
圖6 鴨源性空白對照正交試驗結果Fig.6 The results of duck derived blank control by orthogonal experiment
圖6為15對鴨源性引物探針MIRA-LFD空白結果,4對引物探針組合空白對照未出現T線,表明未出現非特異結合;其余11對引物探針均出現T線,因此選擇4對未出現T線的引物探針組合(組合I、K、M、N)進行后續試驗。
3.3 陰性對照試驗結果
根據以上試驗結果,篩選空白對照中未出現檢測線(T線)的引物探針組合進行陰性對照試驗。其中,試驗對象分別為豬、牛、羊、雞和鴨樣品提取的DNA模板。膠體金結果如圖7所示。

圖7 陰性對照篩選預試驗Fig.7 Negative results pre-test
如圖7中的4對引物探針陰性對照結果,組合N陰性對照未出現T線,表明未出現非特異結合。在此基礎上增加陰性對照物種數,進一步考察這對引物探針組合的特異性,膠體金結果如圖8所示。

圖8 陰性對照篩選試驗Fig.8 Negative results test
如圖8所示,組合N在牛、羊、豬、雞、鵝、狐貍、貂、貓和海貍鼠為陰性,表現出良好的特異性,未出現明顯的非特異性結合,因此將組合N作為MIRA-LFD方法檢測鴨源性成分的引物探針組合。
3.4 檢出限試驗與對比試驗結果
檢出限試驗是通過將鴨肉酶解液與雞肉酶解液混合制備得到的不同濃度的模擬樣品(10%、1%、0.1%和0.01%,質量比),以比較MIRA-LFD法同熒光定量PCR法在檢測鴨源性成分時的最低檢出限,試驗結果如圖9所示。
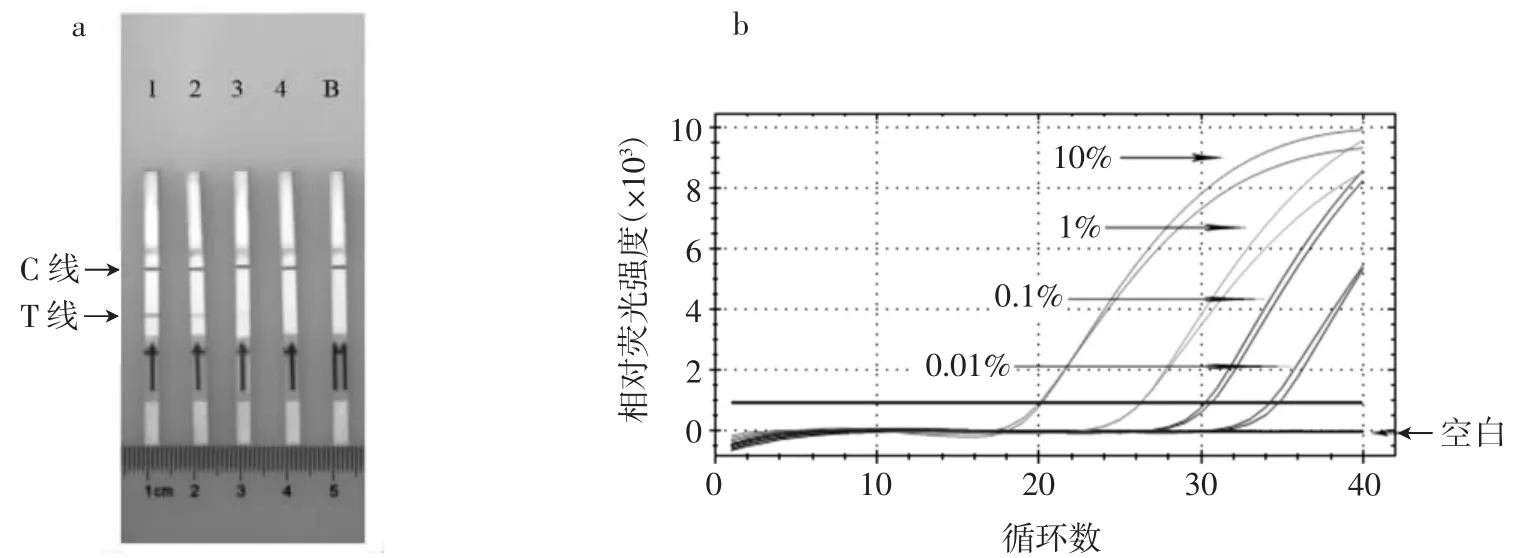
圖9 檢出限比對試驗結果Fig.9 Comparison of detection limit results
由圖9可知,MIRA-LFD模擬樣品在鴨源性成分為0.1%時仍能呈現陽性結果,說明模擬樣品的檢測限為0.1%,與熒光定量PCR法結果一致。但是在現場檢測中,膠體金0.1%結果顏色較淺,不易辨別,因此鴨源性成分MIRA-LFD檢測線為1%。
4 討論與結論
等溫擴增技術近幾年的發展非常迅速,在分子檢測領域越來越重要,但是由于相關軟件支持的滯后,引物探針的設計還停留在人工檢索階段。MIRA-LFD檢測方法源于RPA技術,篩選引物的過程中,不但一些陽性結果出現了大小不一的非特異性條帶,一些空白結果也出現了彌散條帶,后期試驗說明該檢測方法需要找到反應后無非特異性條帶,且在空白對照中特異性條帶的位置上無條帶出現的引物。在篩選引物的過程中,能夠滿足條件的引物較少,為此進行了大量的正交試驗,花費時間較多。
本研究成功篩選出肉制品中鴨源性成分的MIRA-LFD檢測體系的最優引物探針組合,與此同時,對所篩選方法的特異性、檢出限分別進行了評價,證明了該組合所建立的檢測體系特異性強、靈敏度高。通過與現行實驗室檢測方法進行比對試驗,進一步驗證了該方法實際應用的有效性,在實際工作尤其是現場檢測中具有廣闊的應用前景。

