LncRNA-NEF轉錄激活FOXA2并通過抑制β-catenin信號通路抑制肝癌細胞的EMT過程
車軍 楊柳青 孫斌 賈澤博
肝細胞癌(HCC)占原發性肝癌的80~90%,是全世界第四大最常見癌癥相關死亡原因[1]。轉移是癌癥的標志性事件,伴隨轉移細胞獲得了耐藥的能力[2]。研究表明,上皮-間質轉化(EMT)是許多癌癥中促進轉移的關鍵步驟[3],而其逆過程,即間充質-上皮轉化(MET)則可能有利于轉移抑制或降低癌細胞耐藥性[4]。在EMT過程中,上皮細胞失去其與基底的連接,喪失頂-基極性,并通過一系列的信號轉導過程,形成侵襲性表型[5]。研究表明,EMT的標志性特征是上皮性標志物E-cadherin蛋白的丟失,伴隨間充質性標志物Vimentin和Snail等蛋白表達的增加。當腫瘤細胞獲得侵襲性間充質性表型時,它們的運動性和侵襲性增加,有利于其從局部擴散并滲透到血管中[6]。因此,靶向和逆轉腫瘤細胞的EMT過程,實現MET,可能將有效減緩腫瘤細胞的侵襲和遠端擴散[7-9]。已有大量研究揭示,Snail、TWIST、Slug和FOXA2均參與調節EMT過程[5]。FOXA2是其中一種關鍵的EMT抑制性轉錄因子,但其調節癌癥轉移的分子機制仍不清楚。最近已有研究顯示,lncRNA-NEF能以順式作用方式直接調節其基因組鄰近基因FOXA2的轉錄[10]。但lncRNA-NEF是否能夠通過FOXA2抑制EMT過程,以及其抑制EMT的何種信號通路,目前仍不十分清楚。在本研究中,筆者證實了lncRNA-NEF通過順式作用方式轉錄激活FOXA2并通過抑制β-catenin信號通路抑制肝癌細胞的EMT過程。
資料與方法
一、肝癌和癌旁組織來源
收集2018至2019年醫院肝癌患者手術切除的肝癌及癌旁組織10對。經患者和醫院倫理批準同意后,采用上述組織進行研究。
二、肝癌細胞系細胞培養和藥物處理
永生化的正常肝細胞MiHA、肝癌細胞系Hep3B、Huh7、HepG2、Sk-Hep-1購自ATCC(American Type Culture Collection,美國)。所有細胞系細胞均培養在含有10%胎牛血清(Gibco,美國)、100 IU/mL青霉素和100 μg/mL鏈霉素(Sigma-Aldrich,德國)的DMEM培養液(Gibco,美國)中,培養于37 ℃ 5% CO2孵育箱。Hep3B細胞接種于6-孔板里,TGF-β處理組加入2 ng/mL的TGF-β(Sigma-Aldrich,德國),處理72 h[11];對照組加入等體積的生理鹽水。
三、載體構建和轉染
構建FOXA2過表達的載體pcDNA3.1(+)購自南京金斯瑞生物科技(南京,中國)。采用Lipofectamine 3000(賽默飛世爾,美國)進行轉染。
四、實時熒光定量PCR檢測
組織和細胞的總RNA,采用動物組織總RNA提取試劑盒(DP431,天根生化)進行提取。反轉錄RT-PCR采用lnRcute lncRNA cDNA第一鏈合成試劑盒(去基因組)(貨號KR202,天根生化)和FastKing一步法除基因組cDNA第一鏈合成預混試劑(貨號KR118,天根生化)進行。實時熒光定量PCR引物見表1。
五、檢測
組織和細胞的總蛋白采用RIPA裂解液(89900,賽默飛世爾)提取。一抗抗體分別為E-cadherin小鼠抗人單抗(貨號14472,CST),Vimentin兔抗人單抗(貨號5741,CST),Snail兔抗人單抗(貨號3879,CST),FOXA2兔抗人單抗(貨號8186,CST),p-β-catenin(phospho Y228)兔抗人單抗(貨號ab32403,ABCam),Total β-catenin兔抗人單抗(貨號ab223075,ABCam),CCND1兔抗人單抗(貨號ab16663,ABCam),CD44兔抗人單抗(貨號ab189524,ABCam),VEGF兔抗人單抗(貨號ab150375,ABCam),β-actin小鼠抗人(貨號ab8226,ABCam)。

表1 實時熒光定量PCR引物列表
六、統計學分析
采用GraphPad Prism 8.0軟件進行統計學分析,計量數據以平均值±標準差的形式表示。比較兩組間差異,采用的統計學方法為t檢驗,比較多組間差異,采用的統計學方法為One-way ANOVA。當P<0.05時為具有統計學差異。
結 果
一、LncRNA-NEF在肝癌組織中和肝癌細胞中的表達
lncRNA-NEF在肝癌組織中的表達水平為0.28±0.09,在癌旁組織中表達水平為1.05±0.34,差異具有統計學意義(t=3.792,P<0.05)。lncRNA-NEF與FOXA2 mRNA在Hep3B細胞、Huh7細胞、HepG2細胞、Sk-Hep-1細胞中的表達水平明顯低于MiHA細胞(永生化的正常肝細胞,作為對照組),差異具有統計學意義(P<0.05)。見表2。
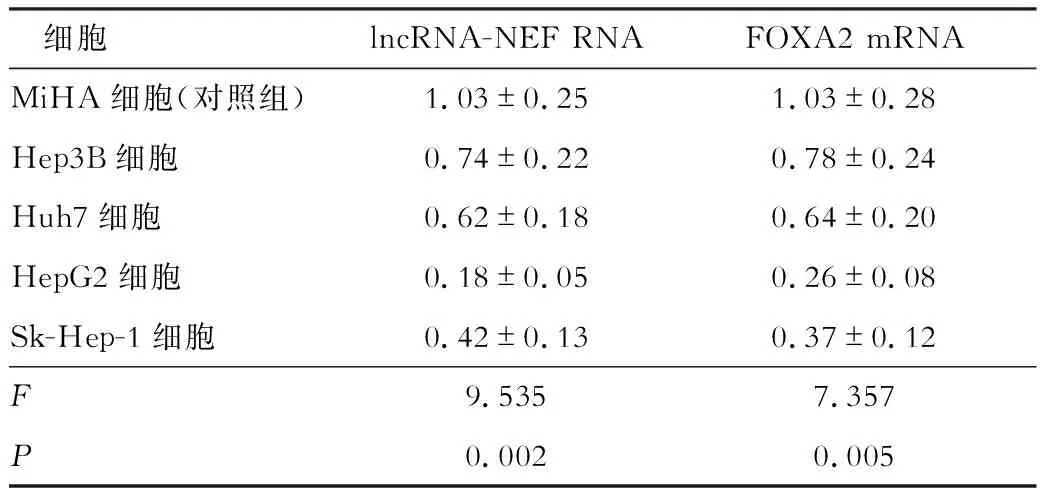
表2 各細胞中lncRNA-NEF RNA與FOXA2 mRNA的表達情況對比
二、在體外采用TGF-β處理能引起Hep3B細胞進入EMT轉化并增強其侵襲能力
根據上述實驗結果,Hep3B細胞是相對高表達lncRNA-NEF和FOXA2的,使用TGF-β處理(2 ng/mL,處理72 h)Hep3B細胞,使其進入EMT轉化,實驗分組為對照組(NC)和TGF-β處理組(TGF-β)。檢測Hep3B細胞內E-cadherin、Vimentin、Snail蛋白因子的表達量,實驗結果顯示,E-cadherin表達量顯著降低,Vimentin和Snail的表達量顯著升高,差距均具有統計學意義(P<0.05),證明經TGF-β處理后的Hep3B細胞的確出現了間充質細胞的典型特征(圖 1A)。進一步檢測出現間充質細胞典型特征的Hep3B細胞內lncRNA-NEF的RNA和FOXA2的mRNA的表達情況,發現Hep3B細胞進入EMT后,lncRNA-NEF的RNA和FOXA2的mRNA表達均被顯著下調(P<0.05)。為了進一步驗證實驗結果,采用Transwell實驗,檢測對照組和TGF-β處理組的Hep3B細胞的侵襲能力。結果顯示,與對照組相比,TGF-β處理組的細胞侵襲能力顯著增強(P<0.05)(圖 1B)。具體數據見表3。

(A)檢測Hep3B細胞內E-cadherin、Vimentin、Snail蛋白因子的表達量;(B)采用Transwell實驗檢測了2組細胞的體外侵襲能力
三、在體外過表達FOXA2能引起HepG2細胞進入MET轉化并降低其侵襲能力
HepG2細胞是相對低表達lncRNA-NEF和FOXA2的,采用過表達FOXA2的策略,向HepG2細胞中轉染pcDNA3.1-FOXA2質粒,使細胞進入MET轉化。實驗分組為對照組(NC)和pcDNA3.1-FOXA2轉染組(pcDNA3.1-FOXA2)。首先檢測FOXA2的mRNA和蛋白質的表達水平,結果顯示,與對照組相比,pcDNA3.1-FOXA2轉染組細胞的確過表達了FOXA2(P<0.05,圖2A)。隨后檢測HepG2細胞內E-cadherin、Vimentin、Snail蛋白因子的表達量,結果顯示,與對照組相比,E-cadherin表達量顯著升高、Vimentin和Snail的表達量顯著降低,差距均具有統計學意義(P<0.05,圖2B),證明轉染了pcDNA3.1-FOXA2質粒后的Hep3B細胞的確出現了上皮細胞的典型特征。檢測lncRNA-NEF的RNA表達水平,發現lncRNA-NEF的RNA表達水平顯著升高。為了進一步驗證細胞的確進入了MET轉化,采用Transwell實驗,檢測了對照組和pcDNA3.1-FOXA2轉染組的HepG2細胞的侵襲能力。結果顯示,與對照組相比,pcDNA3.1-FOXA2轉染組的細胞侵襲能力顯著降低(圖2C)。具體數據見表3。

表3 Hep3B細胞蛋白因子、lncRNA-NEF RNA、FOXA2 mRNA的表達量與體外侵襲能力
四、LncRNA-NEF和FOXA2通過抑制β-catenin信號通路抑制肝癌細胞的EMT過程
采用Western blot技術,檢測了對照組(NC)和TGF-β處理組(TGF-β)的Hep3B細胞(圖 3A)以及對照組(NC)和pcDNA3.1-FOXA2轉染組的HepG2細胞(圖 3B)中磷酸化的β-catenin(p-β-catenin)、總β-catenin,以及β-catenin信號通路中的關鍵蛋白CCND1、CD44和VEGF蛋白因子的表達量情況。實驗結果顯示,與對照組相比,TGF-β處理組的Hep3B細胞內磷酸化的β-catenin(p-β-catenin)表達量顯著增高(P<0.05),而總β-catenin蛋白水平不變。隨后檢測的β-catenin信號通路下游蛋白CCND1和CD44在TGF-β處理組表達被上調,以及VEGF在TGF-β處理組表達被下調(P<0.05)。與對照組相比,pcDNA3.1-FOXA2轉染組的HepG2細胞內磷酸化的β-catenin(p-β-catenin)表達量顯著降低(P<0.05),而總β-catenin蛋白水平不變。隨后檢測的β-catenin信號通路下游蛋白CCND1和CD44在過表達FOXA2組表達被下調,以及VEGF在過表達FOXA2組表達被上調(P<0.05)。具體數據見表4。
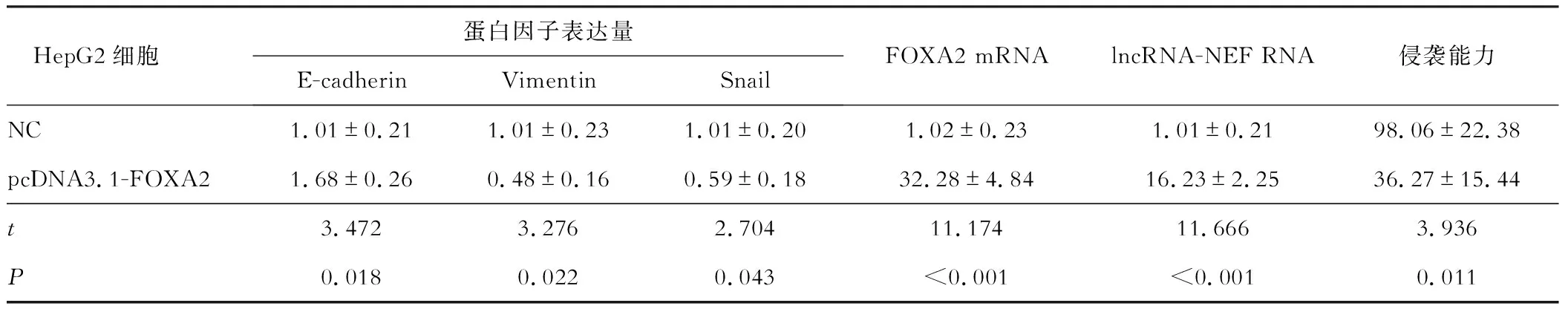
表3 HepG2細胞蛋白因子、lncRNA-NEF RNA、FOXA2 mRNA的表達量與體外侵襲能力

(A)檢測FOXA2的蛋白質表達水平;(B)檢測HepG2細胞內E-cadherin、Vimentin、Snail蛋白因子的表達量;(C)采用Transwell實驗檢測了兩組細胞的體外侵襲能力

表4 細胞中p-β-catenin、Total-β-catenin、CCND1、CD44和VEGF的表達量
討 論
EMT是研究從良性腫瘤向惡性癌癥演變過程中信號轉導機制的有效模型,但對廣泛參與癌癥發生、發展的lncRNAs是如何在EMT過程中調節信號轉導網絡的,人們仍知之甚少。本研究結果顯示,肝癌組織中lncRNA-NEF和FOXA2的RNA表達水平均顯著降低;在肝癌細胞中,lncRNA-NEF表達水平相對較低的細胞,FOXA2的RNA表達量也相對較低,lncRNA-NEF表達水平相對較高的細胞,FOXA2的RNA表達量也相對較高。這驗證了之前的報道,即lncRNA-NEF和FOXA2的作用方式是順式的[10]。另外,在肝癌細胞系HepG2細胞中過表達FOXA2能夠顯著升高lncRNA-NEF的RNA水平,也進一步驗證了這一結果。同時結果還顯示,與對照組相比,TGF-β處理組的Hep3B細胞lncRNA-NEF和FOXA2的RNA和FOXA2的蛋白表達水平均顯著降低,侵襲能力顯著增強,而過表達FOXA2的HepG2細胞lncRNA-NEF和FOXA2的RNA和FOXA2的蛋白表達水平均顯著增高,侵襲能力顯著減弱,證明了lncRNA-NEF和FOXA2的確參與了肝癌細胞的EMT轉化。之前文獻報道,在小鼠模型中,激活的β-catenin信號通路,能夠負調控FOXA2的表達[12]。因此,本研究檢測磷酸化的β-catenin(p-β-catenin)、總β-catenin,以及β-catenin信號通路中的關鍵蛋白CCND1、CD44和VEGF蛋白因子的表達量情況,結果顯示,TGF-β處理組能夠誘導Hep3B細胞進入EMT轉化并激活β-catenin信號通路;與此相反,過表達FOXA2能夠誘導HepG2細胞進入MET轉化并抑制β-catenin信號通路。這些結果證實,lncRNA-NEF和FOXA2是通過抑制β-catenin信號通路來抑制肝癌細胞的EMT過程的。
盡管腫瘤早期診斷標記物的研究領域在迅速發展,但大多數HCC患者被發現時,通常已是晚期,治療方案的可選擇性有限且臨床預后不良。在HCC中晚期患者中,腫瘤轉移一直是嚴重威脅患者長期生存的主要危險因素。根據本研究的結果,lncRNA-NEF可被認為是EMT的候選抑制劑,lncRNA-NEF的增強表達可顯著減弱癌癥的轉移,這也為進一步研究lncRNA-NEF作為HCC患者的治療靶標,提供了可靠的基礎研究證據。

