PTCD序貫經皮腎鏡在介入術后難治性肝膿腫治療中的應用
段昌虎 劉曉晨 丁建龍 段建峰
肝動脈介入栓塞術在中晚期肝癌、肝癌術后復發、肝轉移瘤等惡性腫瘤中有著舉足輕重的作用,可抑制腫瘤生長、延長患者生存期[1,2]。此外,在外傷性肝破裂、腹腔出血等良性疾病中也有重要的作用,如外科術后腹腔出血可急診行腹腔動脈造影及介入栓塞止血,但是肝動脈介入也會出現一些相應的并發癥,其中介入術后肝膿腫是比較少見、但極其難治的并發癥,病死率為13.3%~50%[3]。本文回顧性分析5例肝動脈介入術后難治性肝膿腫患者的臨床表現、治療、轉歸等。
資料與方法
一、 一般資料
2018年1月至2021年3月西安交通大學附屬三二〇一醫院收治的行肝動脈介入栓塞術后發生難治性肝膿腫5例。病例1為胰腺癌胰十二指腸切除術后1年3月余,復查提示肝右葉轉移瘤,行肝動脈介入栓塞化療后出現肝臟巨大膿腫,反復行超聲引導下穿刺置管引流及CT下更換引流沖洗,病程持續3月余,引流效果欠佳,患者仍出現間斷寒戰、高熱,后經超聲置管處行竇道擴張及經皮腎鏡肝膿腫壞死組織清除引流。病例2為原發性巨塊型肝癌伴2型糖尿病,行3次肝動脈介入化療栓塞術后出現肝右葉巨大膿腫,經消炎、反復穿刺引流效果欠佳,入院后行超聲置管處竇道擴張及經皮腎鏡肝膿腫壞死組織清除引流。病例3、4為閉合性腹部損傷、3級及4級創傷性肝破裂、腹腔大量積血,行肝動脈介入栓塞后出現肝臟巨大膿腔,經消炎、穿刺引流后仍有寒戰、高熱,行超聲置管處竇道擴張及經皮腎鏡肝膿腫壞死組織清除引流。病例5為結腸癌術后4年肝右葉轉移瘤,行肝動脈介入栓塞術后,腫瘤滅活,但同時出現難治性肝膿腫,穿刺引流效果欠佳,后行經皮腎鏡肝膿腫壞死組織清除(見表1)。
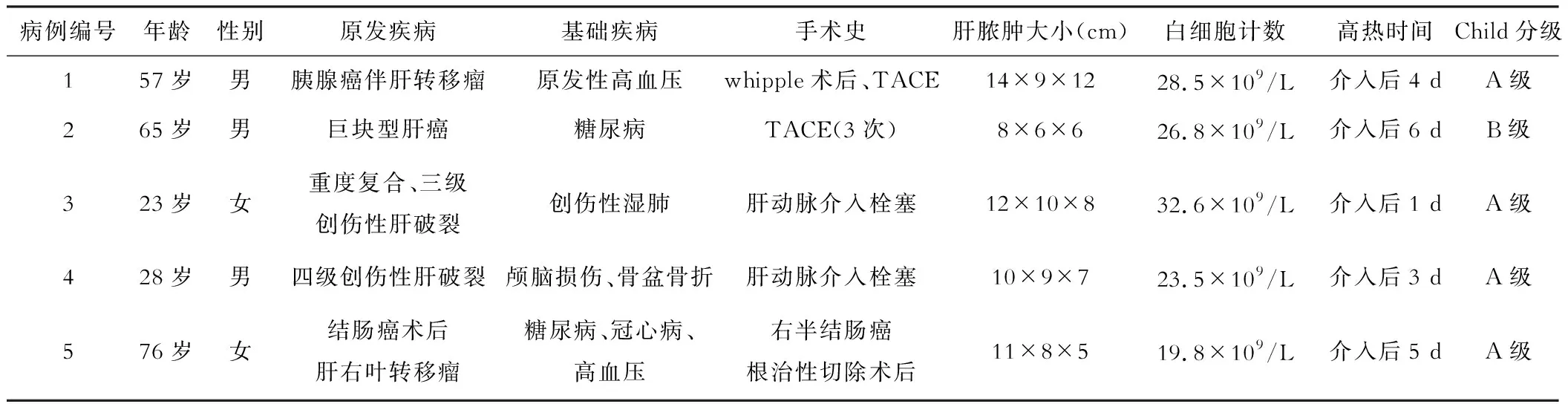
表1 5例難治性肝膿腫患者一般資料
二、治療方法
在治療3例肝臟腫瘤患者原發病的同時(胰腺癌肝轉移瘤行正規白蛋白紫杉醇聯合吉西他濱化療;原發性肝癌患者予以抗病毒、保肝治療;結腸癌肝轉移行全身經脈化療),針對肝臟腫瘤或肝轉移瘤行介入栓塞治療,術中均將微導管頭端超選至腫瘤供血動脈近端,栓塞面積均≥80%,化療藥物為5-氟尿嘧啶、表柔比星,常規碘化油栓塞;栓塞后患者出現寒戰、發熱不適,體溫最高達39.5~40 ℃,伴有乏力、納差,經驗性使用美羅培南抗感染治療,后根據藥物敏感試驗調整抗生素;復查腹部超聲等提示肝膿腫伴膿腔內氣化、壞死,予以介入超聲引導下行經皮肝穿刺膽道穿刺置管(PTCD)后沖洗引流療效欠佳,反復調整、沖洗引流管后患者癥狀改善不明顯,后行經皮腎鏡肝膿腫壞死組織清除引流,癥狀明顯改善。
另兩例患者系外傷后導致的創傷性肝破裂,病例3為三級肝破裂(血腫占肝臟表面積的50%以上,撕裂深度超過3 cm),病例4為四級肝破裂(肝實質破裂,累及30%的肝臟),入院后生命體征尚平穩,血壓偏低,考慮腹腔大量出血,急診行腹腔動脈造影及肝動脈介入栓塞術,術后介入超聲留置腹腔穿刺引流管,引出腹腔積血及膽汁后,患者出現寒戰、高熱,行超聲復查提示肝右葉膿腫,行PTCD穿刺置管沖洗引流聯合抗生素抗感染治療效果欠佳,后續反復調整、沖洗引流管后患者癥狀改善不明顯,行經皮腎鏡肝膿腫壞死組織清除引流,癥狀明顯改善。
結 果
5例患者介入術后1~6 d出現寒戰、高熱不適,體溫最高達39.5~40 ℃,伴有乏力、納差等全身癥狀,血常規提示白細胞和(或)中性粒細胞比值明顯升高,根據經驗用藥給予廣譜抗感染藥物,并進行保肝及營養支持治療,得到藥物敏感試驗結果后,及時更換敏感的抗生素。在影像檢查確定膿腫形成并有膿腔液化后,及時行PTCD,經引流管沖洗引流,療效欠佳,反復調整、沖洗引流管后患者癥狀改善不明顯,后行經皮腎鏡肝膿腫壞死組織清除引流,癥狀明顯改善。
5例患者均為先行肝膿腫經皮穿刺置管引流,引流不暢或膿腔進行性增大、患者癥狀改善不明顯后,病例1經2次經皮腎鏡肝膿腫壞死組織清除引流;病例3、4經過1次腎鏡清理;病例2、5行3次經皮腎鏡肝膿腫壞死組織清除引流,患者術中無明顯出血,病例1術后出現膽瘺,經通暢引流1周后,均達到治愈的效果。
病例1行靜脈化療的同時,針對肝轉移瘤行TACE,術后第4天開始出現寒戰、高熱,復查腹部CT提示肝膿腫,大小為7 cm×4 cm(圖1),行超聲引導下肝膿腫穿置管引流,抽出咖啡色渾濁液體約50 mL后癥狀稍改善,予以抗感染、沖洗引流管,帶引流管好轉出院。出院后患者間斷寒戰、發熱,引流管未見液體引出,復查腹部CT提示膿腔進行性增大,膿腔為10 cm×10 cm(圖2),遂行CT引導下留置沖洗管及引流管,引流3 d后未見膿液引出,反復行膿腔超聲引導下更換引流管沖洗引流,患者仍有寒戰、高熱,復查腹部CT提示膿腔14 cm×8.7 cm(圖3),但引流管位置良好,考慮膿腔內大量壞死粘稠物質堵塞引流管,遂行全麻下經皮腎鏡肝膿腫壞死組織清除引流術,術中經原肝膿腫穿刺引流管竇道處依次置入16#、18#及20#剝皮鞘擴張竇道,至肝膿腫腔,經腎鏡直視下沖洗膿腔,見大量帶有惡臭的灰黃色渾濁膿液流出,膿腔鹽水沖洗干凈后用腎鏡下活檢鉗直視下夾出大量壞死組織及黃色膿性絮狀物(圖4),邊夾除邊沖洗直至壞死物及膿腔清理干凈,于膿腔內留置18#引流管一根,術后引流通暢,患者未再出現寒戰、發熱,1周后復查膿腔明顯縮小為8.8 cm×5.8 cm,再次同法清理膿腔,1周后復查提示膿腔基本消失(圖5),治愈出院,復查CA199降至正常水平。
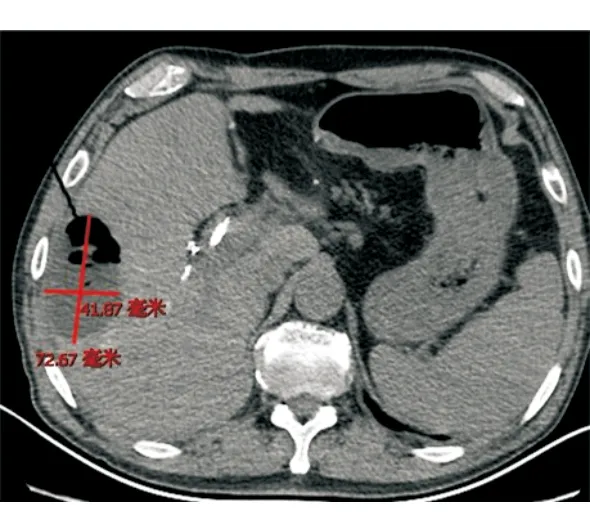
圖1 胰腺癌肝轉移瘤患者介入術后肝膿腫
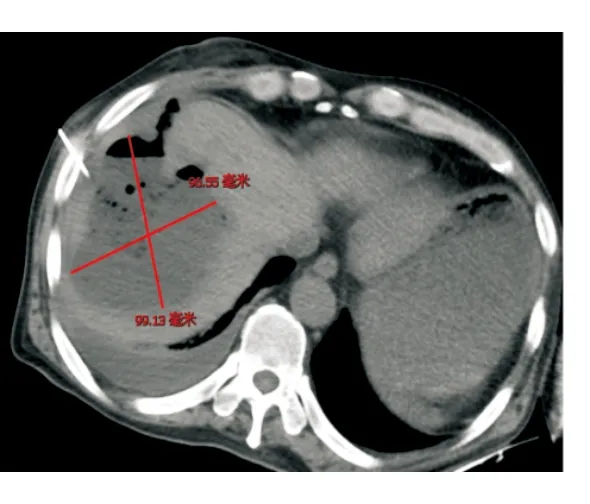
圖2 超聲引導置管引流術后膿腔增大
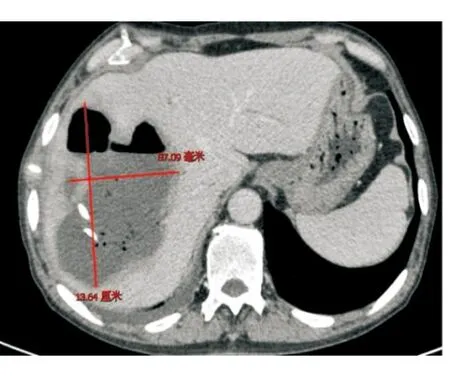
圖3 更換CT置管引流膿腔進行性增大
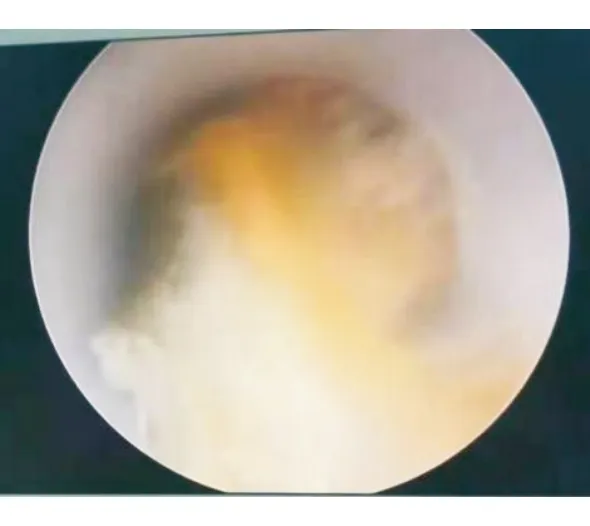
圖4 經皮腎鏡清理膿腔內膿性絮狀物
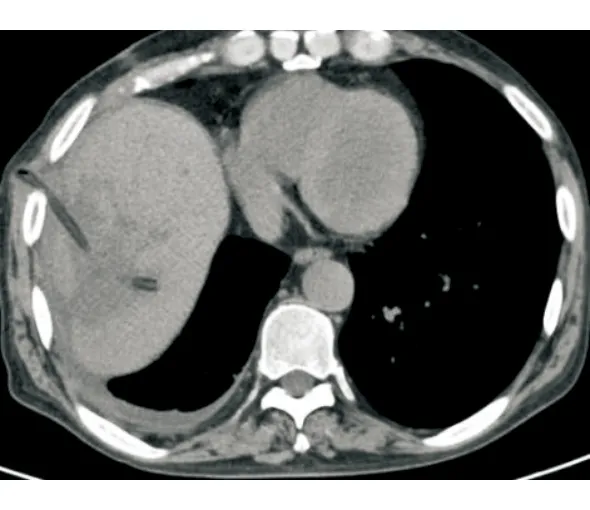
圖5 腎鏡清理2次后膿腔基本消失
討 論
文獻報道,在原發性肝癌中,TACE/TAE后肝膿腫的發生率為0.2%~4.5%[4-6]。介入術后形成肝膿腫的原因:與接受雙重血液供應的肝實質相反,膽管系統和膽管周圍毛細血管叢的主要供血來源于肝動脈的伴隨分支,因此,與肝細胞相比,膽道系統更容易發生缺血性損傷,TACE不僅可以阻斷腫瘤供血動脈,還可以減少膽管周圍毛細血管叢內皮細胞的數量,對膽道系統造成繼發性化學性和缺氧缺血性損傷,并最終形成局部膿腫[7]。文獻報道,女性患者介入治療后發生肝膿腫的可能性更大[6]。通過改善患者貧血和低蛋白血癥、控制血糖、增加抵抗力與免疫力、降低膽道受損、改善肝功能、保證介入治療中腫瘤充足供血有利于避免介入治療后肝膿腫.
超聲或CT穿刺置管引流聯合抗生素的使用對大部分肝膿腫治療是有效的,但是針對穿刺置管引流聯合抗生素治療效果欠佳,需要外科手術進一步干預治療的肝膿腫稱為難治性肝膿腫[8,9]。難治性肝膿腫有以下特點:①應用抗生素及穿刺引流后仍存在反復寒戰、高熱;②影像資料提示肝膿腫壁厚、膿腔內呈蜂窩狀、多發間隔;③膿腔內壞死組織粘稠、引流不通暢;④反復調整引流管后仍難以達到通暢引流的目的。
本研究通過PTCD序貫經皮腎鏡肝膿腫壞死組織清除引流治療難治性肝膿腫,取得了滿意的效果。有如下經驗供大家分享:1.常規的肝膿腫首選介入超聲引導下穿刺沖洗置管引流聯合抗感染可達到滿意效果,但是因為介入術后形成的難治性肝膿腫腔內大量壞死粘稠組織引流不暢、穿刺引流效果差、既往有腹部手術史無法行腹腔鏡手術治療、預計需要多次清理的患者,PTCD序貫經皮腎鏡肝膿腫壞死組織清除引流為一種可供選擇的方法;2.選擇經皮腎鏡的優點有以下5點,①直觀:在腎鏡下操作,用活檢鉗徹底清除膿腔內的膿絮狀壞死組織,聯合沖洗泵可邊沖洗膿腔、邊清理膿腔內的壞死組織,正是這些壞死的膿絮狀組織堵塞引流管導致引流不暢,但是需要注意的是沖洗泵的壓力不可過高,避免壓力過高導致膿腔完整性破壞,膿液播散入腹腔,引起感染性休克;②避免了盲目操作引起的出血風險;③視野更加開闊:可以通過轉動腎鏡的角度,對分隔的病灶進行打通,徹底通暢引流;④微創:傳統開腹手術的創傷大、花費高、恢復時間長、風險高,本方法微創、痛苦小、花費少;⑤可重復性強:本文報道的5例患者,2例行1次清理,1例患者行2次清理,2例行3次清理,簡單易行。3.術中需要注意保護肝膿腫膿腔壁的完整性,以避免膽瘺、出血及感染播散的發生;5例患者中,1例術后出現了膽瘺,考慮系膿腔壁與膽管相通,因既往胰十二指腸手術史,無法再行ERCP膽道支架等減壓操作,后續經通暢引流后,膽瘺自行愈合;1例有少量出血,通過留置的引流管壓迫即可自行止血。
綜上所述,PTCD序貫經皮腎鏡在介入術后難治性肝膿腫治療中具有微創、直觀、可重復性強等優點,值得推廣。

