基于摻氮碳點的比率熒光法檢測人體血清中的尿酸
邱 萍,黎 帆,何田爽
(南昌大學化學學院,江西 南昌 330047)
尿酸是人體中普遍存在的生物分子。由于人體中缺少催化尿酸氧化的尿酸氧化酶[1],所以它也是嘌呤代謝的最終代謝物之一。正常生理條件下,人體血清中尿酸濃度為120~460 μmol·L-1,而在尿中為1.4~4.4 μmol·L-1[2-3]。體液里的尿酸含量維持在健康水平是極為重要的,因為尿酸的異常濃度可以引起或反映出許多疾病。比如高尿酸水平會增加心血管疾病、痛風、原發性高血壓、腎臟疾病、帕金森病等疾病的風險[4-7]。并且,極低的尿酸濃度可能會導致多發性硬化癥[8]。
因此,開辟一條快速、靈敏的檢測尿酸的途徑是具有意義重大的。到目前為止,已有多種技術用于尿酸的定量分析,如高效液相色譜[9]、熒光[10]、電化學技術[11]、紫外吸收[12]、比色法[13]、化學發光[14]、表面增強拉曼光譜[15]等。光分析法以其靈敏度高、快速和簡便優點引起了人們的廣泛關注。其中,比率熒光技術能得到的定量結果更為可靠[16],不失為一個較好選擇。由于比率分析法可以通過建立兩組不同的信號,從而有效地使變量歸一化。這可以有效地減少儀器和環境的影響,特別是在復雜的生物環境中,提高信噪比,以此來使定量更加可靠[17]。要獲得雙發射信號,可以通過比較探針和產物的熒光來實現。碳點是一種新興的碳基納米材料,具有熒光強度高、光學穩定性好、合成操作簡單、毒性低、生物相容性好等優點[18]。根據文獻報道,摻雜是控制納米材料性能的優良策略[19]。胺分子作為表面鈍化劑和氮摻雜源,在合成碳點過程中加入胺分子合成摻氮碳點,這種方法可以改善碳點本身的光學和電學性能。
據此,我們建立了基于氮摻雜碳點(N-CDs)的比率熒光法,利用2,3-二氨基吩嗪(DAP,產物)與碳點(探針)的熒光強度比(I580/I427)檢測尿酸。在傳感分析中,碘化物較為常見,價格低廉,具有類過氧化物酶活性[20,21],是一種理想的過氧化物酶模擬試劑。基于此,在I-存在下,由尿酸產生的H2O2催化生成羥基自由基(·OH),進而氧化鄰苯二胺(OPD)生成DAP。DAP利用內濾光效應(IFE)猝滅了N-CDs在427 nm處的熒光發射,并在580 nm處產生新峰。我們采用DAP與N-CDs的熒光強度比(I580/I427)可實現實際樣品中尿酸含量的定量分析。
1 實驗部分
1.1 試劑與儀器
尿酸、尿酸酶、尿素、葡萄糖、肌酐、多巴胺和谷胱甘肽購自西格瑪奧德里奇貿易有限公司。鄰苯二胺、組氨酸和苯丙氨酸來源于上海麥克林生化科技有限公司。二亞乙基三胺來自TCI上海化工發展有限公司。所使用的化學品都是分析純,整個實驗過程中都使用超純水。
熒光光譜由日立F-4600熒光光譜儀(日本)在330 nm的激發下獲得。紫外-可見吸收光譜來自安捷倫Cary 8454紫外-可見分光光度計(美國)的記錄。粒徑分布由布魯克海文粒度分析儀(美國)測得。熒光壽命曲線采用愛丁堡穩態瞬態熒光光譜儀FLS1000(英國)得到。
1.2 N-CDs的合成
N-CDs是采用水熱法制備[22]。首先將1.2 g檸檬酸完全溶解在20 mL的超純水中。0.15 mL二亞乙基三胺加入到上述混合液中,隨后超聲15 min。將混合完的溶液轉移到50 mL的聚四氟乙烯內襯的不銹鋼高壓釜中,置于200 ℃烘箱里反應14 h。冷卻至室溫后取出,由此產生的褐黃色產品是通過透析膜透析時間超過3 d得到的。最后,通過冷凍干燥法得到粉末狀的N-CDs,并在室溫下保存。
1.3 尿酸檢測
將50 μL不同濃度的尿酸標準液和50 μL尿酸酶(100 μg·mL-1)依次加入100 μL Britton-Robinson緩沖液(pH 8.5)中。混合物在37 ℃下穩定15 min后,再依次加入200 μL OPD(25 mmol·L-1),200 μL I-(14 μmol·L-1),60 μL N-CDs溶液(400 μg·mL-1)和1 340 μL磷酸鹽緩沖液(pH 5.5)。在45 ℃下,再恒溫反應30 min。在330 nm激發下進行比率熒光分析,激發和發射模式下的狹縫寬度均為5.0 nm。
1.4 實際樣品的處理
取南昌大學第四附屬醫院提供的血清樣,4 000 r·min-1離心15 min,提取上清液,用磷酸鹽緩沖液稀釋5倍備用。同時,我們采用生化分析儀對該血清樣進行了檢測,以便進一步驗證結果。在該法中,血清樣品在4 000 r·min-1下離心3 min,取上清液(5.6 μL)將尿酸酶、4-氨基安替比林(4-AAP)和3-二苯胺二鈉鹽(MADB)混合。然后,用分析儀在660/800 nm波長下進行測定。
2 結果與討論
2.1 N-CDs的表征
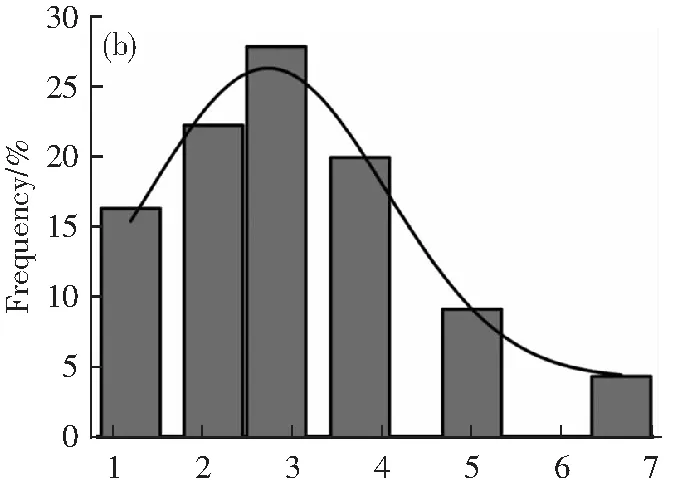
通過透射電鏡對合成的N-CDs的形貌和尺寸進行了分析。從圖1a中可以看出,N-CDs呈均勻的球形,在水溶液中具有良好的分散性,平均粒徑大約為2.8 nm(圖1b)。其中,高分辨透射電鏡圖顯示N-CDs的晶格間距為0.21 nm。通過紅外分析(圖1c)對所制備的N-CDs鍵合方式和結構進行了表征。·OH拉伸振動在3 429 cm-1處產生了較寬的吸收帶。此外,在2 900 cm-1附近的峰值歸因于C-H烷基的伸縮振動。在1 681 cm-1處有明顯的峰,表明N-CDs表面存在C-O鍵。1 581和1 425 cm-1以及1 028 cm-1處的吸收帶分別對應于C-C和C-N以及C-O振動帶。說明已成功合成了N-CDs。
2.2 N-CDs的光學性質
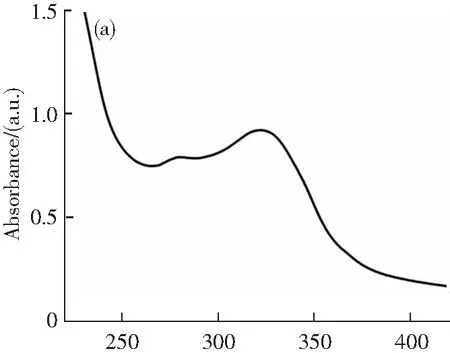
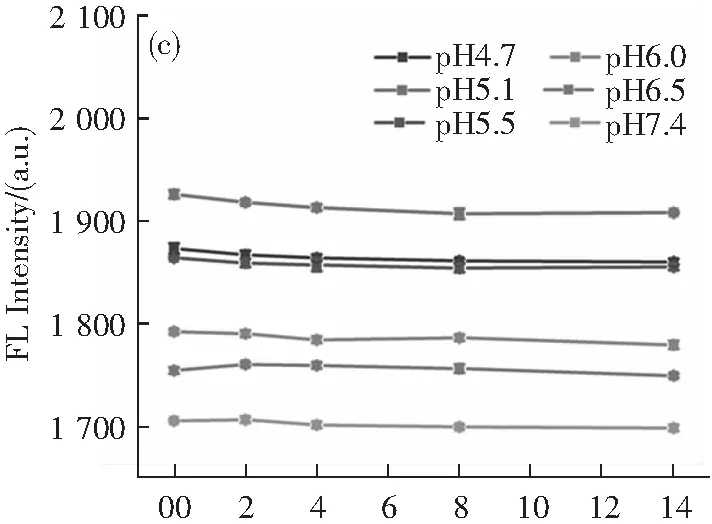
圖2a為制備的N-CDs的紫外-可見吸收光譜。在277和321 nm處有兩個明顯的吸收峰,分別與碳sp2的π-π*躍遷和C=O帶的n-π*躍遷有關。同時可以看出,N-CDs的發射峰由激發波長決定(圖2b)。這種依賴激發峰的特性是由帶隙中的新能級引起的。當激發波長從290增加到360 nm時,發射峰出現紅移。激發波長為330 nm時,N-CDs的發射峰最強中心為430 nm。此外,它也具有良好的熒光穩定性。從圖2c可以看出,在不同pH值的磷酸鹽緩沖溶液(4.7~7.4)中,N-CDs的熒光強度在14 d內并沒有明顯下降。因此,合成的N-CDs是可以用于接下來的實驗。

Diameter/nm
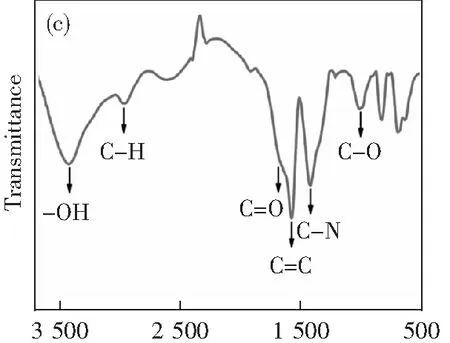
λ/cm-1圖1 N-CDs的TEM(a);粒徑分布圖(b);紅外表征圖(c)
λ/nm
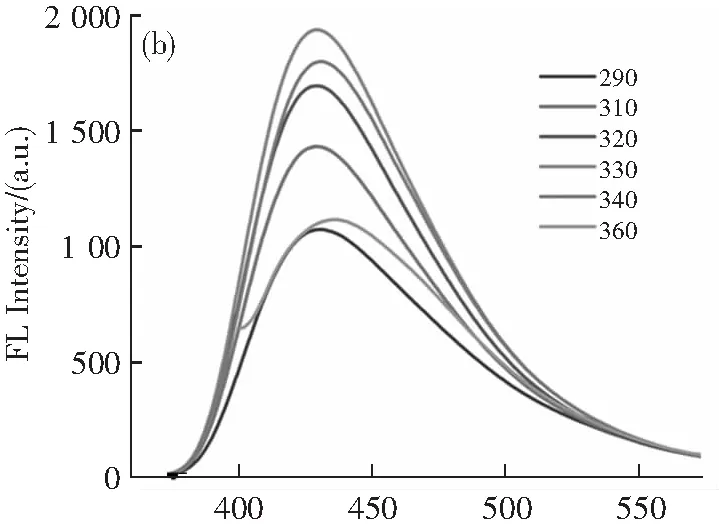
λ/nm
t/d圖2 N-CDs的光學性質
2.3 檢測原理
圖3說明了基于I-和尿酸酶使用N-CDs作為熒光探針的方法基本原理。首先,尿酸酶催化尿酸(UA)生成H2O2。OPD在H2O2存在下可被I-催化氧化生成產物DAP。在330 nm的激發波長下,生成的DAP可以在427 nm處猝滅N-CDs體系中的熒光發射,而在580 nm(DAP所產生的熒光峰位)處發射熒光增強,導致不同UA濃度下的熒光發生變化。最后,利用DAP/N-CDs的熒光強度比(I580/I427)測定UA的濃度。
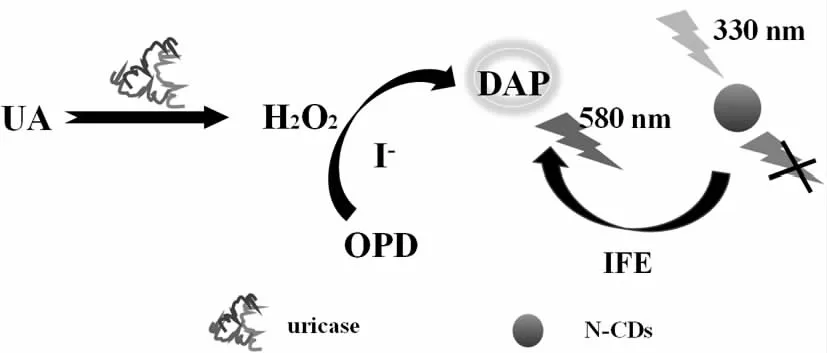
圖3 比率熒光法的檢測原理
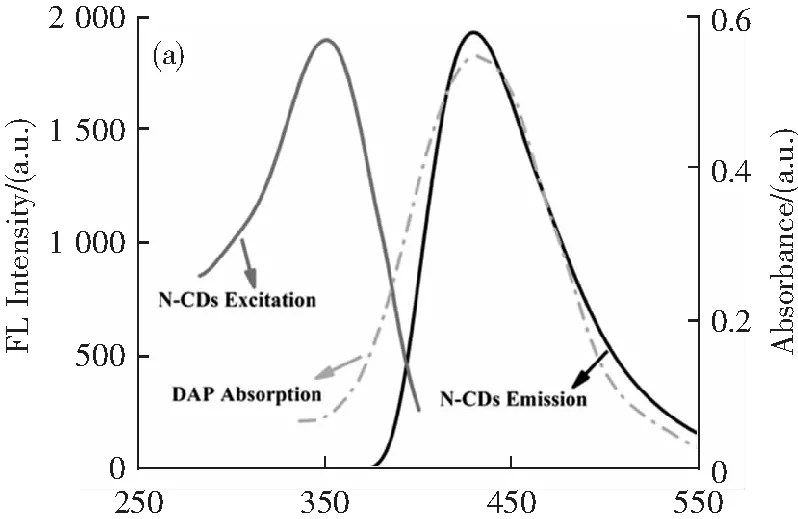
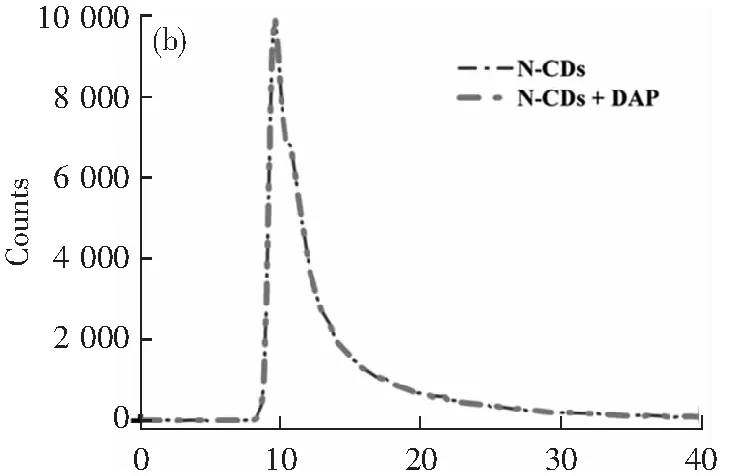
為了研究OPD誘導N-CDs熒光猝滅的可能機理,進行了幾種測定。如圖4a所示,DAP的吸收光譜不僅在427 nm處與N-CDs的發射光譜有很大的覆蓋區域,而且在330 nm處與激發光譜有重疊,這說明可能存在內濾光效應(IFE)或者F?rster-resonance-energy轉移(FRET)。為了探究這一機理,我們同時測量了N-CDs在沒有DAP和存在DAP的情況下的熒光壽命。結果顯示,熒光壽命沒有明顯變化(圖4b),說明N-CDs與DAP之間沒有發生能量轉移過程。在圖4c中,DAP和N-CDs的zeta電位分別為-1.1和-2.6 mV。結果表明,DAP和N-CDs的zeta電位均為帶負電,證實DAP和N-CDs之間幾乎不存在靜電吸引。此外,由于相同電荷之間發生靜電排斥,N-CDs與DAP之間的距離往往大于10 nm。我們都知道,在FRET的情況下,熒光供體與受體之間的距離應不超過10 nm。因此,上述結果表明,DAP利用IFE猝滅了N-CDs的熒光發射。
λ/nm
t/ns
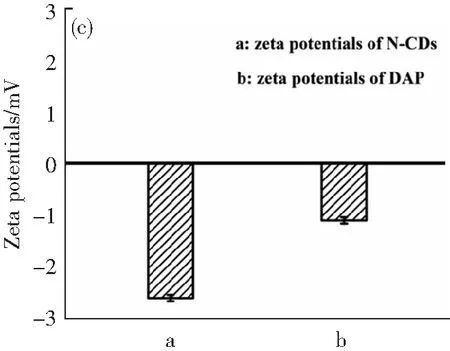
圖4 OPD的氧化物猝滅N-CDs的機制
2.4 實驗條件的優化
相關反應條件的優化對于提高傳感器的靈敏度具有重要作用。根據前期工作,我們認為尿酸酶催化尿酸的反應最適宜條件是在pH為8.5的環境中,在35 ℃下孵育15 min[23-24]。隨后我們研究了pH、溫度、培養時間、I-濃度和OPD濃度對DAP/N-CDs(I580/I427)熒光強度比的影響,以分析后續實驗的最佳測試條件。考察pH的影響可以發現最大強度比(I580/I427)在pH為5.5時。因此,后續優化實驗采用最適pH值5.5進行。溫度的影響范圍為25 ℃~55 ℃時,45 ℃為理想溫度。選擇最佳孵育時間為45 min。將I-的濃度從0.2變化到1.6 mmol·L-1,OPD濃度從0.1變化到3 mmol·L-1,可以看到I-的濃度和OPD濃度在1.4和2.5 mmol·L-1時分別獲得最大的發射強度比。
2.5 對尿酸的分析檢測
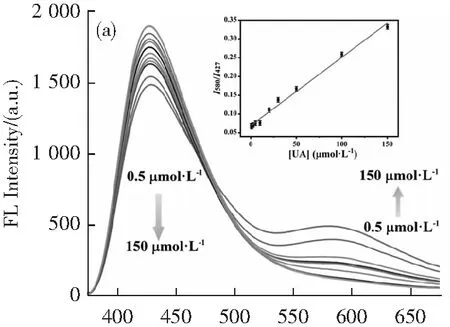
為了證明所提出的生物傳感器的性能,我們在上述最佳條件下探索了尿酸檢測的線性范圍和檢測限。從圖5a可以看出,隨著UA濃度的增加,427 nm處的發射強度(I427)逐漸降低,而580 nm處的發射強度(I580)逐漸增強。在紫外光照射下,熒光光度明顯由藍色變為黃色(圖5b)。不同UA濃度對應的熒光強度比(I580/I427)在0.5~150 μmol·L-1范圍內呈線性關系。線性回歸方程為I580/I427=0.001 82CUA+0.069 37,相關系數(R2)為0.992(圖5a插圖),說明比值熒光法測定尿酸具有良好的線性關系。以3 σ/s(其中σ和s分別代表估計誤差和線性回歸斜率)方法計算出檢測限(LOD)為0.06 μmol·L-1。
λ/nm
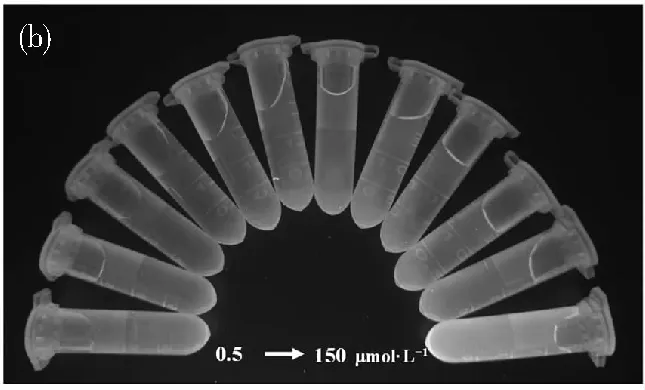
圖5 尿酸的分析檢測
2.6 選擇性實驗
2.7 實際樣品的檢測
采用比率熒光法對血樣進行了分析檢測,結果與生化分析儀檢測結果進行了比較(表1),平均相對誤差為3.3%。本法測定人血清的回收率為94.6%~103.3%,相對標準偏差(RSD,n=3)小于3.6,說明該法具有較好的準確性,在實際應用上有很大的潛能。
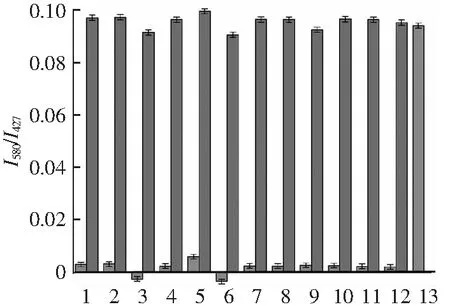
1~13分別代表:(1) NaCl;(2) KNO3;(3) NH4Cl;(4) Urea;(5) AA;(6) Cys;(7) Cr;(8) Glu;(9) DA;(10) GSH;(11) His;(12) Phe;(13) UA。
圖6 選擇性實驗,
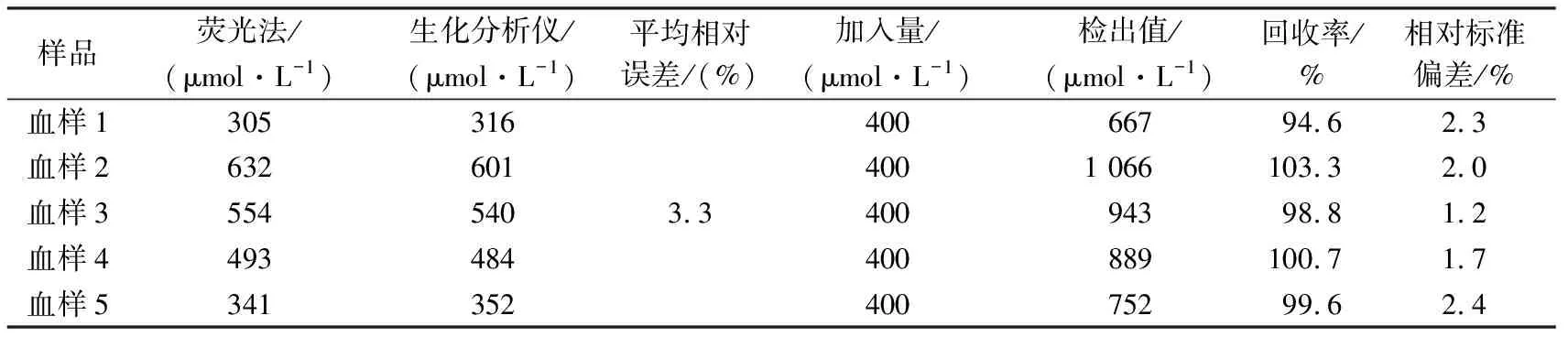
表1 實際樣品的檢測
3 結論
綜上所述,我們成功設計了一種基于N-CDs的比率熒光法測定了人體血清中尿酸含量。使用比率熒光輸出信號,使尿酸水平的定量分析更加可靠。與傳統酶法相比,用碘離子取代辣根過氧化物酶,大大降低了失活風險和成本。N-CDs不需要復雜的合成技術。所制備的N-CDs具有良好的光學性能和穩定性。該法檢測尿酸具有超靈敏、高選擇性和良好的實際應用前景。

