我國醫藥制造業危險廢物產生特性及污染防治分析
姚光遠, 劉玉強, 劉景財, 徐亞*
1.環境基準與風險評估國家重點實驗室, 中國環境科學研究院 2.國家環境保護危險廢物鑒別與風險控制重點實驗室, 中國環境科學研究院
醫藥制造業是關系國計民生的重要產業,是我國“十二五”規劃中確定的朝陽型戰略性新興產業,是《中國制造2025》的重點發展領域,更是推進健康中國建設的重要保障[1]。隨著國民經濟的不斷發展和人民生活水平的不斷提高,醫療保健的意識也不斷增強,極大促進了我國醫藥制造行業的發展。此外,隨著2019年“一帶一路”倡議的全面推進和健康中國行動的全面實施,醫藥制造業將得到持續發展。醫藥制造業的飛速發展導致污染物大量排放,隨之而來的是區域環境風險的增加,這將會制約醫藥制造業的可持續發展。
醫藥制造業是《國家環境保護“十二五”規劃》中要求重點治理的12個行業之一,屬于精細化工行業,具有產品種類多,生產工序復雜,原材料種類多、數量大且原料利用率低等特點。因此醫藥制藥業的“三廢”產量巨大,且成分復雜[2-3]。醫藥制造業產生的危險廢物具有毒性、易燃性、腐蝕性、化學反應性、感染性等危害特性,對生態環境和人體具有極大的潛在危害[4]。國家高度重視生態環境保護工作,《重點行業揮發性有機物綜合治理方案》《重點流域水污染防治規劃(2016—2020年)》以及《“十三五”生態環境保護規劃》中均對醫藥制造業的污染防治工作提出了具體要求[5-7]。筆者對我國醫藥制造業的產排污環節進行分析,系統梳理了其危險廢物的產生特性,并對醫藥制造業危險廢物的污染防治工作提出建議,以期為提高醫藥制造業危險廢物識別能力以及醫藥制造業危險廢物的安全處置提供指導。
1 醫藥制造業現狀
我國是世界醫藥制造大國之一,制藥生產企業遍布全國29個省(自治區、直轄市),2008—2019年我國醫藥制造業主營業務收入和企業數見圖1[8]。從圖1可以看出,醫藥制造業的主營業務收入呈先升高后降低的趨勢,在2016年達到峰值,之后隨著生態環境監管工作持續收緊,生態環境部、工業和信息化部等多部委不斷出臺監管政策,企業進行提質改造,導致其主營業務收入下降。醫藥制造業企業數量呈先增高后降低再升高的趨勢。
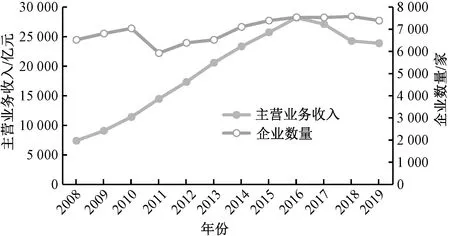
圖1 2008—2019年我國醫藥制造業主營業務收入和企業數量Fig.1 Business income and number of enterprises of pharmaceutical manufacturing industry in China from 2008 to 2019
GB/T 4754—2017《國民經濟行業分類》將藥企分為8類,包括化學藥品原料藥制造、化學藥品制劑制造、中藥飲片加工、中成藥生產、獸用藥制造、生物藥品制品制造、衛生材料及醫藥用品制造、藥用輔料及包裝材料。根據藥品種類、生產工藝及產排污情況,將藥企分為6類,包括化學合成類、中藥類、發酵類、混裝制劑類、提取類、生物工程類,其中化學合成類、發酵類以及提取類歸入化學原料藥。
《中國醫藥統計年報2016》中醫藥制造業主營業務收入排名前500的企業信息如表1所示。由表1可知,制藥企業工業總產值占醫藥制造業的94.63%,其中化學藥品行業占比最大,達到59.77%。據統計,目前我國醫藥工業中約80%的污染是由于化學原料藥生產所造成的,且所有被納入國家重點監控的制藥企業均為化學原料藥生產企業。

表1 2016年醫藥制造業主營業務收入排名前500企業信息Table 1 Information of pharmaceutical manufacturing industry for Top 500 enterprises in 2016
我國化學原料藥具有上千個品種,涉及的各類原輔料達萬種以上;全國化學原料藥規模以上生產企業已超過 1 000 家,還不包括生產醫藥中間體的眾多化工企業。化學原料藥可分為抗微生物藥、抗腫瘤藥、免疫抑制及免疫調節劑、抗寄生蟲藥、中樞神經系統藥、呼吸系統藥、心血管系統藥、消化系統藥、血液及造血系統藥、泌尿系統藥、抗過敏藥、內分泌系統藥等24類以及單列品種類藥物。2016年醫藥制造業原料藥產量按地區統計匯總如圖2所示。由圖2可知,原料藥生產主要集中在山東省、河北省、浙江省、上海市、安徽省等地區。

圖2 2016年醫藥制造業原料藥產量按主要生產地區統計匯總Fig.2 Statistics of chemical raw drugs production in 2016 by major production regions
2016年化學原料藥產量、出口量以及各大類化學原料藥中主要產品類型、產量和出口量匯總如表2 所示。由表2可知,我國是世界上主要的醫藥產品出口國,其中化學原料藥出口量占產量的29.10%,中樞神經系統藥物、維生素類藥物、生化藥物出口量分別占產量的72.35%、45.53%、41.58%。

表2 2016年主要化學原料藥產量和出口量匯總Table 2 Production and export volume summary of main chemical raw drugs in 2016
2 醫藥制造業標準及政策分析
由于我國制藥生產技術水平的進步,GB 8978—1996《污水綜合排放標準》不能滿足制藥工業水污染物的排放要求。2003年,我國啟動了制藥工業水污染物排放標準的制訂工作,2008年,制藥工業水污染物排放標準正式實施,包括GB 21903—2008《發酵類制藥工業水污染物排放標準》、GB 21904—2008《化學合成類制藥工業水污染物排放標準》、GB 21906—2008《中藥類制藥工業水污染物排放標準》、GB 21905—2008《提取類制藥工業水污染物排放標準》、GB 21907—2008《生物工程類制藥工業水污染物排放標準》、GB 21908—2008《混裝制劑類制藥工業水污染物排放標準》。
我國制藥工業大氣污染物排放標準此前執行GB 16297—1996《大氣污染物綜合排放標準》和GB 14554—1993《惡臭污染物排放標準》,由于未考慮醫藥制造業的生產工藝特點及污染治理的實際狀況等,2013年啟動了制藥工業大氣污染物排放標準的制訂工作。2018年《排污許可管理辦法(試行)》開始實行,同年,為了進一步明確和細化對制藥工業企業自行監測行為的指導,支撐制藥行業排污許可制度的落實,HJ 882—2017《排污單位自行監測技術指南 發酵類制藥工業》、HJ 881—2017《排污單位自行監測技術指南 提取類制藥工業》、HJ 883—2017《排污單位自行監測技術指南 化學合成類制藥工業》以及HJ 858.1—2017《排污許可證申請與核發技術規范 制藥工業—原料藥制造》相繼實施。2019年,HJ 1064—2019《排污許可證申請與核發技術規范 制藥工業—中成藥生產》、HJ 1062—2019《排污許可證申請與核發技術規范 制藥工業—生物藥品制品制造》、HJ 1063—2019《排污許可證申請與核發技術規范 制藥工業—化學藥品制劑制造》、HJ 992—2018《污染源源強核算技術指南 制藥工業》以及GB 37823—2019《制藥工業大氣污染物排放標準》也開始實施。
2019年12月《推動原料藥產業綠色發展的指導意見》發布[9],提出“到2025年,突破20項以上綠色關鍵共性技術,基本實現行業綠色生產技術替代,建立原料藥綠色工廠、綠色園區、綠色管理標準評價體系,主要污染物排放強度逐步下降,標志著醫藥制造業向著綠色化方向發展”。針對化學原料藥制造業高消耗、高排放的特點[10-11],為進一步落實工業和信息化部《工業綠色發展規劃(2016—2020年)》,積極推行清潔生產,2020年底,國家發展和改革委員會、生態環境部、工業和信息化部聯合發布了《化學原料藥制造業清潔生產評價指標體系》[12],該指標體系既能夠作為相關主管部門對行業實施清潔生產的有效管理工具和評價績效手段,滿足主管部門對推動各行業實施清潔生產的要求,又能夠減輕企業負擔,提高清潔生產工作效率。
3 危險廢物產生分析
我國醫藥制造業中化學藥品原料藥制造具有產品種類多、原輔材料(包括有機溶劑)類別多、用量大、生產工藝復雜、污染因子成分復雜、排放量大等特點。因此,主要分析化學合成原料藥的產排污環節,按照其產生工藝又可細分為發酵類、化學合成類和提取類藥物。
3.1 發酵類藥物
發酵類制藥是指通過發酵的方法產生抗生素或其他的活性成分,然后經過分離、純化等工序生產出藥物的過程[13]。發酵類藥物最開始是從抗生素的生產發展起來的,截至目前,發酵類藥物仍以抗生素為主。根據其生產工藝特點,可將其分為抗生素類、維生素類、氨基酸類以及其他類藥物,其生產工藝和產排污過程如圖3所示。
從圖3可以看出,發酵類制藥的生產工藝流程一般為種子培養、微生物發酵、發酵液預處理和固液分離、提煉純化、精制、干燥、成品等步驟[14]。種子培養階段通過搖瓶種子培養、種子罐培養及發酵罐連續的擴增培養,獲得足夠量健壯均一的種子投入發酵生產。發酵液預處理的主要目的是將菌體與濾液分離開(通常采用過濾法處理),便于后續處理。提取工藝過程分為從濾液和菌體中提取2種,提取的方法主要有萃取、沉淀、鹽析等。產品精制純化主要采用結晶、噴霧干燥、冷凍干燥等方式。

圖3 發酵類制藥的生產工藝及排污環節Fig.3 Production process and pollution discharge links of fermentation pharmacy
由發酵類制藥工業的生產工藝和排污環節可知,發酵類制藥工業產生的危險廢物包括以下幾類[15]:1)抗生素類藥物生產過程中產生的菌絲廢渣,蒸餾濃縮、母液分離產生的蒸餾釜殘和高濃度母液;2)生產過程中產生的廢酸和廢堿;3)粉碎、篩分、混合、包裝過程產生的含塵廢氣經除塵后收集的粉塵;4)脫色、過濾、分離等工序產生的不能回收或再生處理的廢活性炭、吸附劑和有機溶劑等;5)含有或直接接觸藥品的廢包裝材料、廢濾芯(濾膜)、廢容器及清洗雜物等;6)企業設備運行過程中產生的廢礦物油、廢乳化液等。此外,維生素、氨基酸以及其他非抗生素類藥物發酵藥物生產過程中產生的菌絲廢渣。廢水處理過程中產生的格柵截留物和污水處理污泥按照GB 5085.7—2019《危險廢物鑒別標準 通則》中的有關規定進行鑒別。
3.2 化學合成類藥物
化學合成類制藥是以化學原料或藥物中間體為起始反應物,采用一個化學反應或一系列化學反應生產藥物活性成分的過程[16]。化學合成類制藥以不同種類的化學原料為基礎,根據配方生產各種產品,其中最常見的化學原料為有機溶劑,如丙酮、苯胺、苯、氯仿等,通常具有毒性、腐蝕性和易燃性等特點[17]。
化學合成類藥物具體包括鎮靜催眠藥(如巴比妥類、氨基甲酸酯類等)、抗癲癇藥、抗精神失常藥、麻醉藥、解熱鎮痛藥和非甾體抗炎藥、鎮痛藥和鎮咳祛痰藥、中樞興奮藥和利尿藥、合成抗菌藥(如喹諾酮類、磺胺類等)、擬腎上腺素藥、心血管系統藥物、解痙藥及肌肉松弛藥、抗過敏藥和抗潰瘍藥、寄生蟲病防治藥物、抗病毒藥和抗真菌藥、抗腫瘤藥、甾體藥物等16個種類約近千個品種[18],其生產工藝和產排污過程如圖4所示。
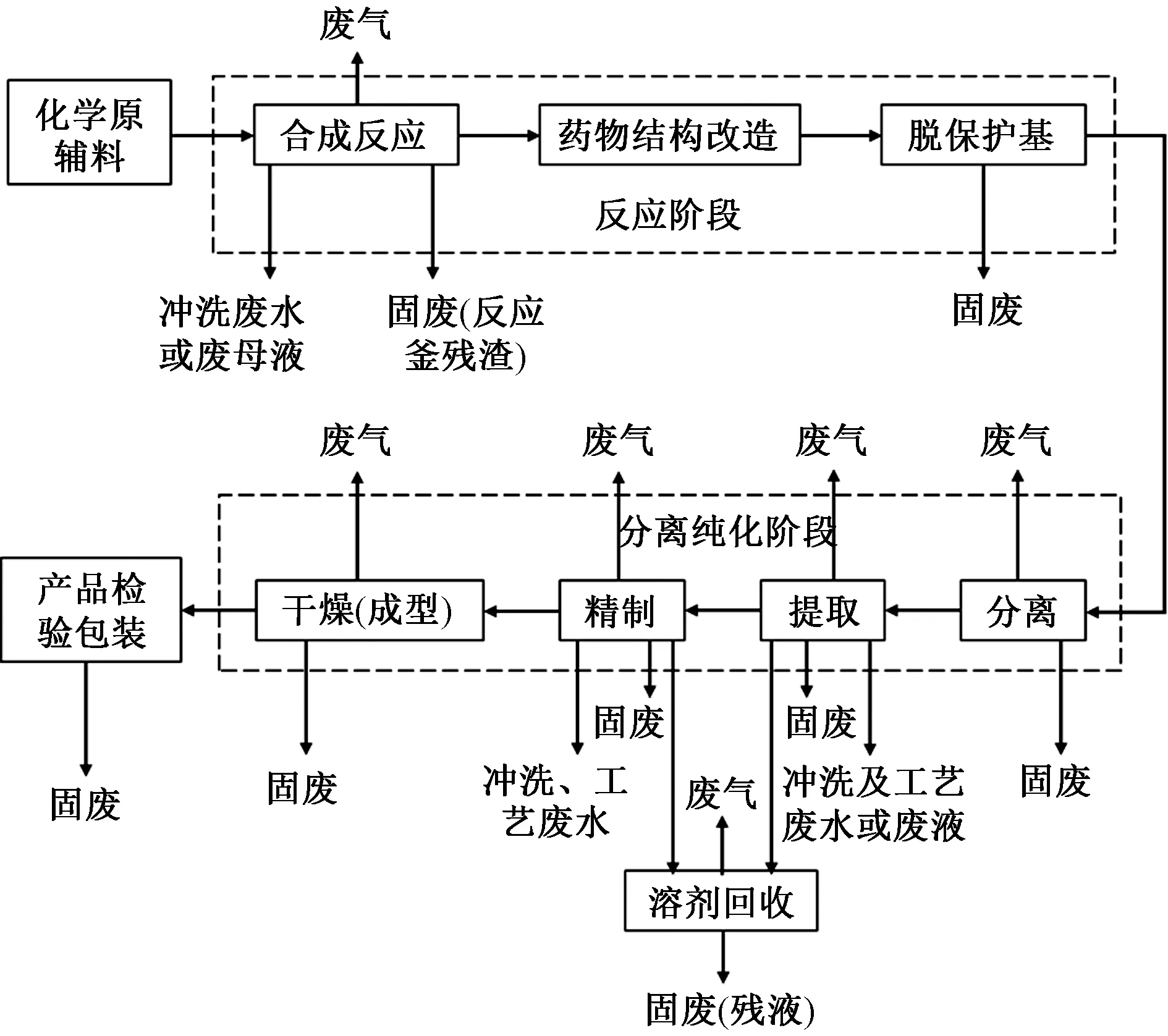
圖4 化學合成類制藥的生產工藝及排污環節Fig.4 Production process and pollution discharge links of chemical synthesis pharmacy
由圖4可知,化學合成類制藥的生產流程大致包括原輔料的投加、反應階段、分離純化、產品檢驗包裝4個步驟[19],其中,反應和分離純化2個階段是核心生產環節,是污染物產生的主要環節。化學合成類制藥的反應階段包括合成、藥物結構改造、脫保護基等過程。具體的化學反應類型包括酰化反應、裂解反應、硝基化反應、縮合反應和取代反應等。純化階段包括分離、提取、精制和成型等。其中分離主要包括沉降、離心、過濾和膜分離技術;提取主要包括沉淀、吸附、萃取、超濾技術;精制包括離子交換、結晶、色譜分離和膜分離等技術;成型主要包括濃縮、干燥、無菌過濾和成型等技術。純化階段中的分離、提取、精制過程與發酵類藥物制造過程相似。
由化學合成類制藥工業的生產工藝和排污環節可知,化學合成類制藥工業產生的危險廢物包括以下幾類[15]:1)反應階段產生的廢催化劑;2)蒸餾濃縮、母液分離產生的蒸餾釜殘和高濃度母液;3)生產過程中產生的廢酸和廢堿;4)粉碎、篩分、混合、包裝過程產生的含塵廢氣經除塵后收集的粉塵;5)脫色、過濾、分離等工序產生的不能回收或再生處理的廢活性炭、吸附劑和有機溶劑等;6)含有或直接接觸藥品的廢包裝材料、廢濾芯(濾膜)、廢容器及清洗雜物等;7)企業設備運行過程中產生的廢礦物油、廢乳化液等。此外,廢水處理過程中產生的格柵截留物和污水處理污泥按照GB 5085.7—2019的有關規定進行鑒別。
3.3 提取類藥物
提取類制藥是指運用物理、化學、生物化學方法,將生物體中起重要生理作用的各種基本物質采用提取、分離、純化等手段生產藥物的過程[20]。提取類制藥分為生化制藥(以動物提取為主)、天然藥物(以植物提取為主)和海洋藥物,提取類制藥企業相對于其他類別的制藥企業而言規模較小,其生產工藝和產排污過程如圖5所示。
從圖5可以看出,提取類制藥工藝大體可分為原料的選擇和預處理、原料的粉碎、提取、分離純化、干燥及保存、制劑6個階段。其中提取過程可分為酸解、堿解、酶解、鹽解及有機溶劑提取等;提取過程常用的溶劑包括水、稀鹽、稀堿、稀酸、有機溶劑,如乙醇、丙酮、三氯甲烷、三氯乙酸、乙酸乙酯、草酸、乙酸。精制過程可分為鹽析法、有機溶劑分級沉淀法、等電點沉淀法、膜分離法、層析法、凝膠過濾法、離子交換法、結晶和再結晶等幾種工藝的組合。

圖5 提取類制藥的生產工藝及排污環節Fig.5 Production process and pollution discharge links of extraction pharmacy
由提取類制藥工業的生產工藝和排污環節可知,提取類制藥工業產生的危險廢物包括以下幾類[15]:1)生產過程中產生的廢酸和廢堿;2)粉碎、篩分、混合、包裝過程產生的含塵廢氣經除塵后收集的粉塵;3)脫色、過濾、分離等工序產生的不能回收或再生處理的廢活性炭、吸附劑和有機溶劑等;4)含有或直接接觸藥品的廢包裝材料、廢濾芯(濾膜)、廢容器及清洗雜物等;5)企業設備運行過程中產生的廢礦物油、廢乳化液等。此外,提取廢渣、高濃度釜殘液、廢水處理過程中產生的格柵截留物和污水處理污泥按照GB 5085.7—2019的有關規定進行鑒別。
4 危險廢物危害特性及處置分析
醫藥制造業產生的危險廢物具有毒性、易燃性、腐蝕性、化學反應性、感染性、浸出毒性等危害特性,如殘留的抗生素、菌體使其具有毒性、感染性,有機溶劑使其具有毒性、易燃性、腐蝕性和化學反應性,殘留的重金屬離子使其具有浸出毒性。其中的有毒有害污染物可以通過大氣、土壤、地下水進入生態系統,從而對人體健康和周圍環境產生危害。醫藥制造業危險廢物的污染特性匯總如表3所示。

表3 醫藥制造業危險廢物的危害特性匯總Table 3 Hazardous characteristics of hazardous wastes in pharmaceutical manufacturing industry
雖然菌絲廢渣中含有大量粗脂肪、蛋白質等有機物,具有較好的肥料化利用前景,但是由于其中殘留的抗生素,通常只能采用焚燒的方式進行處置;廢吸附介質則通過回收加工或再生處理后,用作化工或其他行業的生產原材料;蒸餾釜殘和高濃度母液的熱值較高,主要通過焚燒的方式進行處置,還可以進行回收利用;廢水處理污泥主要通過焚燒的方式進行處置。
5 危險廢物利用處置對策建議
5.1 促進源頭減量,減少環境風險
對于化學合成類藥物,可通過工藝改進、原材料替代以及催化劑選擇實現綠色生產[21-23]。通常藥物合成具有多條反應路徑,因此應選擇合成路線簡短、所需要原輔材料少、中間體容易提純、反應條件溫和、廢物產量少的合成路徑。原材料的替代一般采用以無毒、低毒的原材料替代有毒、劇毒的原材料,從而降低或消除污染物的毒性。藥物合成通常需要催化劑的作用,因此應選擇高效催化劑,提高原材料的轉化效率。
5.2 加強回收利用,提升醫藥制造業清潔生產水平
醫藥制造業涉及的原輔料種類繁多,其中有機溶劑的用量巨大,且環境危害性顯著[24]。因此,對于有回用價值的溶劑應加強回收利用,一方面可以減少原輔料的用量,另一方面可以減少危險廢物的產生,提升企業清潔生產水平。此外,制藥廢液中通常含有較高含量的銨鹽,可采用蒸發、濃縮、結晶的方式進行回收。通過開展企業間點對點的合作,充分利用區域內的各企業原料和廢物的關聯,將對方排出或回收的廢物作為原材料加以利用,形成生態產業鏈,促進區域內的清潔生產,助力碳達峰、碳中和。
5.3 推進末端利用,提升醫藥制造業危險廢物資源化水平
發酵類制藥企業會產生數量巨大的廢菌絲渣[25],其中抗生素類廢菌絲渣為危險廢物,維生素、氨基酸及其他類型的廢菌絲渣則需要鑒別。而目前對于廢菌絲渣綜合利用的標準規范尚不完善。因此應強化廢菌絲渣無害化預處理技術創新,為其后續安全利用處置奠定基礎。因此,應健全廢菌絲渣利用處置標準規范,循序漸進構建完善抗生素廢菌絲渣利用處置污染控制及產品質量標準體系。
6 結語
醫藥制造業中化學原料藥產生的危險廢物具有毒性、易燃性、腐蝕性、化學反應性、感染性、浸出毒性等危害特性,對生態環境和人體健康具有極大的潛在危害。應從源頭上減少環境風險,如通過工藝改進、原材料替代以及催化劑選擇實現綠色生產;過程中提高企業清潔生產水平,如通過提高原輔料的回收利用水平、加強企業間點對點的合作實現產業生態循環;末端利用中提升醫藥制造業危險廢物資源化水平,如強化相關危險廢物處置技術創新,建立其綜合利用標準規范,奠定安全利用基礎。

