p53基因治療聯合TACE和射頻消融在兔VX2肝癌模型中的療效研究
尚華 劉博 趙曉東 胡寧 戚誠
肝癌是我國最常見的惡性腫瘤之一,根據國家癌癥中心發布的數據,2014年我國肝癌新發病例 36.5萬例,肝癌新死亡病例約 31.9萬例[1]。肝切除術是早期肝癌的首選治療方法,但肝癌早期診斷困難,患者就診時多屬中晚期,失去手術機會。對于不可切除的肝癌,治療方法有局部消融治療、經導管動脈化療栓塞術(transarterial chemoembolization,TACE)、放射治療和全身治療[2]。雖然肝癌的治療手段多樣,但療效有限,5年相對生存率僅12.1%[3]。作為抑癌基因,p53與腫瘤的發生發展密切相關,p53基因治療制品也已在臨床使用多年。本研究聯合不同作用機制的治療方式,探討TACE聯合p53基因治療和射頻消融用于肝癌治療的可行性。
1 材料與方法
1.1 實驗動物 新西蘭大白兔26只,體重2.5~3.0 kg,雌雄不限,由河北醫科大學動物中心提供[實驗動物合格證號:SYXK(冀)2018-008]。
1.2 材料與儀器 超液態碘油(法國Guerbet公司),Ad-p53(深圳賽百諾基因技術有限公司),p53抗體(北京中杉金橋生物技術有限公司),射頻治療儀[安雋醫療科技(南京)有限公司],CT機(西門子股份有限公司),生物光學顯微鏡(日本電子株式會社)。
1.3 模型建立和動物分組 VX2腫瘤株復蘇后800 r/min離心5 min,去除上清液后加入 PBS 液繼續離心5 min,去除上清液后再次加入PBS液,玻璃棒攪勻,取懸液進行臺盼藍染色計數,將細胞液濃度調至109個/L。隨機選取2只大白兔作為腫瘤傳代兔,取VX2瘤細胞懸液0.5 ml接種于兔后腿外側肌肉內,2周后待瘤體細胞發育完成,取出瘤體,剔除肌肉組織和壞死組織,將瘤體組織剪成約 1 mm3大小的碎塊浸泡于0.9%氯化鈉溶液中備用。24只擬荷瘤兔全麻后無菌條件下逐層開腹,眼科剪刺破肝左葉較厚處,剪開約5 mm深度的“燒瓶樣”竇道,直接植入2~3塊瘤體組織,明膠海綿填埋瘺口,逐層關腹。術后3 d肌內注射青霉素105 U·kg-1·d-1預防感染。術后14 d行CT檢查,觀察腫瘤生長情況,計算腫瘤體積。24只成功建模的實驗兔隨機分為A、B、C組進行后續治療。(1)A組(8只):第1天瘤內注射rAd-p53(5×106/VP),經肝動脈灌注超液態碘油(0.5 ml/只),第2天射頻消融(治療時間5 min,功率135 W);(2)B組(8只):第1天經肝動脈灌注rAd-p53(5×106/VP)和超液態碘油(0.5 ml/只),第2天射頻消融(治療時間5 min,功率135 W);(3)C組(8只):經肝動脈灌注超液態碘油(0.5 ml/只),第2天射頻消融(治療時間5 min,功率135 W)。
1.4 檢測指標 治療后第3天檢測p53蛋白表達量。治療后1、2、3、4周行CT檢查,觀察腫瘤生長情況,計算腫瘤體積。最后處死實驗兔,觀察腫瘤大小及壞死情況并對標本行HE染色。治療前、治療后1 d、3 d、1周和2周,兔耳緣靜脈采血2~3 ml行肝功能檢查,比較治療前后各時間點血清丙氨酸氨基轉移酶(ALT)和天冬氨酸氨基轉移酶(AST)兩項指標變化情況。
1.5 Western blot檢測p53水平 治療后第3天,細針針吸法取肝癌中心組織,粉碎,用含蛋白酶抑制劑的RIPA-buffer提取總蛋白,SDS-PAGE電泳,轉膜,封閉,一抗4℃孵育過夜,二抗室溫孵育1 h,顯色,定影,顯影。以β-actin為內參蛋白,以目標蛋白吸光度與內參蛋白的比值表示目標蛋白相對表達量。
1.6 免疫組化染色 切片常規脫蠟水化,乙醇浸泡,蘇木精染色,鹽酸乙醇分色,自來水洗,伊紅染色,蒸餾水洗,梯度乙醇脫水,二甲苯透明,中性樹膠封片后光鏡下觀察。
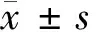
2 結果
2.1 組織病理學 術后組織形態觀察,肝癌組織標本壞死灶為類橢圓形,呈灰白色,邊界清晰,與周圍組織間有纖維包膜,瘤體中央可見凝固性壞死,部分液化。其中C組組織標本的毀損中心區較A組和B組略小,邊緣均有腫瘤殘存。HE染色顯示大片凝固性壞死,凝固性壞死區周圍有包膜形成。見圖1。
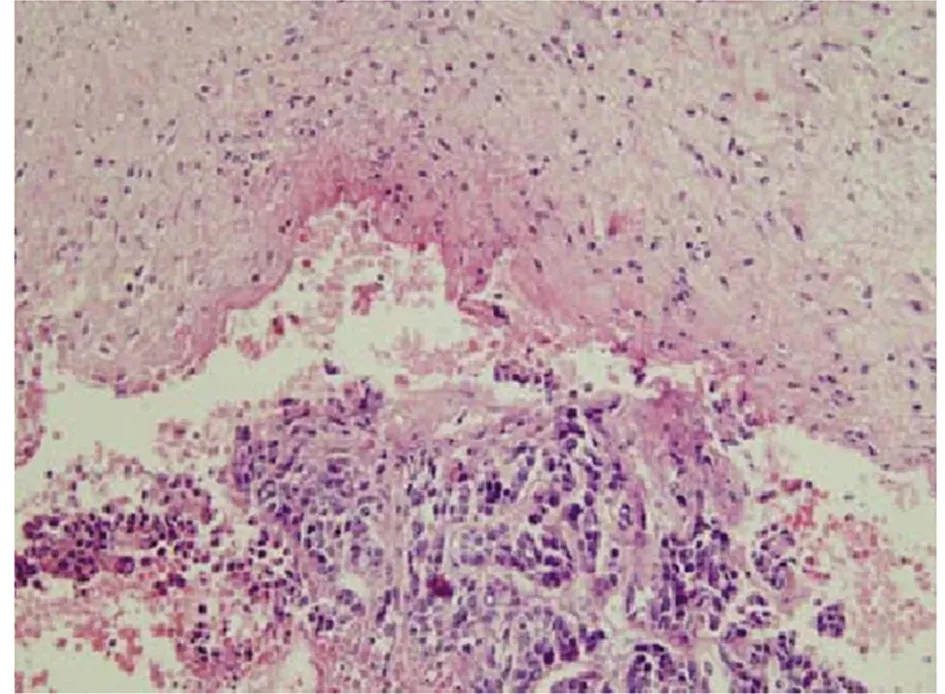
圖1 凝固性壞死區(HE×200)
2.2 3組腫瘤體積比較 經治療后,A組和B組腫瘤體積呈持續縮小趨勢,C組腫瘤體積在治療后的前2周先縮小,治療后3周逐漸恢復增長。治療后1周3組腫瘤體積差異無統計學意義,治療后2、3、4周A組和B組腫瘤體積均較C組小,差異有統計學意義(P<0.05)。見表1。
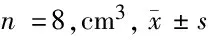
表1 3組不同時間腫瘤體積比較
2.3 3組治療ALT水平比較 治療前3組瘤兔肝功能差異無統計學意義(P>0.05),治療后1 d 3組ALT水平均達到峰值,較治療前顯著升高,組間差異無統計學意義(P>0.05);治療后3 d、治療后1周及治療后2周3組的ALT在治療后1 d的基礎上持續下降,其中A組和B組的下降趨勢更顯著,治療后3 d和治療后1周時,A組和B組的ALT水平較C組更低,治療后2周時A組和B組ALT基本恢復至術前水平,且低于同期C組水平,差異均有統計學意義(P<0.05)。見表2。
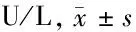
表2 3組治療前后ALT變化
2.4 3組治療前后AST水平比較 治療前3組的AST比較,差異無統計學意義(P>0.05);3組在治療后1 d、3 d及1周后,AST水平均較治療前高(P<0.05),治療后2周,A組和B組基本恢復至術前水平,但C組仍顯著高于治療前,明顯高于A、B組(P<0.05)。見表3。
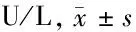
表3 3組治療前后AST水平比較
2.5 3組p53蛋白表達比較 A組和B組p53表達明顯低于C組,差異有統計學意義(P<0.05)。見圖2,表4。
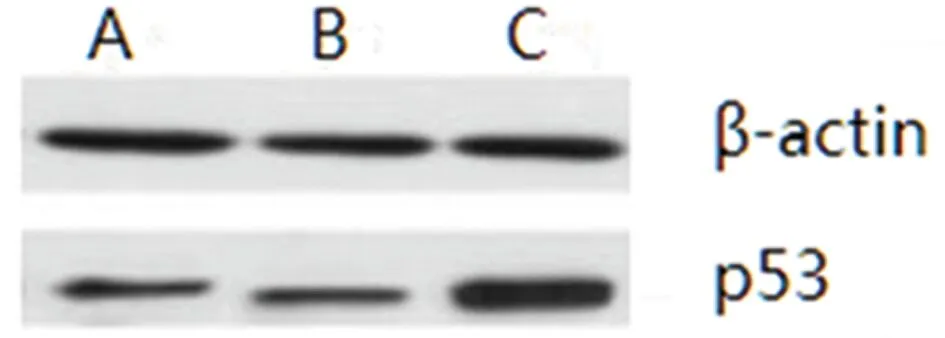
圖2 p53蛋白表達
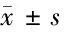
表4 3組p53蛋白表達比較
3 討論
肝癌是我國第四位常見的惡性腫瘤,病死率僅次于肺癌,對人民生命健康造成嚴重威脅[1]。肝癌患者就診時多為中晚期,失去手術機會,局部消融治療、TACE、放療和全身治療是不適合外科手術的進展期肝癌的首選方法。TACE是公認的最常用的肝癌非手術治療方法之一,尤其是TACE與局部消融治療聯合應用,協同效應明顯,逐漸替代TACE單一治療模式,但對中晚期肝癌患者生存率的改善仍有限[2]。近年來,基因治療迅猛發展,陸續有多項基因治療產品上市,與傳統療法相比,基因治療更有針對性,有望成為當前惡性腫瘤生物治療的主要手段[4]。
p53是一種腫瘤抑制基因,主要參與細胞周期調節,人類 p53基因所編碼的蛋白有野生型(wtp53)和突變型(mtp53)兩種形式, wtp53可誘導細胞凋亡。研究發現,50%的惡性腫瘤存在p53基因的突變[5]。mtp53能與wtp53形成復合物,使wtp53與DNA結合能力下降,與這些結合位點相關的基因轉錄調節受影響,最終引起癌細胞生長失控[6]。
p53應用于惡性腫瘤基因治療是以野生型 p53基因導入腫瘤細胞,以替代突變型p53基因。本研究中使用的rAd-p53是以5型腺病毒為載體,與人野生型p53進行基因重組形成有活性的基因工程重組腺病毒顆粒,通過外源性導入野生型p53基因,誘導腫瘤細胞凋亡而發揮抗腫瘤作用,臨床上被批準與放射治療聯合可試用于現有治療方法無效的晚期鼻咽癌的治療[7]。p53基因經肝動脈灌注化療治療中晚期肝癌與未聯合使用p53基因相比,總緩解率更高并有效縮小腫瘤直徑[8]。
肝細胞癌90%以上的血供來自肝動脈,通過TACE可切斷病灶主要血供,使腫瘤發生缺血、缺氧并壞死,結合射頻消融術的輔助治療下,局部組織溫度升高也可使腫瘤細胞凝固性壞死[9]。本研究中,治療前3組腫瘤體積比較,差異無統計學意義(P>0.05);經治療后,不同治療方式下腫瘤體積呈現不同的變化規律。治療后的前2周3組腫瘤均出現縮小,在第2周開始腫瘤體積差異開始體現,治療后第3周,C組(碘油灌注聯合射頻消融)腫瘤恢復增長,而rAd-p53給藥下腫瘤體積持續縮小,治療后第4周,C組腫瘤體積在2周基礎上繼續增加,而2個rAd-p53給藥組治療效果仍持續,腫瘤體積未出現增加。表明rAd-p53聯合超液態碘油TACE和射頻消融較未使用rAd-p53相比對VX2肝癌治療效果更好。根據rAd-p53使用說明書,動物體內注射后1 h重組腺病毒顆粒即可進入腫瘤細胞;注射后3 h,p53基因開始表達;第3天達到高峰,3周后,細胞內重組腺病毒DNA被降解[10]。說明p53基因表達可持續3周,本研究中,rAd-p53給藥組在治療后4周仍保持對腫瘤體積的控制,體積變化規律與藥代動力學特點具有一定一致性。水化碘油為含碘油劑,經肝動脈灌注后能長期滯留于腫瘤組織內,正常肝組織內則數天后就消失。水化碘油作為抗腫瘤藥物的載體,可提高藥物濃度、使藥物緩慢釋放,延長藥物作用時間[11]。本研究中,2個rAd-p53給藥組,在治療后4周仍繼續發揮抗腫瘤作用,可能是由于碘油栓塞局部靶血管的同時,延長了p53基因在肝動脈和瘤體局部的停留時間,持續保持基因有效濃度,從而發揮誘導腫瘤細胞凋亡、縮小腫瘤體積的作用。
ALT和AST是評價肝臟代謝功能的指標,本研究中,治療后1 d,ALT和AST均顯著升高,由于3組均采用了TACE,介入治療通過對腫瘤組織主要供血動脈進行栓塞,肝動脈及其分支動脈暫時性缺血,進而造成肝細胞的腫脹、缺血、缺氧,射頻消融的高溫引起肝臟毛細血管和膽管通透性增加,與肝功能相關的各種酶從細胞內釋放入血[12,13],血清ALT和AST水平出現明顯的上升。而3組間ALT和AST水平差異無統計學意義(P>0.05),說明無論是灌注碘油還是rAd-p53,對肝臟造成的一過性損傷是類似的。治療后3 d開始,ALT和AST水平下降,肝功能逐漸恢復,至治療后2周,A組和B組基本恢復至術前水平,以上數據說明,隨著時間的推移,肝臟在因介入栓塞治療和射頻消融損傷后,肝功能將逐漸恢復,且rAd-p53對肝功能的恢復可能有促進作用。wtp53半衰期僅1~2 h,正常細胞內水平低,而mtp53半衰期較長,達2~12 h,因此通常是檢測mtp53水平[14]。本研究選擇在p53基因表達高峰期比較表達差異,Western blot檢測陽性表明了3組肝癌模型均存在不同程度的p53基因突變,A組和B組p53表達明顯低于C組,說明給予rAd-p53后,突變型p53蛋白相對表達量下降。結合3組腫瘤體積變化規律,從分子學水平表明了p53蛋白表達與抗腫瘤療效有相關性。
瘤內注射是rAd-p53的常規給藥方式,而已有的關于p53基因治療與TACE聯用則多采用動脈介入灌注的方式[15],本研究中rAd-p53瘤內注射和動脈灌注兩種不同給藥方式下的對腫瘤大小的影響并不明顯,p53蛋白表達差異也不顯著,說明p53基因兩種給藥方式對療效影響不大,但與碘油聯用時p53基因動脈灌注給藥便利性更高,且考慮介入途徑下給藥免疫反應可能較瘤內直接注射低,所以肝動脈灌注p53基因更具優勢。
綜上所述,p53基因聯合TACE和射頻消融在兔VX2肝癌模型中療效肯定。本課題組也考慮從分子學水平考察p53基因治療影響腫瘤生長的機制,以及安全性等指標,從而為用于p53基因聯合TACE和射頻消融用于肝癌治療提供充足依據。

