嘌呤轉(zhuǎn)運蛋白的缺失對枯草芽孢桿菌生產(chǎn)核黃素的影響
蘇媛,劉川,谷振宇,4,夏苗苗,鐘成,張大偉*
1(天津科技大學(xué) 生物工程學(xué)院,天津,300457) 2(中國科學(xué)院 天津工業(yè)生物技術(shù)研究所,天津,300308) 3(天津科技大學(xué),食品營養(yǎng)與安全國家重點實驗室,天津, 300457) 4(三峽大學(xué) 生物與制藥學(xué)院,湖北 宜昌,443002)
核黃素又名維生素B2,與動植物的生長密切相關(guān),在生物體內(nèi)常以黃素單核苷酸(flavin mononucleotide,F(xiàn)MN)和黃素腺嘌呤二核苷酸(flavin adenine dinucleotide,F(xiàn)AD)兩種形式存在,發(fā)揮輔酶的作用。核黃素常被用作飼料添加劑、營養(yǎng)添加劑、輔助藥物等,廣泛應(yīng)用于飼料、食品、醫(yī)療等領(lǐng)域[1]。目前核黃素工業(yè)大規(guī)模生產(chǎn)的主要方法為微生物發(fā)酵法,枯草芽孢桿菌(Bacillussubtilis)、棉囊阿舒酵母(Assultagossypii)等都是工業(yè)上常用的核黃素生產(chǎn)菌株[2-3]。
在核黃素的合成途徑中,鳥苷三磷酸(guanosine triphosphate,GTP)是重要前體之一。它既可以利用糖類及氨基酸為原料進行頭合成,也可以利用嘌呤堿為前體進行補救合成[4]。在工業(yè)生產(chǎn)中,培養(yǎng)基成分復(fù)雜,尤其是酵母粉或酵母抽提物中含有一些嘌呤類物質(zhì),理論上既可提供GTP合成的原料,又會對從頭合成產(chǎn)生抑制作用[5]。但在以酵母提取物、玉米漿為氮源的工業(yè)培養(yǎng)基中,補救合成途徑并不是核黃素合成的主要途徑[6]。因此通過嘌呤轉(zhuǎn)運蛋白的敲除調(diào)節(jié)胞內(nèi)嘌呤類物質(zhì)的含量,進而解除培養(yǎng)基中嘌呤類物質(zhì)對從頭合成的抑制是一種潛在的提高核黃素產(chǎn)量的手段。枯草芽孢桿菌基因組中存在7個被注釋為嘌呤轉(zhuǎn)運蛋白的基因(pbuG、nupG、pbuE、ywdJ、nupNOPQ、pbuX、pbuO)。根據(jù)文獻報道,PbuE為次黃嘌呤和腺嘌呤的外排蛋白[7-8],PbuG為鳥嘌呤和次黃嘌呤的內(nèi)運蛋白[9],PbuX為黃嘌呤的內(nèi)運蛋白[10],PbuO為鳥嘌呤和次黃嘌呤的內(nèi)運蛋白[9]。然而7種轉(zhuǎn)運蛋白對全部4種嘌呤堿的轉(zhuǎn)運能力,以及敲除轉(zhuǎn)運蛋白對核黃素產(chǎn)量的影響還沒有被系統(tǒng)的研究過。
本研究發(fā)現(xiàn)培養(yǎng)基中添加一定濃度的嘌呤堿對核黃素的合成有抑制作用。轉(zhuǎn)運蛋白缺失后,這種抑制的程度會發(fā)生改變。根據(jù)抑制程度的改變和轉(zhuǎn)運蛋白缺失突變體生長表型的變化鑒定了7種嘌呤轉(zhuǎn)運蛋白對4種嘌呤堿的轉(zhuǎn)運功能,并且本文構(gòu)建了一系列轉(zhuǎn)運蛋白缺失菌株并測定了這些菌株的核黃素產(chǎn)量。
1 材料與方法
1.1 實驗材料
1.1.1 實驗菌株
實驗涉及的菌株如表1所示。

表1 本實驗所用菌株
1.1.2 主要培養(yǎng)基
LB培養(yǎng)基(g/L):酵母抽提物5,胰蛋白胨10,氯化鈉10。
SPI(g/L):硫酸銨1.96,磷酸氫二鉀13.72,磷酸二氫鉀5.88,檸檬酸鈉0.98,七水硫酸鎂0.196,葡萄糖5,酸水解酪素0.2,酵母抽提物1。
SPⅡ(g/L):硫酸銨1.92,磷酸氫二鉀13.45,磷酸二氫鉀5.76,檸檬酸鈉0.96,七水硫酸鎂0.192,葡萄糖4.9,酸水解酪素0.196,酵母抽提物0.98,氯化鈣0.006,氯化鎂0.238。
發(fā)酵培養(yǎng)基(g/L):白玉米漿干粉15,玉米漿干粉1.5,蔗糖40,硫酸鎂0.5,硫酸銨5,酵母抽提物5,磷酸氫二鉀3,磷酸二氫鉀1,滅菌前用飽和NaOH調(diào)節(jié)pH至7.2,121 ℃,滅菌30 min后,根據(jù)需要添加不同濃度的嘌呤堿。
SP基本鹽培養(yǎng)基(g/L):SPI(不添加酸水解酪素和酵母抽提物),色氨酸0.05,根據(jù)需要添加不同濃度的嘌呤堿。
1.1.3 主要試劑
腺嘌呤堿、次黃嘌呤堿、黃嘌呤堿、鳥嘌呤堿,北京索萊寶科技有限公司。
1.1.4 儀器與設(shè)備
EDC-810基因擴增儀,東勝國際貿(mào)易有限公司;水平電泳儀,北京市六一儀器廠;94-Z水平搖床,寧波新芝生物科技股份有限公司;V-1600可見分光光度儀,上海美譜達儀器有限公司。
1.2 實驗方法
1.2.1 嘌呤轉(zhuǎn)運蛋白缺失突變菌株構(gòu)建方法
本實驗所涉及的基因序列均來自NCBI(https://www.ncbi.nlm.nih.gov/),使用SnapGene設(shè)計所用引物,由擎科生物公司合成(表2)。
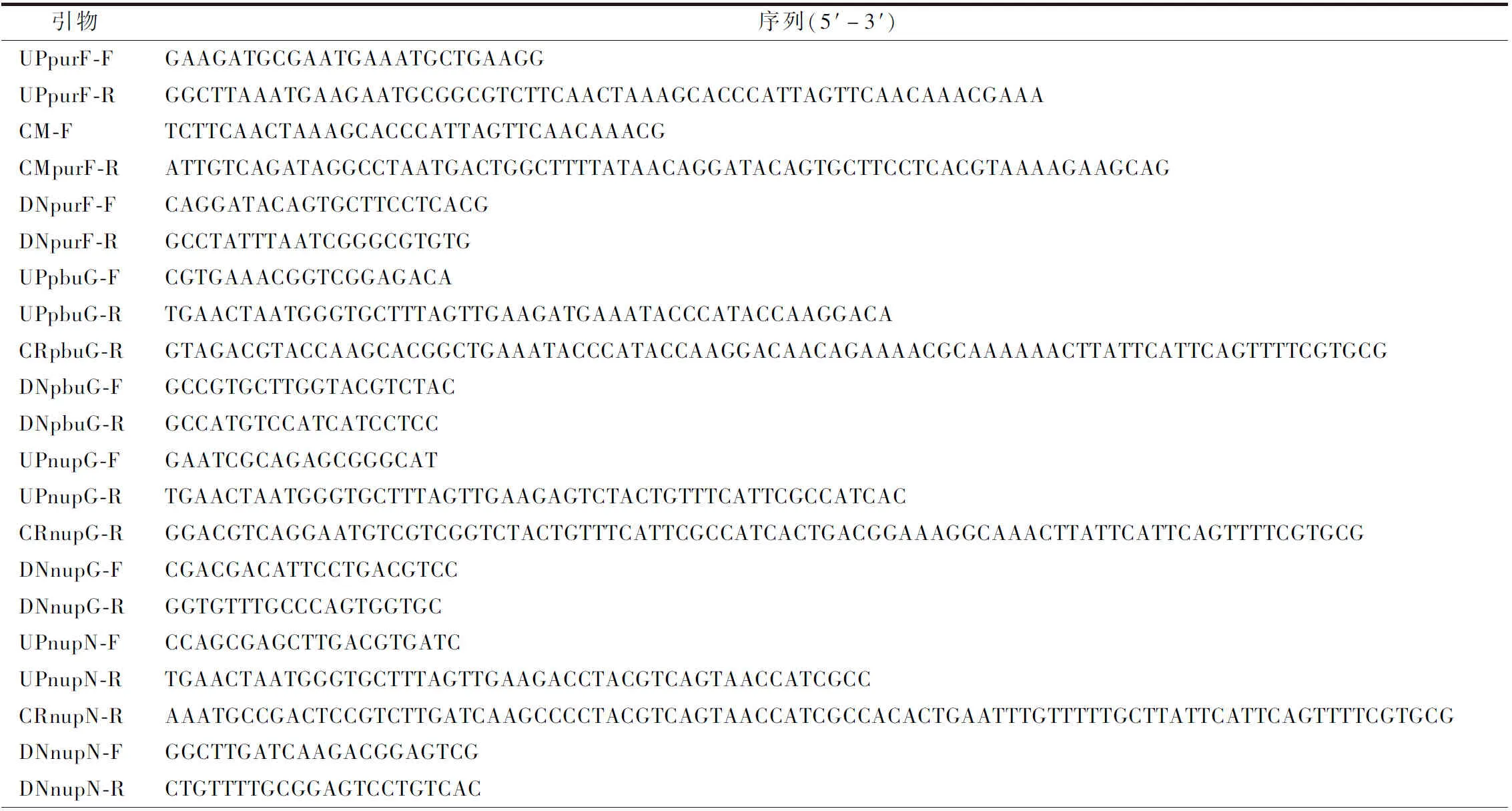
表2 本實驗所用引物
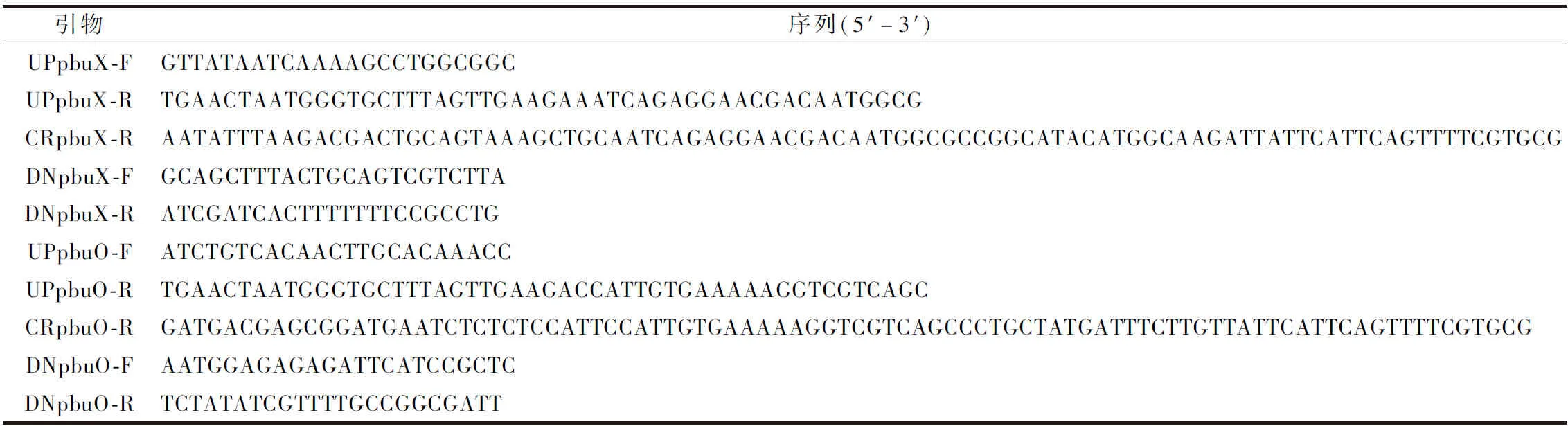
續(xù)表2
根據(jù)文獻報道的方法進行無痕敲除[11],以B.subtilis168基因組為模板,分別擴增基因的上游同源臂(UP)、下游同源臂(DN)部分,以帶有cat+araR(CR)的菌為模板擴增含有篩選標記CR以及與同向重復(fù)序列DR(direct repeats)的部分,進行3片段融合PCR,將產(chǎn)物用SPI-II轉(zhuǎn)化法轉(zhuǎn)入R菌中[12],利用DR在LB培養(yǎng)基中振蕩培養(yǎng)進行同源重組,將篩選標記去除,得到敲除菌株。具體敲除過程如圖1所示。
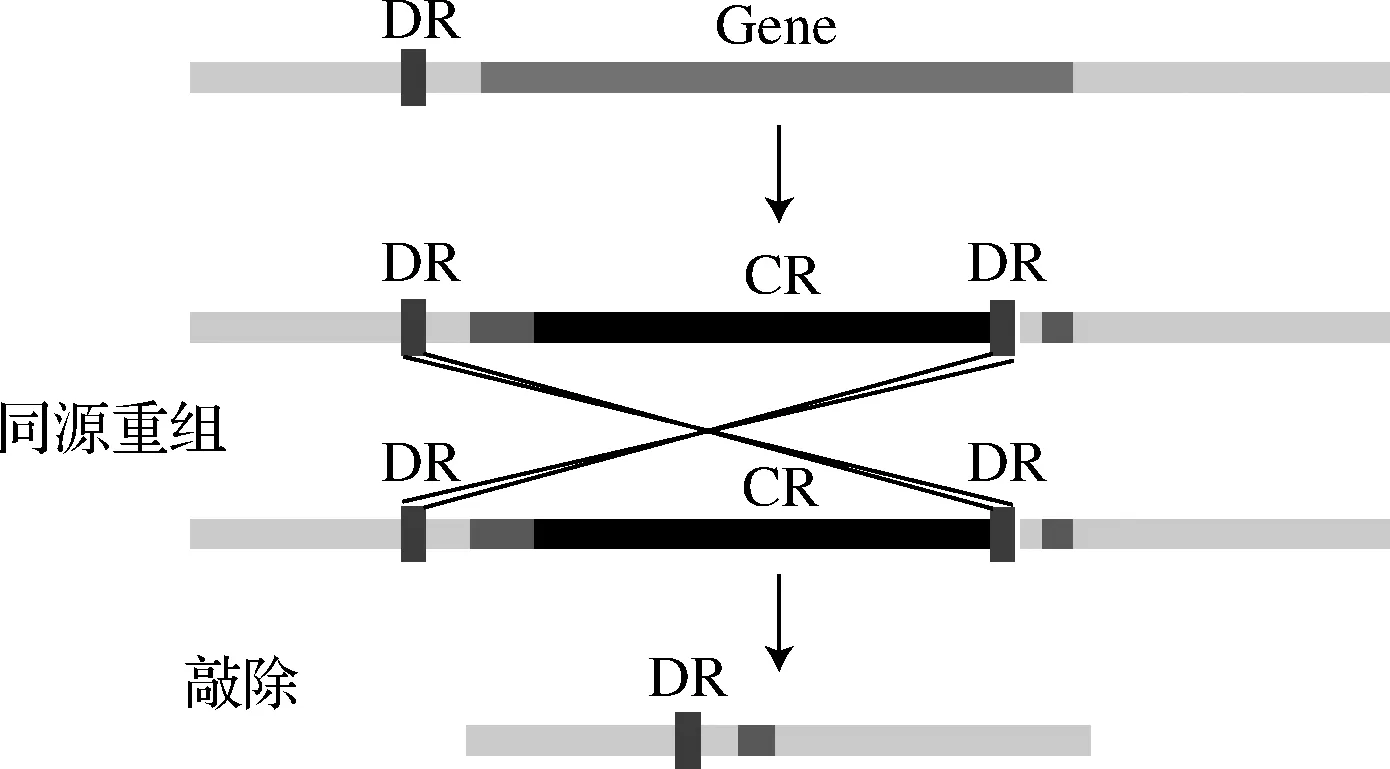
圖1 同源重組敲除原理圖
1.2.2 嘌呤從頭合成缺陷菌株的構(gòu)建
通過同源重組將嘌呤合成途徑中關(guān)鍵酶PRPP轉(zhuǎn)酰胺酶編碼基因purF使用氯霉素抗性基因cat替換,阻斷嘌呤的從頭合成,構(gòu)建嘌呤從頭合成缺陷菌株RF、RFP、RFG、RFE、RFY、RFN、RFX、RFO。
1.2.3 轉(zhuǎn)運蛋白缺失對生長影響的測定
挑取新鮮的單菌落至5 mL LB液體培養(yǎng)基中,37 ℃, 200 r/min振蕩培養(yǎng)12 h,取適量菌液至1.5 mL EP管中,離心棄上清液,用同體積的無菌水洗滌1次,再用同體積的無菌水重懸并微調(diào)至相同OD600值,取50 μL轉(zhuǎn)接至添加不同嘌呤堿的SP基本鹽培養(yǎng)基中,37 ℃,200 r/min,培養(yǎng)30~40 h,每隔10~12 h測定其OD600。
1.2.4 核黃素濃度的測定
采用分光光度法測定核黃素濃度,取適量體積的發(fā)酵液,稀釋合適倍數(shù),溶于0.1 mol/L NaOH 避光放置20 min,12 000 r/min,離心1 min,取上清液測定其在444 nm處的吸光度,確定核黃素濃度[13]。
1.2.5 搖瓶發(fā)酵驗證
從-80 ℃凍存管中取20 μL菌液,涂布于LB固體平板上,37 ℃倒置培養(yǎng)24 h,刮取全部菌苔至1 mL無菌水中,混勻后取適量菌液,以初始OD600=0.1接至含80 mL發(fā)酵培養(yǎng)基的500 mL帶擋板的三角瓶中,37 ℃,180 r/min振蕩培養(yǎng)42 h。
2 結(jié)果與分析
2.1 嘌呤轉(zhuǎn)運蛋白缺失菌株的構(gòu)建
根據(jù)文獻報道以及在KEGG(https://www.kegg.jp/)及subtiwiki(http://subtiwiki.uni-goettingen.de/)上查找到7種嘌呤轉(zhuǎn)運蛋白基因:pbuG、nupG、pbuE、ywdJ、nupNOPQ、pbuX、pbuO。以實驗室保藏的1株有一定核黃素產(chǎn)量的枯草芽孢桿菌R為出發(fā)菌株,根據(jù)1.2.1中的方法分別敲除了以上7種嘌呤轉(zhuǎn)運蛋白基因,構(gòu)建了一系列嘌呤轉(zhuǎn)運蛋白缺失的菌株。
以敲除pbuG基因為例,以B.subtilis168基因組為模板,用引物UPpbuG-F、UPpbuG-R(含DR),和引物DNpbuG-F、DNpbuG-R分別擴增pbuG基因上下游的UP和DN片段,以實驗室保藏菌株中帶有CR片段的基因組為模板,用引物CR-F、CRpbuG-R(含DR)擴增出CR片段。將所擴增出的UP、CR、DN進行片段融合,將融合后的產(chǎn)物轉(zhuǎn)入菌株R中,通過氯霉素抗性(8 μg/mL)篩選到CR替換pbuG的陽性克隆,用引物UPpbuG-F、DNpbuG-R進行菌落PCR驗證,正確的條帶大小應(yīng)為5 248 bp。正確的克隆轉(zhuǎn)接至無抗性的LB液體培養(yǎng)基中培養(yǎng),直接重復(fù)序列DR重組之后,彈出篩選標記CR,涂布在含40 μg/mL新霉素的LB固體培養(yǎng)上,即可得到篩選到目的基因的敲除的陽性克隆,用引物UPpbuG-F、DNpbuG-R對克隆進行菌落PCR驗證,大小為3 179 bp即為敲除成功,未敲除成功的條帶大小為5 248 bp。
2.2 不同嘌呤物質(zhì)添加濃度的確定及其對核黃素產(chǎn)量的影響
根據(jù)文獻報道,腺苷一磷酸(adenosine monophosphate, AMP)、腺苷二磷酸(adenosine diphosphate,ADP)、腺苷三磷酸(adenosine triphosphate,ATP)、鳥苷一磷酸(guanosine monophosphate,GMP)、鳥苷二磷酸(guanosine diphosphate,GDP)、GTP等均會抑制嘌呤的從頭合成途徑[14-15]。本實驗基于如下假設(shè):一旦發(fā)酵培養(yǎng)基中嘌呤堿濃度超過閾值,雖然通過補救合成途徑可以生成少量嘌呤核苷酸,但這些嘌呤核苷酸會對從頭合成途徑產(chǎn)生抑制,并且補救合成的嘌呤核苷酸不能彌補這種抑制導(dǎo)致的從頭合成GTP的損失,最終導(dǎo)致核黃素產(chǎn)量的降低。為了證明我們的假設(shè),首先嘗試在發(fā)酵培養(yǎng)基中添加不同濃度的4種嘌呤堿并檢測出發(fā)菌株R的核黃素產(chǎn)量變化。
發(fā)酵培養(yǎng)基中的腺嘌呤、次黃嘌呤、黃嘌呤、鳥嘌呤設(shè)置7個終質(zhì)量濃度梯度,分別為0、1、20、50、100、500、1 000 mg/L,添加1 000 mg/L的腺嘌呤、次黃嘌呤、黃嘌呤及100 mg/L的鳥嘌呤時核黃素產(chǎn)量降低最明顯,分別為29.22%、10.15%、17%、10.27%(圖2),說明該濃度的嘌呤堿對菌株R的核黃素合成具有較強的抑制效果。因此確定后續(xù)實驗中,4種嘌呤堿的添加終質(zhì)量濃度分別為腺嘌呤1 000 mg/L、次黃嘌呤1 000 mg/L、黃嘌呤1 000 mg/L、鳥嘌呤100 mg/L。
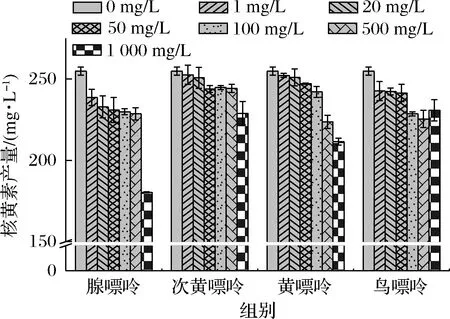
圖2 添加不同濃度的嘌呤堿對核黃素產(chǎn)量的影響
敲除嘌呤內(nèi)運蛋白和外排蛋白,可以阻礙發(fā)酵培養(yǎng)基中的嘌呤堿進入細胞,或細胞中嘌呤堿的排出,導(dǎo)致嘌呤從頭合成途徑抑制程度的改變,而影響核黃素的產(chǎn)量。敲除nupNOPQ、pbuX、pbuO后,腺嘌呤對菌株核黃素產(chǎn)量的抑制程度分別減弱了65.30%、75.80%、58.50%,敲除pbuG、pbuE、ywdJ后,腺嘌呤對菌株核黃素產(chǎn)量的抑制程度分別增強了10.15%、159.90%、106.53%(圖3-a);敲除nupG、pbuE、ywdJ、nupNOPQ、pbuX后,次黃嘌呤對菌株核黃素產(chǎn)量的抑制程度分別增強66.10%、45.60%、448.60%、197.20%、 245.80%(圖3-b);敲除pbuG、pbuE、ywdJ、nupNOPQ、pbuO后,黃嘌呤對菌株核黃素產(chǎn)量的抑制程度分別減弱了66.10%、55.50%、82.60%、44.70%、34.40%,敲除nupG后,黃嘌呤對菌株核黃素產(chǎn)量的抑制程度增強了61.30%(圖3-c);敲除pbuG、pbuE、ywdJ、nupNOPQ、pbuX、pbuO后,鳥嘌呤對菌株核黃素產(chǎn)量的抑制程度分別減弱了66.80%、217.90%、 133.60%、66.50%、82.20%、179.20%(圖3-d)。 說明嘌呤轉(zhuǎn)運蛋白的缺失確實影響了嘌呤堿對核黃素合成的抑制作用。
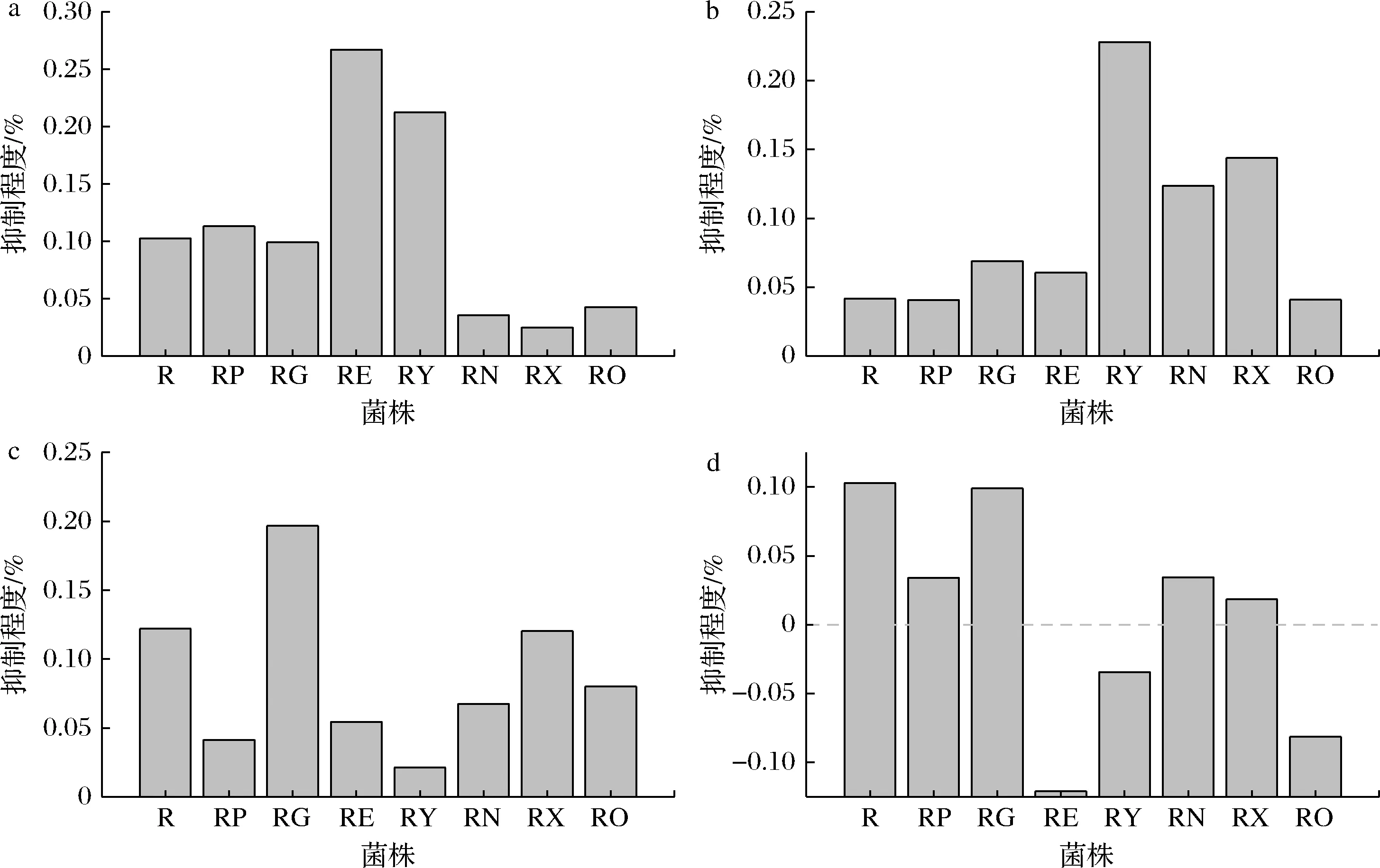
a-1 000 mg/L腺嘌呤;b-1 000 mg/L次黃嘌呤;c-1 000 mg/L黃嘌呤;d-100 mg/L鳥嘌呤
2.3 嘌呤轉(zhuǎn)運蛋白缺失對菌株生長的影響
在阻斷嘌呤從頭合成途徑后,細胞只能利用胞外的嘌呤堿進行補救合成以維持細胞生長,嘌呤轉(zhuǎn)運蛋白的敲除會影響細胞利用胞外嘌呤堿的能力,從而使細胞的生長速度發(fā)生改變。首先利用同源重組將嘌呤操縱子中的purF用氯霉素抗性基因cat替換,構(gòu)建了嘌呤從頭合成缺陷菌株RF。在SP基本鹽培養(yǎng)基中,若不添加任何嘌呤堿,在培養(yǎng)47 h后通過吸光度法檢測不到菌株RF生長,而出發(fā)菌株R的OD600可長至0.7左右,因此確定其成功阻斷了嘌呤從頭合成途徑。經(jīng)過測定RF菌株在SP基本鹽培養(yǎng)基中分別添加終質(zhì)量濃度為10 mg/L腺嘌呤(圖4-a),20 mg/L次黃嘌呤(圖4-b),20 mg/L 黃嘌呤(圖4-c),20 mg/L鳥嘌呤(圖4-d)后培養(yǎng)至47 h時可恢復(fù)到與出發(fā)菌株R生長相近的水平。
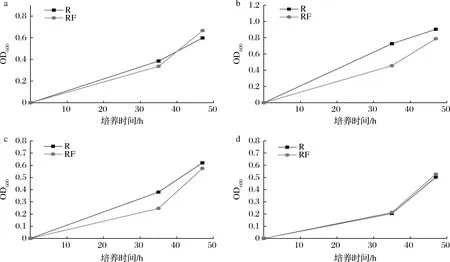
a-10 mg/L腺嘌呤;b-20 mg/L次黃嘌呤;c-20 mg/L黃嘌呤;d-20 mg/L鳥嘌呤
由圖5可知,敲除nupG、pbuE、ywdJ后,菌株在添加腺嘌呤的SP基本鹽培養(yǎng)基中生物量分別提高了10.43%、57.55%、20.50%,敲除nupNOPQ、pbuX、pbuO后,菌株在添加腺嘌呤的培養(yǎng)基中生物量分別降低了6.83%、8.27%、6.65%;敲除nupG、pbuE、nupNOPQ、pbuX后,菌株在添加次黃嘌呤的培養(yǎng)基中生物量分別提高了11.65%、9.61%、16.69%、24.57%;敲除nupG后菌株在添加黃嘌呤的培養(yǎng)基中生物量分別提高了36.38%,敲除pbuG、pbuE、ywdJ、pbuX、pbuO后,菌株在添加黃嘌呤的培養(yǎng)基中生物量分別降低了5.87%、31.65%、19.25%、18.92%、29.04%;敲除nupG、pbuE、ywdJ后,菌株在添加鳥嘌呤的培養(yǎng)基中生物量分別提高了8.12%、50.84%、30.63%,敲除pbuG、pbuX、pbuO后,菌株在添加鳥嘌呤的培養(yǎng)基中生物量分別降低了38.44%、8.12%、15.47%。
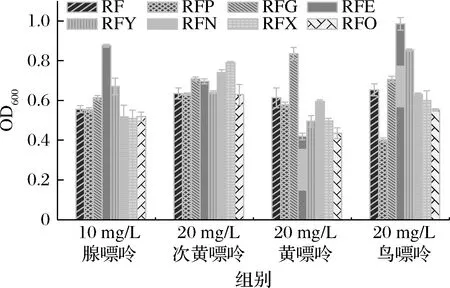
圖5 嘌呤轉(zhuǎn)運蛋白缺失對生物量的影響
2.4 嘌呤轉(zhuǎn)運蛋白的功能分析
在本實驗中,我們通過嘌呤轉(zhuǎn)運蛋白缺失對嘌呤堿對核黃素合成的抑制及缺失菌株在添加嘌呤堿的基本培養(yǎng)基中細胞生物量的變化兩方面實驗判斷了7種嘌呤轉(zhuǎn)運蛋白對4種嘌呤堿的轉(zhuǎn)運功能(表3)。一方面,我們通過核黃素產(chǎn)量的變化初步判斷PbuG可以外排腺嘌呤,內(nèi)運黃嘌呤和鳥嘌呤;NupG可外排次黃嘌呤和黃嘌呤;PbuE、YwdJ可能是主要的腺嘌呤外排蛋白,同時可以外排次黃嘌呤,內(nèi)運黃嘌呤和鳥嘌呤;NupNOPQ、PbuX、PbuO可內(nèi)運腺嘌呤及鳥嘌呤,NupNOPQ、PbuX可以外排次黃嘌呤, NupNOPQ、PbuO還可內(nèi)運黃嘌呤。另一方面,通過生長實驗可以初步判定PbuG可以內(nèi)運黃嘌呤和鳥嘌呤;NupG可以外排4種嘌呤堿;PbuE可以外排腺嘌呤、次黃嘌呤和鳥嘌呤,內(nèi)運黃嘌呤;YwdJ可外排腺嘌呤、鳥嘌呤;NupNOPQ可外排次黃嘌呤,內(nèi)運腺嘌呤和黃嘌呤;PbuX可外排次黃嘌呤,內(nèi)運腺嘌呤、黃嘌呤和鳥嘌呤;PbuO可內(nèi)運腺嘌呤、黃嘌呤和鳥嘌呤。
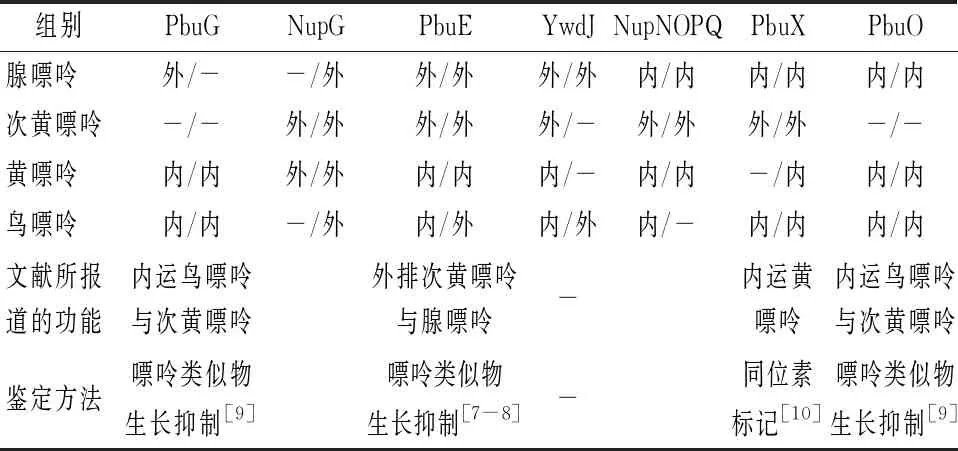
表3 由產(chǎn)量和生長實驗的推測結(jié)果以及文獻報道的嘌呤轉(zhuǎn)運蛋白功能結(jié)果
綜合上述兩方面實驗結(jié)果,發(fā)現(xiàn)只有其中1個實驗證明的結(jié)果有7個,2個實驗產(chǎn)生相反的結(jié)果有2個,兩個實驗得到的一致結(jié)果有17個。其中一致的結(jié)果如下:PbuG可以內(nèi)運黃嘌呤、鳥嘌呤;NupG可外排次黃嘌呤和黃嘌呤;PbuE可以外排腺嘌呤和次黃嘌呤,內(nèi)運黃嘌呤;YwdJ可外排腺嘌呤;NupNOPQ可外排次黃嘌呤,內(nèi)運腺嘌呤和黃嘌呤;PbuX可外排次黃嘌呤,內(nèi)運腺嘌呤、鳥嘌呤;PbuO可內(nèi)運腺嘌呤、黃嘌呤和鳥嘌呤。
通過比較文獻中利用其他實驗方法驗證的嘌呤轉(zhuǎn)運蛋白的功能,發(fā)現(xiàn)其與本文中的結(jié)果具有一定的一致性(表3)。
2.5 通過改造嘌呤轉(zhuǎn)運蛋白提高核黃素的產(chǎn)量
通過搖瓶發(fā)酵測定了嘌呤轉(zhuǎn)運蛋白缺失菌株的核黃素產(chǎn)量。如圖6所示,發(fā)現(xiàn)不同嘌呤轉(zhuǎn)運蛋白缺失對核黃素的合成有一定的促進或抑制作用。pbuG、nupNOPQ、pbuX的缺失菌株與出發(fā)菌株R相比,核黃素產(chǎn)量分別提高了7.53%、10.74%、5.84%;而pbuE、ywdJ的缺失菌株與出發(fā)菌株R相比,核黃素產(chǎn)量分別降低了7.72%、6.48%。
在測定添加不同濃度的嘌呤堿對核黃素產(chǎn)量影響的實驗中發(fā)現(xiàn)添加較低濃度的腺嘌呤和鳥嘌呤就會對核黃素產(chǎn)量產(chǎn)生抑制作用。因此推測在本實驗所用培養(yǎng)基中,轉(zhuǎn)運蛋白對腺嘌呤和鳥嘌呤的轉(zhuǎn)運能力是對核黃素產(chǎn)量的關(guān)鍵影響因素。而單獨敲除腺嘌呤/鳥嘌呤內(nèi)運蛋白基因(除pbuO)和腺嘌呤外排蛋白基因分別提高和降低了核黃素產(chǎn)量。因此對本文中確定的3個編碼腺嘌呤內(nèi)運蛋白基因nupNOPQ、pbuX、pbuO進行了敲除構(gòu)建了菌株RNXO,同時構(gòu)建了敲除nupNOPQ、pbuX的菌株RNX,經(jīng)搖瓶驗證發(fā)現(xiàn)RNXO和RNX相較于出發(fā)菌株R的核黃素產(chǎn)量分別提高了11.39%、12.17%。在RNXO和RNX基礎(chǔ)上又分別敲除了鳥嘌呤內(nèi)運蛋白基因pbuG,得到了RNXOP和RNXP,二者的核黃素產(chǎn)量較出發(fā)菌株R分別提高了17.81%、19.14% (圖6)。
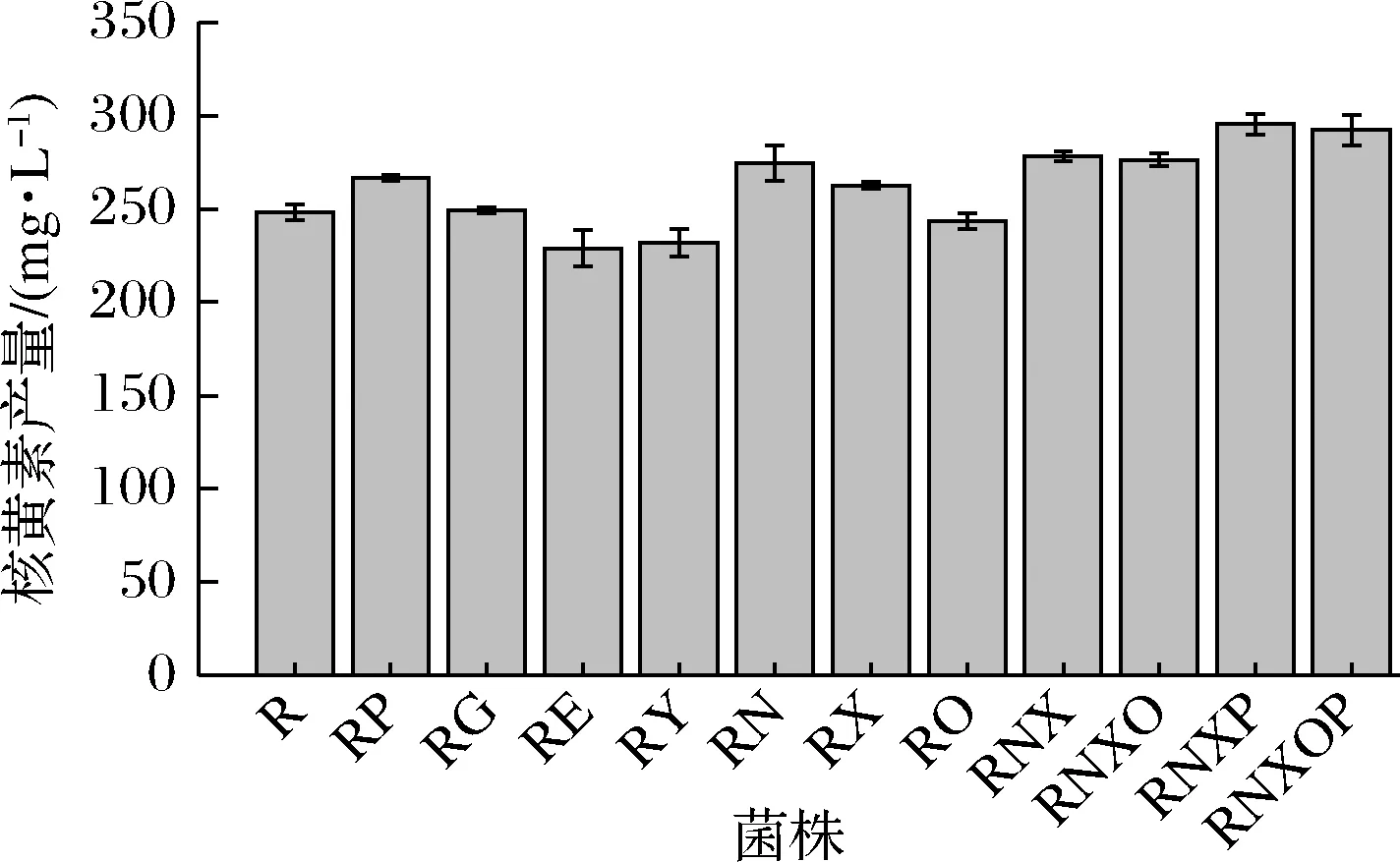
圖6 嘌呤轉(zhuǎn)運蛋白缺失菌株的核黃素產(chǎn)量
3 結(jié)論與討論
經(jīng)本實驗鑒定PbuE、YwdJ具有外排腺嘌呤的功能,NupNOPQ、PbuX、PbuO具有內(nèi)運腺嘌呤的功能;NupG、PbuE、NupNOPQ、PbuX具有外排次黃嘌呤的功能;NupG具有外排黃嘌呤的功能;PbuG、PbuE、NupNOPQ、PbuO具有內(nèi)運黃嘌呤的功能;PbuG、PbuX、PbuO具有內(nèi)運鳥嘌呤的功能。基于其轉(zhuǎn)運功能,在實驗室已有菌株R基礎(chǔ)上對腺嘌呤及鳥嘌呤的內(nèi)運蛋白基因nupNOPQ、pbuX、pbuG進行了敲除,將核黃素產(chǎn)量提高了19.14%。
文獻報道,嘌呤轉(zhuǎn)運蛋白的敲除會影響嘌呤核苷的產(chǎn)量,嘌呤核苷的生產(chǎn)菌株中也會存在一些嘌呤轉(zhuǎn)運蛋白的突變[16-17]。這些敲除和突變可能影響了菌株嘌呤核苷酸的從頭合成能力。本文中鑒定的一些腺嘌呤和鳥嘌呤的轉(zhuǎn)運蛋白與核黃素產(chǎn)量有一定的關(guān)系。除pbuO以外,敲除其他腺嘌呤/鳥嘌呤的內(nèi)運蛋白基因后核黃素產(chǎn)量均有所提高,而敲除外排蛋白的菌株核黃素產(chǎn)量均降低。文獻報道PbuO的鳥嘌呤的轉(zhuǎn)運能力在大于100 μmol/L時才能體現(xiàn)[8],因此在我們的培養(yǎng)基中鳥嘌呤的含量沒有達到該濃度,而當培養(yǎng)基中額外添加100 mg/L 的鳥嘌呤后,敲除pbuO提高了核黃素的產(chǎn)量(圖3)。因此由于發(fā)酵培養(yǎng)基成分的差異,對嘌呤轉(zhuǎn)運蛋白敲除的效果也會出現(xiàn)差異。本文對嘌呤轉(zhuǎn)運蛋白的敲除結(jié)果對核黃素生產(chǎn)菌株的改造具有一定的參考意義。
前人對于枯草芽孢桿菌生產(chǎn)核黃素的方法已經(jīng)有了詳細的研究,在最新的綜述中,這些研究方法已經(jīng)被歸納匯總[3,18]。WANG等[19]通過整合基因組和轉(zhuǎn)錄組數(shù)據(jù)解析了1株高產(chǎn)核黃素枯草芽孢桿菌的高產(chǎn)機制,并通過逆向代謝工程從頭構(gòu)建了核黃素生產(chǎn)菌株,其搖瓶產(chǎn)量達到4.2 g/L。BOUMEZBEUR等[20]通過點突變核糖開關(guān),在保持細胞正常生長的前提下解除了嘌呤操縱子和核黃素操縱子的轉(zhuǎn)錄水平調(diào)控,提高了核黃素的產(chǎn)量。而本文首次報道了通過改造嘌呤轉(zhuǎn)運蛋白提高核黃素產(chǎn)量的方法,為核黃素高產(chǎn)菌株的構(gòu)建提供了新的思路。