“風寒濕”外邪影響Th17/Treg失衡促進類風濕關節炎病證發生的分子機制研究
張逢,戴宗順,林也,蔡雄,宋厚盼,陳聰,廖菁

〔摘要〕 目的 探討Th17/Treg細胞在類風濕關節炎(痹證)中的表達情況及“風寒濕”外邪影響痹證發生的分子機制。方法 (1)雄性SD大鼠90只,隨機分為正常對照組、單純佐劑性關節炎(AIA)組和AIA風寒濕痹組,每組30只。正常對照組和單純AIA組大鼠正常飼養;AIA風寒濕痹組每天置于人工智能氣候箱內接受風寒濕刺激,14 d后單純AIA組和AIA風寒濕痹組免疫含有熱滅活結合桿菌的完全弗氏佐劑(CFA);AIA風寒濕痹組CFA免疫后風寒濕再刺激6 d。各組動物CFA免疫前1天、免疫后第6、10天,分離外周血單核細胞(PBMCs),流式細胞術檢測CD4+Th17和CD4+CD25+Foxp3+Treg細胞,分析Th17/Treg細胞比例。(2)雄性SD大鼠20只,隨機分為正常對照組和AIA風寒濕痹組,每組10只。正常對照組和AIA風寒濕痹組大鼠的實驗條件同(1)。CFA免疫后第14天麻醉大鼠,分離PBMCs,流式細胞術檢測外周血CD4+T細胞pSTAT3蛋白、CD4+IL-17+淋巴細胞pSTAT4和pSTAT6的蛋白平均熒光強度,RT-PCR檢測外周血CD4+T細胞中RORγt、Foxp3、STAT3、STAT4、STAT6 mRNA的表達。結果 隨著AIA風寒濕痹大鼠病情的進展,外周血CD4+Th17細胞比例逐漸增加,CD4+CD25+Foxp3+Treg細胞比例逐漸降低,與同時間點單純AIA組大鼠比較,差異具有統計學意義(P<0.05或P<0.01)。與正常對照組比較,AIA風寒濕痹組大鼠外周血CD4+pSTAT3+和CD4+IL-17+pSTAT4+及CD4+IL-17+pSTAT6+蛋白表達量顯著增加,CD4+T細胞中Foxp3 mRNA表達量顯著降低,而RORγt、STAT3、STAT4、STAT6 mRNA表達量顯著增加,差異具有統計學意義(P<0.05或P<0.01)。結論 “風寒濕”外邪可能通過JAK/STAT信號通路激活Th17細胞分化,并抑制Treg細胞分化,導致Th17/Treg細胞失衡,從而促進RA病證的發生。
〔關鍵詞〕 類風濕關節炎;痹證;“風寒濕”外邪;Th17/Treg;JAK/STAT信號通路
〔中圖分類號〕R255.6? ? ? ?〔文獻標志碼〕A? ? ? ? 〔文章編號〕doi:10.3969/j.issn.1674-070X.2021.11.003
Mechanistic Studies of Th17/Treg Imbalance Influenced by Exogenous Wind-cold-damp
Pathogens on the Development of Rheumatoid Arthritis
ZHANG Feng1, DAI Zongshun2, LIN Ye1, CAI Xiong1, SONG Houpan2, CHEN Cong2, LIAO Jing1,2*
(1. Hunan Key Laboratory of Chinese Medicine Powder and Innovative Drugs Established by Provincial and Ministry Training Bases, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Hunan Provincial Key Laboratory of Translational Research in TCM Formulas and Zheng, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective To observe the molecular mechanism of “wind-cold-damp” (FHS) exogenous pathogenic factors and the expression of Th37/Treg cells on Bi syndrom (rheumatoid arthritis, RA). Methods (1) Ninety male SD rats were randomly and evenly assigned into normal control group, simple adjuvant-induced arthrtis (AIA) group and FHS+AIA group. Normal control group and simple AIA group were normally fed, and the FHS+AIA group was placed in an intelligent artificial climate box every day to receive FHS stimulation. After 14 days of FHS stimulation, rats in the simple AIA group and FHS+AIA group were injected complete Freuds adjuvant (CFA) containing heat-inactivated Mycobacterium tuberculosi to establish AIA. FHS+AIA group continued to receive FHS stimulation for additional 6 days. Peripheral blood mononuclear cells (PBMCs) were isolated 1 day before, 6 and 10 days after CFA immunization. Percentages of CD4+Th17 and CD4+CD25+Foxp3+Treg cells were detected by flow cytometry. (2) Twenty male SD rats were randomly and evenly assigned into normal control group and FHS+AIA group. The experimental conditions of rats in normal control group and FHS+AIA group were the same (1). On day 14 after CFA injection, rats were anesthetized and blood specimens were collected for isolation of PBMCs. Mean fluorescence intensity of pSTAT3 protein in CD4+T cells, pSTAT4 and pSTAT6 proteins in CD4+IL-17+T cells were detected and analyzed by flow cytometry, and mRNA expression levels of RORγt, Foxp3, STAT3, STAT4, and STAT6 in CD4+T cells were examined by RT-PCR. Results With the progression of the disease in FHS+AIA group of rats, the proportion of peripheral blood CD4+Th17 cells gradually increased, and the proportion of CD4+CD25+Foxp3+Treg cells gradually
decreased, compared with the simple AIA group of rats at the same time point, the difference was statistically significant (P<0.05 or P<0.01). Compared with normal control group of rats, FHS+AIA group of rats showed significantly elevated fluorescent intensities of CD4+pSTAT3+, CD4+IL-17+pSTAT4+ and CD4+IL-17+pSTAT6+ proteins in the peripheral blood, markedly decreased mRNA level of Foxp3 and significantly increased mRNA levels of RORγt, STAT3, STAT4, and STAT6 detected in CD4+T cells, the difference was statistically significant (P<0.05 or P<0.01). Conclusion FHS exogenous pathogenic factors may activate the differentiation of CD4+Th17 cells and inhibit the differentiation of Treg cells through the JAK/STAT signaling pathway, leading to imbalance of Th17/Treg cells, thus promoting the occurrence of RA syndrome.
〔Keywords〕 rheumatoid arthritis; Bi syndrom; wind-cold-damp exogenous pathogenic factors; Th17/Treg; JAK/STAT signaling pathway
類風濕關節炎(rheumatoid arthritis, RA)是一種以關節滑膜慢性炎癥、軟骨及骨組織侵蝕,最終導致關節結構破壞、畸形為主要臨床特征的慢性、系統性自身免疫疾病[1]。流行病學研究[2-3]表明,全球RA發病率約為0.5%~1.2%,我國RA患病率約為0.28%~0.36%,其5年致殘率高達30%~50%,至今仍缺乏理想的治療藥物與方法,是造成勞動力喪失及致殘的主要疾病之一。RA病因不明,發病機制復雜,目前認為主要與遺傳、飲食和環境等因素有關[4]。根據其臨床癥狀和體征,RA屬于中醫學“痹證”范疇,與中醫古籍所記載的“歷節”“鶴膝風”“尪痹”等病證相似[5]。對其病因病機的認識,《素問·痹論》有云:“風寒濕三氣雜至,合而為痹也。其風氣勝者為行痹、寒氣勝者為痛痹、濕氣勝者為著痹也”“不與風寒濕氣合,故不為痹”[6-7]。另外,痹的產生與飲食和生活環境有關,所謂“食飲居處,為其病本也”[6]。
基于“風寒濕三氣雜至合而為痹也”的中醫經典理論和現代醫學對于環境因素在RA發病機制中重要作用的認識,推測“風寒濕”外邪能顯著影響RA的發生和/或發展。選擇應用最廣泛的經典佐劑性關節炎(adjuvant-induced arthrtis, AIA)動物模型,采用改良人工智能氣候箱,給予大鼠風寒濕刺激,再誘導AIA的方案,研究“風寒濕”外邪刺激對AIA發生發展的影響[8]。李鑫等[9]研究表明,“風寒濕”外邪只影響AIA的發生,其在疾病初發階段中醫證候表現為風寒濕痹證。
RA的特征是以大量CD4+T細胞浸潤為主的慢性滑膜炎癥反應,而大鼠AIA也是一種T細胞介導的免疫性炎癥動物模型[10]。CD4+T細胞作為效應T細胞的重要成分,可參與免疫應答過程中的各個階段,其介導的免疫反應異常被認為是RA的主要發病機制之一[9-10]。用流式細胞儀初步檢測了風寒濕刺激14 d后大鼠外周血T細胞種類和表面抗原,顯示CD4+T細胞亞群數量明顯升高[9]。根據其產生的細胞因子及其與之相關的功能不同,通常將CD4+T細胞分為Th1、Th2、Th17和Treg四大亞群。課題組前期研究發現,與正常飼養大鼠比較,風寒濕刺激大鼠可見CD4+Th17細胞亞群明顯增多,血清IL-17含量顯著升高[11]。因此,本研究主要圍繞CD4+Th17分化和Th17/Treg失衡,進一步深入探討“風寒濕”外邪影響類風濕關節炎(痹證)發生的分子機制,以期為中醫論治痹證與相關藥物研發提供參考。
1 材料
1.1? 實驗動物
SPF級SD雄性大鼠,體質量為90~110 g,購自湖南斯萊克景達實驗動物有限公司,許可證號:SCXX(湘)2011-0003,合格證編號:43004700008303;43004700008412;43004700008456;43004700008423。飼養處及實驗地:湖南中醫藥大學實驗動物中心SPF級實驗室,許可證號:SYXK(湘)2019-0009,室溫(22±3) ℃,相對濕度40%~70%,自由采食,分籠飼養。動物房中明暗交替(12 h白天∶12 h黑夜),動物適應環境7 d后開始進行實驗。
1.2? 主要試劑
熱滅活結合桿菌H37Ra(批號:20170320)、礦物油(批號:M8410)、Ficoll淋巴細胞分離液(批號:F4375)均購自美國Sigma Aldrich公司;抗鼠CD4抗體(批號:11-0040-81)、抗鼠IL-17抗體(批號:12-7177-81)、抗鼠CD25抗體(批號:12-0251-81)、抗鼠pSTAT3抗體(批號:MA5-32089)、抗鼠pSTAT4抗體(批號:71-7900)、抗鼠pSTAT6抗體(批號:PA5-104892)、抗鼠Foxp3-APC抗體(批號:17-5773-80)、試劑A破膜劑(批號:23228)、試劑B破膜劑(批號:23224)均購自美國eBioscience公司;異氟烷氣體麻醉劑(深圳市瑞沃德生命科技有限公司,批號:084989);逆轉錄試劑盒(美國ABI公司,批號:4374967);SYBR Premix Ex TaqTM II RORγt試劑盒(上海生物工程技術公司,批號:B110032)。
1.3? 主要儀器
改良人工智能氣候箱(上海汗諾儀器公司,型號:PRX-150);250i細胞二氧化碳培養箱(型號:51033587)、超微量核酸定量檢測儀(型號:701-058112)均購自美國Thermo Fisher公司;全自動細胞計數器(美國Bio-Rad公司,型號:TC20);熒光定量PCR儀(瑞士Roche公司;型號:AXYPCR384LC480CNF);氣體麻醉機(美國SurgriVet公司,型號:SurgiVet CDS9000);流式細胞分析儀(美國Becton Dickinson公司,型號:TM X-20);臺式超高速冷凍離心機(美國Beckman Coulter公司,型號:Allegra 64R);電子天平(日本島津公司,型號:ATY224)。
2 方法
2.1? AIA風寒濕痹大鼠體內Th17/Treg細胞失衡檢測
2.1.1? 分組與造模? 動物模型構建參考文獻[8-9],90只雄性SD大鼠隨機分為正常對照組、單純AIA組和AIA風寒濕痹組,每組30只。正常對照組和單純AIA組大鼠正常飼養14 d;AIA風寒濕痹組大鼠每天置于人工智能氣候箱內接受風寒濕刺激(風速5 m/s、溫度0~2 ℃、相對濕度90%~95%)1次,每次4 h,14 d后,除正常對照組外,其他兩組于尾根部皮下注射0.1 mL含200 g Mtb的CFA誘導AIA,AIA風寒濕痹組CFA免疫后繼續接受風寒濕刺激6 d。
2.1.2? AIA關節炎指數評定? CFA免疫后,依據大鼠多發性關節炎的特性,采用5級評分法[12]對CFA免疫后的大鼠進行關節炎指數評分:正常情況,無紅腫,計0分;腳趾關節紅斑或輕度紅腫,計1分;趾關節和足跖或踝關節中度紅腫,記2分;踝關節以下足爪全部紅腫或者踝關節重度紅腫,計3分;裸關節在內全部足爪紅腫變形,計4分,最高每只可達16分。
2.1.3? 流式細胞術檢測外周血CD4+Th17和CD4+CD25+Foxp3+Treg的細胞比例? CFA免疫前1天、免疫后第6、10天分別麻醉大鼠,腹主動脈取血,用淋巴細胞分離液分離出外周血單核細胞(peripheral blood mononuclear cell, PBMCs),用RPMI 1640培養液制成單細胞懸液,調整細胞密度為1×107/mL,稀釋FITC標記的抗鼠CD4抗體(1∶200),每個樣本2.0 μL染色30 min,冰上孵育;洗滌后,按細胞內染色試劑盒說明書進行后續細胞內染色;固定破膜,洗滌3次;分別加稀釋PE標記的抗鼠IL-17(1∶400)、Foxp3-APC(1∶300)和CD25-PE抗體(1∶400),4 ℃避光孵育30 min,洗滌,對照管加入同型對照。上流式細胞分析儀檢測,應用BD Cell Quest軟件獲取數據進行分析。
2.2? AIA風寒濕痹大鼠JAK/STAT信號通路檢測
2.2.1? 分組與造模? 雄性SD大鼠,體質量90~110 g,隨機分為正常對照組和AIA風寒濕痹組,每組10只。正常對照組大鼠正常飼養;AIA風寒濕痹組大鼠風寒濕刺激14 d后,于尾根部皮下免疫含Mtb的CFA,繼續接受風寒濕刺激6 d,風寒濕刺激和AIA免疫方法同“2.1.1”項。
2.2.2? 流式細胞術檢測外周血CD4+T細胞pSTAT3蛋白、CD4+IL-17+淋巴細胞pSTAT4和pSTAT6蛋白的含量? CFA免疫后14 d,麻醉大鼠,腹主動脈取血,用淋巴細胞分離液分離出PBMCs,用RPMI 1640培養液制成單細胞懸液,調整細胞密度為1×107/mL。以稀釋后的CD4-FITC(1∶200)設門,固定破膜,根據需要,分別用稀釋后的IL-17-APC(1∶300)、pSTAT3-PE(1∶400)、pSTAT4-PE(1∶400)、pSTAT6-PE(1∶400)染色,洗滌后上機檢測。CD4+pSTAT3+蛋白平均熒光強度代表CD4+T細胞JAK/STAT信號通路活化狀態。CD4+IL-17+pSTAT4+和CD4+IL-17+pSTAT6+蛋白平均熒光強度代表CD4+T細胞中Th17細胞JAK/STAT通路的活化狀態。
2.2.3? RT-PCR檢測外周血CD4+T細胞中RORγt、Foxp3、STAT3、STAT4和STAT6 mRNA表達? PBMCs經免疫磁珠法分選CD4+T細胞,設計引物,其中各基因PCR引物序列見表1。Trizol提取滑膜組織總RNA,紫外分光光度計測定RNA含量及純度,逆轉錄合成cDNA,并進行定量PCR擴增。以GAPDH為內參。數據以ABI自帶軟件SDS對RT-PCR進行分析,RORγt mRNA表達水平代表Th17細胞水平,Foxp3 mRNA表達水平代表Treg細胞水平,STAT3、STAT4、STAT6 mRNA表達水平代表CD4+T細胞JAK/STAT通路的活化狀態。
2.3? 統計學分析
采用SPSS 23.0統計軟件進行分析,計量資料描述用“x±s”表示,兩組間比較采用獨立樣本t檢驗,多組間均數比較采用單因素方差分析,方差齊時,用LSD法;方差不齊時,用Dunnett3法。以P<0.05為差異有統計學意義,P<0.01為差異有顯著統計學意義。
3 結果
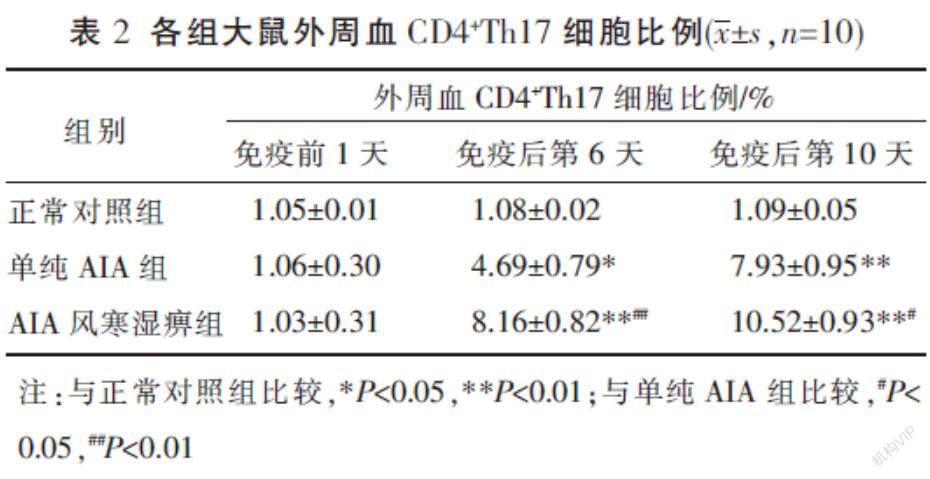
3.1? 各組大鼠外周血CD4+Th17細胞比例
免疫前1天,各組間的CD4+Th17細胞比例比較,差異無統計學意義(P>0.05)。在免疫后第6、10天,與正常對照組相比,單純AIA組及AIA風寒濕痹組大鼠的外周血CD4+Th17細胞比例均增加(P<0.05,P<0.01);同時間點,AIA風寒濕痹組與單純的AIA組相比,CD4+Th17細胞比例增加(P<0.05,P<0.01)。見表2。
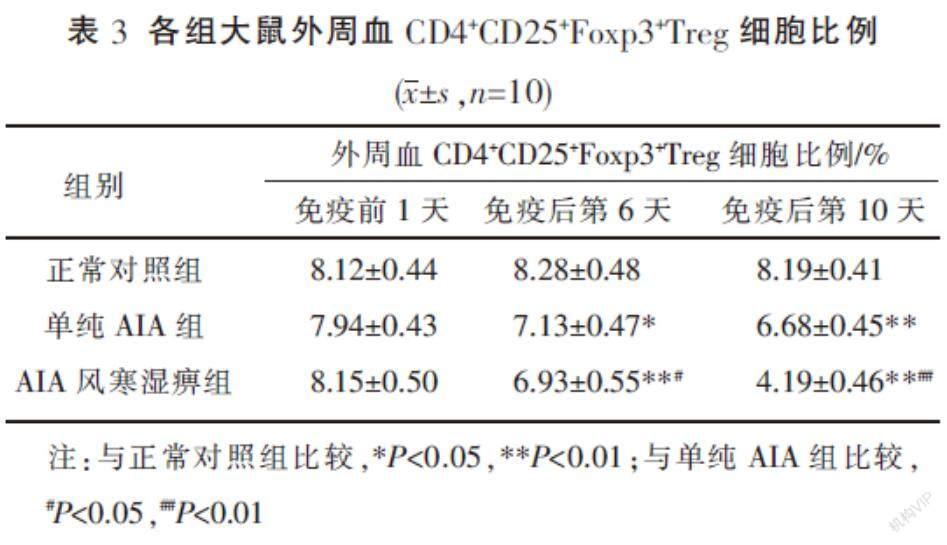
3.2? 各組大鼠外周血CD4+CD25+Foxp3+Treg細胞比例 免疫前1天,各組間的CD4+CD25+Foxp3+Treg細胞比例比較,差異無統計學意義(P>0.05)。在免疫后第6、10天,與正常對照組相比,單純AIA組及AIA風寒濕痹組大鼠的外周血CD4+CD25+Foxp3+Treg細胞比例均降低(P<0.05,P<0.01);同時間點,AIA風寒濕痹組與單純AIA組相比,CD4+CD25+Foxp3+Treg細胞比例降低(P<0.05,P<0.01)。見表3。
3.3? 各組大鼠外周血CD4+pSTAT3+、CD4+IL-17+pSTAT4+和CD4+IL-17+pSTAT6+蛋白表達比較
與正常對照組比較,AIA風寒濕痹組外周血CD4+pSTAT3+、CD4+IL-17+pSTAT4+及CD4+IL-17+pSTAT6+蛋白表達量增加(P<0.05,P<0.01)。見表4。
3.4? 各組大鼠外周血CD4+T細胞中RORγt、Foxp3
mRNA表達水平比較
與正常對照組比較,AIA風寒濕痹組外周血CD4+T細胞中Foxp3 mRNA表達量降低,RORγt mRNA表達量增加(P<0.01)。見表5。
3.5? 各組大鼠外周血CD4+T細胞中STAT3、STAT4、STAT6 mRNA表達水平比較
與正常對照組比較,AIA風寒濕痹組外周血CD4+T細胞中STAT3、STAT4、STAT6 mRNA表達量增加(P<0.05,P<0.01)。見表6。
4 討論
RA屬于中醫“痹證”中最為常見的臨床疾患之一,是一種以慢性侵蝕性關節炎為主要特征的自身免疫性疾病。RA病因不明,發病機制復雜,其分子病理特征是以大量CD4+T細胞浸潤為主的慢性滑膜炎癥反應。Th17細胞是CD4+T細胞新亞型,高分泌IL-17等炎性細胞因子,促進炎癥反應和延續骨破壞進程[13]。RA患者外周血CD4+T細胞中Th17細胞的比例增加,而Treg細胞的比例降低,導致Th17/Treg細胞失衡,而Treg細胞通過直接接觸或產生抑制性細胞因子(如TGF-、IL-10)對自身反應T細胞活化和增殖起負調控作用[14-15]。本研究結果顯示,RA風寒濕痹大鼠存在Th17/Treg細胞失衡現象,風寒濕刺激大鼠外周血CD4+Th17細胞比例較單純AIA組顯著增加(P<0.05,P<0.01),Treg細胞比例顯著降低(P<0.05,P<0.01),Th17/Treg細胞比例處于失衡狀態。
有研究[16]表明,JAK/STAT信號通路活化參與RA的發生,且炎癥位點中的T細胞分化由JAK/STAT信號通路激活所介導。在樹突細胞、單核細胞等抗原呈遞細胞(antigen presenting cell, APC)作用下,IL-6協同低濃度的TGF-β,激活JAK1,進而招募STAT3,并使其磷酸化,活化的JAK1/STAT3通路激活RORγt,使初始 CD4+T細胞向Th17細胞分化[17-18]。同時,在Th17分化的負向調節研究中,細胞因子信號轉導抑制蛋白因子3(suppressor of cytokine signaling3, SOCS3)是重要的負向調節因子,它通過抑制STAT3的磷酸化發揮作用[19]。RORγt被認為是Th17細胞譜系特異性的轉錄激活因子,可誘導調控IL-17的高水平分泌,并抑制Treg細胞分化[20]。Th17細胞被轉錄因子STAT4和STAT6調控,生成IL-17,同時可產生IL-23、IL-6和TNF-α等炎性細胞因子,IL-23可促進激活的記憶細胞產生IL-17,使Th17細胞得以存活和維持功能[17]。Foxp3是Treg的特異性標志物,其持續表達是維持Treg活性的關鍵因素。研究[21-22]表明,RA患者外周血RORγt表達量顯著增加,Foxp3表達量顯著降低。本研究結果顯示,AIA風寒濕痹大鼠外周血RORγt表達量顯著增加,Foxp3表達量顯著降低,與文獻報道一致,提示AIA風寒濕痹大鼠Th17/Treg細胞處于失衡狀態。研究[23-24]顯示,RA患者STAT3、STAT4、STAT6 mRNA表達量顯著增加。本研究結果顯示,AIA風寒濕痹大鼠外周血CD4+T細胞中STAT3、STAT4、STAT6 mRNA表達量顯著增加(P<0.05,P<0.01),RORγt和Foxp3 mRNA表達量也顯著增加(P<0.05,P<0.01),提示JAK/STAT信號通路活化并參與了炎癥位點中的T細胞分化。
綜上,“風寒濕”外邪可能通過激活JAK/STAT信號通路,并在STAT3、STAT4、STAT6、RORγt及Foxp3 mRNA的參與下,激活Th17細胞分化,并抑制Treg細胞分化,導致Th17/Treg細胞失衡,從而促進炎癥發生。
參考文獻
[1] SMOLEN J S, ALETAHA D, BARTON A, et al. Rheumatoid arthritis[J]. Nature Reviews Disease Primers, 2018, 4: 18001.
[2] SAFIRI S, KOLAHI A A, HOY D, et al. Global, regional and national burden of rheumatoid arthritis 1990-2017: A systematic analysis of the Global Burden of Disease study 2017[J]. Annals of the Rheumatic Diseases, 2019, 78(11): 1463-1471.
[3] LI Z G. A new look at rheumatology in China—opportunities and challenges[J]. Nature Reviews Rheumatology, 2015, 11(5): 313-317.
[4] 栗占國.類風濕關節炎年度回顧[J].醫學研究雜志,2013,42(3):4-5.
[5] 林? 也,廖? 菁,戴宗順,等.風寒濕外邪作用于EPO影響痹證(類風濕關節炎)的發生[J].湖南中醫藥大學學報,2021,41(3):345-349.
[6] 潘胡丹,劉? 良.類風濕關節炎中醫治療經驗探討[J].中醫雜志,2016,57(2):173-175.
[7] 吳晉英,李俊蓮,張世霞.《金匱要略》痹證探析[J].中國中醫基礎醫學雜志,2013,19(5):496,520.
[8] 林? 也,戴宗順,張? 婷,等.基于“以方測證”的類風濕關節炎風寒濕痹證動物模型的構建研究[J].湖南中醫藥大學學報,2021,41(5): 668-672.
[9] 李? 鑫,魏艷霞,林? 也,等.風寒濕外邪對痹證(佐劑性關節炎)發生發展的影響[J].中國中西醫結合雜志,2017,37(12):1496-1501.
[10] VAN EDEN W, WAKSMAN B H. Immune regulation in adjuvant-induced arthritis: Possible implications for innovative therapeutic strategies in arthritis[J]. Arthritis & Rheumatism, 2003, 48(7): 1788-1796.
[11] 林? 也.基于以方測證的類風濕關節炎風寒濕痹病證結合動物模型構建研究[D].長沙:湖南中醫藥大學,2019.
[12] CAI X, WONG Y F, ZHOU H, et al. The comparative study of Sprague-Dawley and Lewis rats in adjuvant-induced arthritis[J]. Naunyn-Schmiedebergs Archives of Pharmacology, 2006, 373(2): 140-147.
[13] MIOSSEC P, KORN T, KUCHROO V K. Interleukin-17 and type 17 helper T cells[J]. The New England Journal of Medicine, 2009, 361(9): 888-898.
[14] BETTELLI E, CARRIER Y, GAO W D, et al. Reciprocal
developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells[J]. Nature, 2006, 441(7090): 235-238.
[15] BEHRENS F, HIMSEL A, REHART S, et al. Imbalance in distribution of functional autologous regulatory T cells in rheumatoid arthritis[J]. Annals of the Rheumatic Diseases, 2007, 66(9): 1151-1156.
[16] KRAUSE A, SCALETTA N, JI J D, et al. Rheumatoid arthritis synoviocyte survival is dependent on Stat3[J]. Journal of Immunology, 2002, 169(11): 6610-6616.
[17] MATHUR A N, CHANG H C, ZISOULIS D G, et al. Stat3 and Stat4 direct development of IL-17-secreting Th cells[J]. Journal of Immunology (Baltimore, Md : 1950), 2007, 178(8): 4901-4907.
[18] WU H X, YAN S X, CHEN J Y, et al. JAK1-STAT3 blockade by JAK inhibitor SHR0302 attenuates inflammatory responses of adjuvant-induced arthritis rats and decreases Th17 and total B cells[J]. Joint Bone Spine, 2016, 83(5): 525-532.
[19] KIM E K, KWON J E, LEE S Y, et al. IL-17-mediated mitochondrial dysfunction impairs apoptosis in rheumatoid arthritis synovial fibroblasts through activation of autophagy[J]. Cell Death & Disease, 2017, 8(1): e2565.
[20] KLUGER M A, NOSKO A, RAMCKE T, et al. RORγt expression in Tregs promotes systemic lupus erythematosus via IL-17 secretion, alteration of Treg phenotype and suppression of Th2 responses[J]. Clinical and Experimental Immunology, 2017, 188(1): 63-78.
[21] SUN H Q, GAO W W, PAN W P, et al. Tim3+Foxp3+ tregcells are potent inhibitors of effector T cells and are suppressed in rheumatoid arthritis[J]. Inflammation, 2017, 40(4): 1342-1350.
[22] KANEKO S, KONDO Y, YOKOSAWA M, et al. The RORγt-CCR6-CCL20 axis augments Th17 cells invasion into the synovia of rheumatoid arthritis patients[J]. Modern Rheumatology, 2018, 28(5): 814-825.
[23] WALKER J G, AHERN M J, COLEMAN M, et al. Expression of Jak3, STAT1, STAT4, and STAT6 in inflammatory arthritis: Unique Jak3 and STAT4 expression in dendritic cells in seropositive rheumatoid arthritis[J]. Annals of the Rheumatic Diseases, 2006, 65(2): 149-156.
[24] 呂? 卓,李? 娟,馮知濤,等.RA患者外周血HLA-DR4、PAD4、STAT4 mRNA表達及與疾病活動的相關性[J].南方醫科大學學報,2010,30(6):1349-1353.
(本文編輯? 匡靜之 周? 旦)

