黑果小檗總花色苷對帕金森大鼠認知行為能力、神經保護及Klotho基因表達的研究
李文杰,羅遠,劉婷,姚麒
帕金森病(PD)主要病理改變為多巴胺能神經元缺失,屬于中樞神經系統退行性疾病,而PD患者最常見的非運動癥狀就是認知功能障礙(CI)[1]。黑果小檗是一種落葉灌木植物,資源豐富,具有強胃、生津止渴、清熱解毒的功效[2]。有研究發現,黑果小檗果實中花色苷具有增強抗氧化防御系統,提高老齡動物的記憶力,調節膽堿能神經傳遞等治療神經退行性疾病的作用[3]。Klotho是一種衰老抑制基因,Kl蛋白功能下降會導致多巴胺能神經元的數量下降,抑制多巴胺的合成,PI3K-PKB磷酸化激活轉錄調節因子FoxO,進而參與神經元細胞凋亡、衰老及代謝[4]。本研究探究黑果小檗總花色苷(BHSTA)對帕金森大鼠的認知行為能力、神經保護及Klotho基因表達的影響,報道如下。
1 材料與方法
1.1 實驗動物 80只SPF級雄性大鼠,體質量220~250 g,8周齡,均置于溫度為22~25℃,濕度為40%~50%的動物房內統一飼養。
1.2 藥材 黑果小檗源于烏魯木齊市南山山區,經鑒定為小檗科小檗屬植物黑果小檗的果實,提純后得到BTA凍干粉末(含量為39%)。
1.3 試劑 鹽酸阿撲嗎啡,6-羥基多巴(6-OHDA),多聚甲醛,中性樹脂,Klotho抗體、Foxo3a及P-Foxo 3a抗體。
1.4 PD大鼠模型制備 80只大鼠隨機分為假手術組15只,模型組65只,將65只大鼠參照文獻[5]中雙靶點注射法制備PD-CI大鼠模型。水合氯醛麻醉大鼠并固定,大鼠的頭部用腦立體定位儀固定,在黑質致密部和中腦腹側被蓋區,15 min內用微量注射器注入4 g/l的6-OHDA。7 d后,大鼠均腹腔注射0.5mg/kg鹽酸阿撲嗎啡,誘導大鼠的旋轉行為,并記錄注射后30 min內的旋轉次數。模型制備成功標準:旋轉次數≥7次/min。在制成PD大鼠模型過程中有5只大鼠死亡,剩下60只大鼠均制備成功。假手術組大鼠注射等量含0.2 g/L抗壞血酸的0.9%氯化鈉注射液,手術方法同模型組。
1.5 大鼠分組及給藥 將造模成功的60只大鼠隨機分為模型組(予0.9%氯化鈉注射液灌胃)、低劑量組(予54.6mg/kg BHSTA灌胃)、中劑量組(予109.3 mg/kg BHSTA灌胃)和高劑量組(予218.6 mg/kg BHSTA灌胃),各15只。假手術組大鼠給予等量的0.9%氯化鈉注射液灌胃干預。1次/d,連續給藥28d。
1.6 神經行為學檢測 觀察大鼠行為改變,行旋轉誘導實驗,記錄30min內大鼠旋轉圈數,并計算其平均旋轉圈數。
懸掛實驗:將大鼠前肢懸掛于離地面30 cm高的金屬絲上,記錄從開始懸掛至落地時的時間并評分。評分標準:持續0~5 s記為0分,6~10 s記為1分;11~15s記為2分,16~20s記為3分,21~25 s記為4分,26~30 s記為5分,超過30 s記為6分,實驗3次,取平均值,每次實驗時間間隔約2 min。
1.7 Morris水迷宮實驗 將水池分為大小相同的4個象限,于3象限內的中間位置放置一個圓形的位于水面下2cm的黑色站臺,并在池壁內側做好不同形狀的標記。將攝像機置于迷宮的上方,記錄大鼠的運動軌跡。計算大鼠在平臺所有象限的距離百分比(PT%)和停留時間百分比(T%)。
1.8 樣本采集 行為學實驗結束后,取大鼠腦組織,分離獲得腦黑質,一部分用多聚甲醛固定,在4℃冰箱中保存備用;另一部分凍存于液氮中。
1.9 TUNEL染色檢測神經元凋亡 用多聚甲醛固定備用的腦黑質,24 h后石蠟包埋,切片,置于冰箱備用。取出切片,洗滌后封閉1 h。加入一抗在4℃的環境中孵育過夜;再次洗滌后加入帶有熒光標記的二抗,孵育1 h后洗滌,置于顯微鏡下觀察。
1.10 蛋白質印跡測定腦黑質中Klotho、Foxo3a、p-Foxo3a蛋白表達 取液氮凍存的腦黑質,研磨裂解后取蛋白樣本。取30g蛋白樣本煮沸、電泳、PVDF膜轉印,加入Klotho及p-Klotho一抗、Foxo3a及p-Foxo3a一抗、羊兔抗HRP標記二抗,蛋白質印跡法測定神經元內Klotho和p-Foxo3a蛋白表達,并測定蛋白的相對灰度值。
1.11 統計方法 采用SPSS 21.0統計軟件進行處理,計量資料用均數±標準差表示,多組比較采用單因素方差分析,組間比較采用Dunnett-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 BHSTA對大鼠的神經保護功能 與假手術組相比,模型組大鼠旋轉圈數增多,懸掛實驗評分降低(均P<0.05);低、中和高劑量組大鼠的旋轉圈數少于模型組,懸掛實驗評分高于模型組(均P<0.05);高劑量組大鼠旋轉圈數低于低劑量組,懸掛實驗評分高于低劑量組(均P<0.05),見表1。
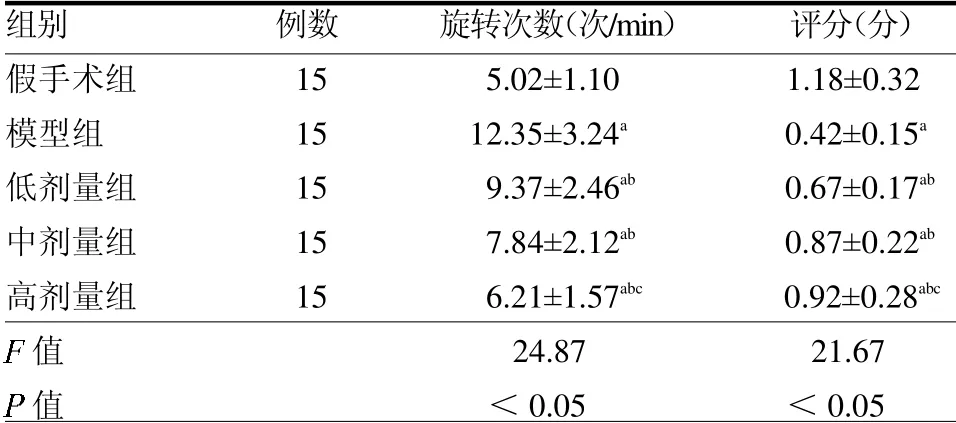
表1 各組大鼠旋轉圈數和懸掛實驗評分比較
2.2 BHSTA對大鼠認知功能影響 與假手術組相比,模型組大鼠PT%、T%值降低(均P<0.05);低、中和高劑量組PT%、T%值均高于模型組(均P<0.05);高劑量組大鼠PT%、T%均高于低劑量組(均P<0.05),見表2。
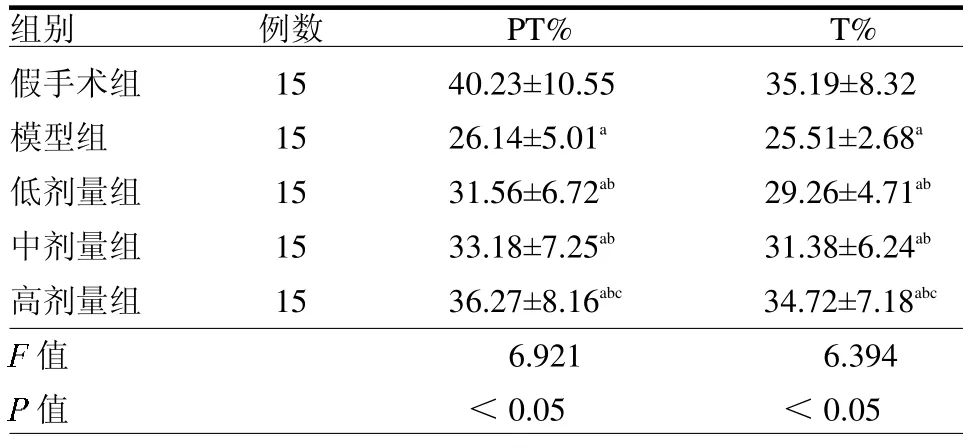
表2 各組大鼠PT%、T%比較
2.3 BHSTA對神經細胞凋亡的影響 相對于假手術組,模型組大鼠腦組織中神經細胞凋亡明顯增多(均P<0.05);而與模型組相比,低、中和高劑量組神經細胞凋亡均降低(均P<0.05),且凋亡程度呈濃度遞減趨勢,高劑量組神經細胞凋亡情況低于低劑量組(均P<0.05),見封二彩圖1。
2.4 Klotho、Foxo3a、p-Foxo3a蛋白的表達情況 與假手術組相比,模型組Klotho和Foxo3a蛋白表達顯著降低,p-Foxo3a蛋白表達明顯升高(均P<0.05);與模型組相比,低、中和高劑量組Klotho和Foxo3a蛋白表達均不同程度的增加,p-Foxo3a蛋白表達均顯著降低(均P<0.05),且高劑量組蛋白變化與低劑量組差異有統計學意義(均P<0.05),見封二彩圖2。
3 討論
PD是一種椎體外系變性疾病,臨床常用手術干預或藥物替代治療,但手術創傷和藥物依賴會加重認知障礙的風險[6]。黑果小檗果實中的花色苷有抗氧化、抗炎、抗凋亡等作用,常用于治療亨廷頓病、局部缺血性腦卒中等疾病[7],但關于BHSTA應用于PD的研究少有報道。本研究顯示模型組大鼠旋轉圈數增多,懸掛試驗評分降低;BHSTA干預后的低、中、高劑量組大鼠旋轉圈數減少,懸掛實驗評分升高。這提示BHSTA可改善PD大鼠的神經功能。水迷宮實驗結果顯示,BHSTA能增加PT%和T%值,增強PD大鼠的認知記憶能力。既往研究也證實,BHSTA可有效改善AD大鼠的CI和腦組織損傷[8]。
研究發現,PD患者臨床表現有腦萎縮,主要累及海馬、鉤回及后扣帶回等部位。PD-CI腦功能的退行性改變可能與海馬區神經元線粒體損傷、自由基調節失衡、能量代謝障礙或細胞衰老有關[9]。Klotho基因與衰老的調控關系密切,Klotho基因缺陷的大鼠通常會出現衰老等癥狀,通過增加Klotho基因表達,可抑制胰島素樣生長因子-1信號,進而延長大鼠的壽命,Klotho高表達可以抑制其下游Akt激活底物中的絲氨酸、蘇氨酸殘基磷酸化[10]。即Klotho減少會激活Akt通路,導致Foxo3a轉錄因子磷酸化和細胞中SOD表達減少,積聚MDA,進而對細胞中的蛋白質和DNA造成損傷,致細胞衰老。本研究結果顯示,模型組大鼠Klotho、Foxo3a表達顯著降低,p-Foxo3a表達升高。這說明PD大鼠神經元Foxo3a表達降低,使進入細胞核內的Foxo減少,引起細胞衰老;通過BHSTA干預使PD大鼠的Klotho、Foxo3a表達增加,減少PD大鼠的神經細胞衰老。王思夷等[11]研究證實,鹽酸多奈哌齊可能通過上調海馬區的Klotho表達,抑制Akt和Foxo3a磷酸化,提高血清SOD含量,進而提高PD大鼠的學習記憶能力。有研究表明黑豆提取物花色苷可提高老年大鼠學習能力,調控膽堿能神經傳遞及線粒體相關凋亡蛋白活性,從而降低神經元凋亡,對大鼠神經退行性病變、腦損傷等多種神經疾病均有一定改善作用[12]。
綜上所述,BHSTA可改善PD大鼠認知行為能力,保護大鼠的神經功能,其作用機制可能是通過調控Klotho、Foxo3a信號通路實現。

