SII NLR對2型糖尿病合并顱內動脈狹窄的預測價值
楊曉露 陸景紅 黃曉晴
顱內動脈狹窄(intracranial arterial stenosis,ICAS)是導致缺血性腦卒中的常見病因,具有較高的死亡率及致殘率。2型糖尿病(type 2 diabetes mellitus,T2DM)是臨床上較為常見的慢性非傳染病之一,有學者通過研究證實T2DM與ICAS之間存在明顯相關性。T2DM合并ICAS患者常出現頭痛、眩暈等癥狀就診,通過計算機斷層掃描血管造影(computed tomography angiography,CTA)影像檢查確診后可進行藥物治療,但ICAS發展緩慢且早期癥狀不典型,許多患者易被漏診和/或誤診而延誤治療時機;因此,T2DM合并ICAS的早期診斷在臨床治療中顯得尤為重要。有研究證實,中性粒細胞與淋巴細胞比值(neutrophil-to-lymphocyte ratio,NLR)、血小板與淋巴細胞比值(platelet-to-lymphocyte ratio,PLR)、C反應蛋白(C-ceactive protein,CRP)等炎癥因子在T2DM血管病變及顱內動脈粥樣硬化性狹窄的發生發展中具有重要作用。系統免疫炎癥指數(systemic immune-inflammation index,SII)作為一項聯合中性粒細胞、淋巴細胞及血小板的新型生物學指標,與非小細胞癌、腎細胞癌、口腔鱗癌等惡性腫瘤的發生、發展、治療及預后密切相關,逐漸成為臨床醫師關注的焦點,然而SII、NLR與T2DM合并ICAS的關系鮮有報道。本文旨在探究SII、NLR是否可作為T2DM合并ICAS的危險因素,以此為基礎構建預測模型,并比較分析兩者預測作用的優良性,為T2DM合并ICAS的早期診療提供理論依據。
1 資料與方法
1.1 一般資料 收集2019年3月至2021年3月安徽醫科大學附屬阜陽人民醫院神經內科收治的289名T2DM患者,根據CTA檢查結果,將合并ICAS者計為ICAS組(共176例),未合并ICAS者計為NS組(共113例)。本研究已通過安徽醫科大學附屬阜陽人民醫院醫學倫理會審批。
納入標準:①所有患者符合《2017年中國2型糖尿病防治指南》T2DM的診斷標準;②臨床資料完整;③身體狀況允許接受CTA檢查。排除標準:①近3周內有急慢性感染史、抗生素使用史;②并發腫瘤,嚴重肝功能或腎功能不全、其它內分泌、過敏性疾病、血液病或血液系統疾病;③并發各種自身免疫性疾病或服用免疫抑制劑。
1.2 方法
1.2.1 一般資料收集 記錄患者性別、年齡、身高、體質量、吸煙史、高血壓史、糖尿病史、冠心病史,并計算其身體質量指數(body mass index,BMI)。
1.2.2 血液資料采集 所有檢測對象在入院第2天清晨禁食、水8 h后抽取靜脈血進行生化、血常規、糖化血紅蛋白檢查,計算NLR、PLR 及SII,其中NLR=中性粒細胞計數/淋巴細胞計數、PLR=血小板計數/淋巴細胞計數,SII=(血小板計數×中性粒細胞計數)/淋巴細胞計數。記錄研究對象糖化血紅蛋白、總膽固醇、三酰甘油、高密度脂蛋白膽固醇、低密度脂蛋白膽固醇水平。
1.2.3 ICAS狹窄程度評估 所有檢測對象采用VC T64層螺旋CT機進行檢查。被分析的顱內動脈包括雙側頸內動脈虹吸段(intracranial internal carotid artery,I-ICA)、椎動脈顱內段(intracranial vertebral artery,I-VA)、基底動脈(basilar artery,BA)、大腦前動脈(anterior cerebral artery,ACA)、大腦中動脈(middle cerebral artery,MCA)及大腦后動脈(posterior cerebral artery,PCA)。判斷顱內動脈狹窄程度依據NASCET方法計算,狹窄率(%)=(1-最狹窄段殘留管徑/狹窄遠端正常動脈管徑)×100%;根據責任血管的狹窄程度分為正常或基本正常(狹窄率<20%)、輕度狹窄(20%≤狹窄率<50%)、中度狹窄(50%≤狹窄率<70%)、重度狹窄或閉塞(狹窄率≥70%)。將T2DM患者中狹窄率≥20%者納入ICAS組,狹窄率<20%者納入NS組。
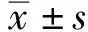
2 結果
2.1 兩組一般資料比較 ICAS組高血壓患病率、冠心病患病率、HbA1c、NLR、PLR、SII 值高于NS 組,差異均有統計學意義(P
<0.05)。見表1。
表1 兩組基線資料及實驗室指標比較
2.2 T2DM患者發生ICAS危險因素的logistic回歸分析 以單因素分析中P
<0.05的因素作為自變量[高血壓史、冠心病史(是=1,否=0);PLR、NLR、HbA1c、SII以原值錄入],以T2DM患者是否發生ICAS作為因變量(是=1,否=0)建立多因素logistic回歸分析模型,結果顯示SII、NLR為T2DM患者發生ICAS的預測因子(P
均<0.05)。見表2。
表2 T2DM患者發生ICAS危險因素的logistic回歸分析
2.3 T2DM患者發生ICAS的logistic回歸分析預測模型擬合優度 繪制T2DM患者發生ICAS的logistic回歸分析預測模型的Hosmer-Lemeshow擬合優度曲線,結果顯示模型預測值與實際觀測值之間差異無統計學意義(Hosmer-Lemeshowχ
=3.253,P
=0.197)。見圖1。
圖1 T2DM患者發生ICAS預測模型的擬合優度曲線
2.4 SII、NLR對T2DM患者發生ICAS的預測價值 以分組為狀態變量,狀態變量的值為1(表示“ICAS組”為狀態變量值),以NLR、SII為檢驗變量,繪制ROC曲線結果顯示,SII 預測T2DM發生ICAS的曲線下面積(area under curve,AUC)為0.983,最佳截斷點為450.930,NLR預測T2DM發生ICAS的AUC為0.900,最佳截斷點為2.255。見圖2。

圖2 SII預測T2DM合并ICAS的ROC曲線
2.5 不同危險因素對T2DM患者發生ICAS的預測效能比較 經比較,SII的AUC大于NLR的AUC,差異有統計學意義(P
<0.05)。見表3。
表3 SII、NLR對T2DM患者發生ICAS的預測效能比較
3 討論
T2DM患者遠期常出現神經血管代謝紊亂,導致胰島素抵抗、脂質堆積及應激等炎性因子異常釋放損傷血管內皮,促進動脈粥樣斑塊形成和破裂,加速動脈管腔狹窄形成。Wang等研究表明,T2DM是ICAS的獨立危險因素;Lam等通過調查也發現,T2DM患者易出現ICAS,且3年內發生中風的風險高于同齡人。近年流行病學研究顯示,隨著生活水平的提高,T2DM合并ICAS患者患病率呈上升趨勢,導致患者住院頻次增加、治療時間延長,致死、致殘率升高,造成巨大的社會經濟負擔。CTA 可提供顱內動脈病變的具體信息,但也存在輻射暴露及使用碘化對比劑出現過敏和腎損害等風險,且花費較高。SII、NLR是基于中性粒細胞、淋巴細胞等計算的綜合性指標,在臨床上具有易檢測、價格低廉等特點。因此,探究SII、NLR對T2DM患者發生ICAS的預測作用在指導臨床工作中具有深刻意義。
本研究通過多因素分析得出,SII、NLR為T2DM患者合并ICAS的危險因素,具有一定預測價值;這與Zhang等研究結論相似,其研究發現NLR是誘發血管病變的重要因素,此外,此研究認為中性粒細胞可通過釋放基質蛋白酶、腫瘤壞死因子-α和彈性蛋白酶來誘導血腦屏障破壞和顱內動脈內膜損傷。Liu等分析發現高NLR為腦缺血早期診斷及不良后果的預測因子。筆者認為:高血糖可引起細胞內酸中毒、自由基形成及線粒體功能障礙,對顱內動脈內膜細胞造成巨大創傷,而中性粒細胞及淋巴細胞的過度表達失衡導致NLR異常變化,此外,血小板的增加可通過招募中性粒細胞和激活白細胞介素來誘導腦繼發性損傷,SII在NLR的基礎上聯合血小板對血管病變的評估可能更合理有效。本研究中,SII與NLR的AUC比較顯示,SII預測效能高于NLR。這與部分學者的研究結果一致。Trifan等通過研究發現,SII較NLR的靈敏度高,此外,其認為SII、NLR對腦缺血的預測作用是炎性因子過度表達、代償失衡所致;當ICAS發生時,大腦慢性代償,中性粒細胞釋放多種炎性因子;同時,大量血小板在血管狹窄處通過P-選擇蛋白糖蛋白配體-1配體與浸潤的中性粒細胞相互作用,活化血小板、改變內皮細胞特性促使更多中性粒細胞遷移聚集,加重了血管損傷。
SII是由Hu等提出的由中性粒細胞、淋巴細胞和血小板組成的新型生物標志物,易于檢測且價格低廉,是基于中性粒細胞、淋巴細胞和血小板的綜合性指標,相比NLR,PLR可更全面反映機體炎癥、免疫和凝血3者的平衡關系。研究發現,中性粒細胞與動脈粥樣硬化相關,其機制可能為中性粒細胞受到刺激時,能夠激活炎性細胞并釋放多種炎性介質,引起內皮細胞功能紊亂,進而促進動脈粥樣硬化不穩定斑塊的形成和破裂,形成血栓,最終導致動脈管腔狹窄。血小板異常堆積可引起內皮細胞和白細胞釋放炎性因子,進而引起單核細胞集聚黏附、導向性遷移,加速動脈硬化發展。
綜上所述,SII、NLR為T2DM患者合并ICAS的危險因素,二者對T2DM合并ICAS具有預測價值,且SII的預測效能優于NLR。本研究樣本量小,未動態監測炎癥指標變化,可能存在統計學偏倚;將來可通過開展大樣本臨床研究進一步對SII、NLR的作用進行驗證,為T2DM合并ICAS的早期診療提供可靠指標。

