黃胸鼠Ldha基因的克隆、原核表達及酶學性質研究
倪玉芳,張樹軍,方天星,萬軍,陳潔,曾凡才*
(1.西南醫科大學基礎醫學院生物化學與分子生物學實驗室,四川瀘州646000;2.西南醫科大學附屬醫院核醫學科,四川瀘州646000)
乳酸脫氫酶(lactate dehydrogenase,LDH)主要催化丙酮酸和乳酸之間相互轉變的可逆反應,是生物體內參與糖的無氧氧化和糖異生兩大代謝途徑的重要酶(Khanetal.,2020)。研究認為腫瘤是一種代謝病,LDH作為腫瘤細胞有氧酵解途徑中的重要酶,在腫瘤的發生、發展、治療和診斷中發揮作用(Fengetal.,2018)。LDH作為一個在從低等生物到高等生物中都普遍存在的酶,由Ldha、Ldhb、Ldhc和Ldhd4種基因編碼,其中與人類關系最密切、表達最普遍的是由Ldha和Ldhb基因編碼的 M和H 2種亞基形成的四聚體同工酶,這2種蛋白亞基可組合形成LDH1(H4)、LDH2(H3M1)、LDH3(H2M2)、LDH4(H1M3)和LDH5(M4)5種同工酶(Valvonaetal.,2016)。這5種同工酶分別以丙酮酸和乳酸作為底物的Km不同,其功能也有所不同。全部由Ldha基因編碼的LDH5同工酶與丙酮酸親和力大,主要催化丙酮酸向乳酸轉變,它是催化腫瘤細胞有氧酵解途徑的主要酶。因此,Ldha基因在腫瘤細胞中一般會高表達,以形成更多LDH5同工酶。由于LDH在糖分解代謝途徑中的特殊位置,如果抑制其活性不會影響正常細胞通過糖的有氧氧化供能,但會抑制腫瘤細胞通過有氧酵解供能且不能再提供腫瘤細胞所需的酸性微環境。因此,LDH被認為是抗腫瘤的理想靶點之一(Augoffetal.,2015)。許多研究都希望找到能抑制LDH的藥物,但尚未見正式上市應用于臨床的LDH抑制劑藥物(丘金梅等,2020)。其中一個原因是LDH的結構與催化機制的關系并未完全清楚,特別是不同物種LDH氨基酸序列之間的差異與酶的催化機制和酶學性質等的關系還不清楚。由此可見,分析更多物種LDH氨基酸序列的差異與酶學性質的關系十分必要。
黃胸鼠Rattustanezumi屬于鼠科Muridae大鼠屬,又稱黃腹鼠、長尾鼠等,主要分布于我國,與褐家鼠R.norvegicus、小家鼠Musmusculus統稱為三大家棲鼠種(鄭智民等,2008;Yinetal.,2021)。目前黃胸鼠在我國的分布逐漸北移,在許多地方已成為了優勢種群,它們不僅危害糧食生產,也是鼠疫、流行性出血熱、鉤端螺旋體病等多種傳染病病原體的重要傳播媒介(胡秋波等,2014;楊新根等,2019;Wangetal.,2020)。黃胸鼠雖然在我國分布廣、危害大,但對其研究并不多見,特別是分子水平的研究,更是未見關于LDH的相關報道。大鼠和小鼠作為最常用的實驗動物,也是用于LDH研究的最主要實驗動物。黃胸鼠與大鼠同屬不同種,比較它們的LDH氨基酸組成差異與酶學性質的關系,可為進一步理解LDH的催化機制提供幫助。
本研究首次克隆黃胸鼠的Ldha基因,并進行原核表達后檢測其酶活性和Km值等,可為后續研究鼠類LDH的結構、功能以及抑制劑的篩選等奠定基礎。
1 材料與方法
1.1 材料
1.1.1 主要試劑和實驗動物實驗鼠捕于四川省西南醫科大學校內。DH5α和BL21(DE3)大腸桿菌菌株、pET28α原核表達載體均為本實驗室保存。pGM-T Fast克隆試劑盒、快速質粒小提試劑盒、TIANScript cDNA第一鏈合成試劑盒、瓊脂糖凝膠DNA回收試劑盒、加A試劑盒、10×Taq Buffer、Taq DNA Polymerase、dNTP均購于天根生化科技(北京)有限公司。高保真DNA聚合酶、T4 DNA Ligase、限制性核酸內切酶Xhol和EcoRⅠ購于TaKaRa公司。其他生化試劑均為國產分析純。利用Primer Premier 5設計的Ldha引物:Ldha-F:CCGgaattcATGGCAACACTCAAGGACC;Ldha-R:GGCctcgagTCAGAACTGCAGCTCTTTCTG(小寫字母分別代表EcoRⅠ和Xhol酶切位點)。
1.1.2 主要實驗儀器普通PCR儀、超微量分光光度計、瓊脂糖凝膠成像系統、恒溫搖床、恒溫水浴箱、恒溫孵育箱、752紫外可見光分光光度計等。
1.2 實驗方法
1.2.1Ldha基因的克隆與表達載體構建一小塊新鮮黃胸鼠骨骼肌組織,液氮中研成粉末。稱取100 mg組織粉末并加入1 mL Trizol裂解液,室溫放置5 min,加入200 μL氯仿充分搖勻15 s,室溫放置2~3 min,12 000 r·min-14 ℃ 10 min。吸出上清并加入等體積異丙醇充分混勻,室溫靜止 10 min,12 000 r·min-14 ℃ 10 min,棄上清,加入75%乙醇1 mL,8 000 r·min-14 ℃ 5 min,棄上清后干燥沉淀,待乙醇揮發后加入20 μL DEPC處理水溶解RNA。根據TIANScript cDNA第一鏈合成試劑盒說明書,將RNA逆轉錄為cDNA。以新合成cDNA為模板,在高保真DNA聚合酶的催化下利用克隆引物Ldha-F、Ldha-R擴增目的基因。PCR擴增程序為:95 ℃ 5 min;95 ℃ 15 s,55 ℃ 15 s,72 ℃ 60 s,35次循環后,72 ℃ 10 min。采用加A試劑盒對目的基因3’端加上堿基A,純化后備用。
純化后的目的基因使用pGM-T Fast克隆試劑盒與pGM-T載體進行連接,將體系置于16 ℃過夜。利用熱激法將pGM-T-Ldha重組質粒轉化入DH5α感受態細胞中,菌落PCR篩選,雙酶切鑒定,測序確認,將克隆成功的重組質粒經Xhol和EcoRⅠ雙酶切后亞克隆至原核表達載體pET-28α。
1.2.2 生物信息學分析用ExPASy-Translate Tool對該氨基酸序列的分子質量、等電點等理化性質進行預測;MEGA分析幾個物種與黃胸鼠的親緣系數;用SOPMA和SWISS-MODEL對LDHA蛋白的二級結構和三級結構進行預測。
1.2.3 重組質粒的原核表達及條件優化將pET28α-Ldha重組質粒轉化入BL21(DE3)感受態細胞中,挑取單克隆細菌于含100 μg·mL-1卡那霉素的10 mL LB液體培養基中,180 r·min-137 ℃ 3 h,測得菌液OD600在0.6~0.8時加入終濃度為1 mmol·L-1IPTG,180 r·min-130 ℃下誘導蛋白表達。每次取1 mL菌液12 000 r·min-12 min,棄上清,加入PBS緩沖液清洗沉淀1次,用200 μL PBS緩沖液重懸沉淀,加入終濃度為1 mmol·L-1PMSF,超聲破碎儀的功率設為25%,超5 s,停9.9 s,共5次。取40 μL樣品加入5×Loading buffer 10 μL后煮沸 5 min 進行SDS-PAGE電泳鑒定蛋白表達。誘導時間點優化是加入IPTG后每小時取1 mL菌液進行鑒定,直到誘導8 h。不同溫度優化是在加入終濃度為1 mmol·L-1IPTG后分別在20 ℃、25 ℃、30 ℃、37 ℃下培養6 h,再取1 mL菌液進行鑒定。不同IPTG濃度優化是在測得菌液OD600在0.6~0.8時加入IPTG終濃度分別為0.1 mmol·L-1、0.5 mmol·L-1、1.0 mmol·L-1、1.5 mmol·L-1時,180 r·min-130 ℃ 6 h后取 1 mL菌液進行鑒定。
1.2.4 表達蛋白的純化與鑒定根據優化的條件誘導表達蛋白后,棄上清,用0.02 mol·L-1PBS緩沖液(pH8.0)重懸菌體,超聲破碎后15 000 r·min-14 ℃ 30 min,將上清經0.45 μm過濾后上樣于Ni-瓊脂糖凝膠6FF柱中,用含咪唑濃度分別為50 mmol·L-1、100 mmol·L-1、150 mmol·L-1、200 mmol·L-1、300 mmol·L-1、400 mmol·L-1和500 mmol·L-1的PBS緩沖液(pH8.0)進行蛋白洗脫,每個緩沖液進行1個柱體積的洗脫,收集相應的流出液進行SDS-PAGE及Western Blot鑒定。收集純化后的樣品透析濃縮后4 ℃保存。
1.2.5 表達蛋白的活性測定及酶學性質分析利用BCA蛋白定量試劑盒對純化蛋白進行定量測定。測定酶活性的實驗原理為LDH催化乳酸與丙酮酸的相互轉化,反應體系參照Worthington(http://www.worthington-biochem.com)推薦的方法。正反應體系為:0.2 mol·L-1Tris-HCl(pH7.3)的緩沖液2.8 mL,6.6 mmol·L-1的NADH 0.1 mL,30 mmol·L-1的丙酮酸鈉0.1 mL;逆反應體系:0.2 mol·L-1Tris-HCl(pH7.3)的緩沖液2.8 mL,6.6 mmol·L-1的NAD+0.1 mL,30 mmol·L-1的乳酸鈉0.1 mL。上述反應體系在加入100 μL LDHA純化表達蛋白(濃度稀釋至使ΔA340/min在線性范圍內)后20 s開始計時,每隔10 s在340 nm波長下檢測吸光度1次,共計時3 min。根據酶比活性計算公式U/mg=(ΔA340/min)×VT/6.22×m,式中,ΔA340/min為每分鐘吸光度的變化值,VT為總反應體積(mL),6.22為消光系數,m為蛋白含量(mg)(袁航等,2018)。
此外,采用本實驗室建立的LDH同工酶檢測方法檢測了LDHA表達蛋白的酶活性(Lietal.,2019)。取80 μL純化后的LDHA表達蛋白,加入20 μL 5×上樣緩沖液,上樣于0.5%的瓊脂糖凝膠,在pH8.6的TBE緩沖液中進行LDH同工酶電泳,電泳條件為100 V、3 h,電泳結束后放入新鮮配制的顯色液中,染色20~30 min后終止顯色反應并拍照保留。
采用雙倒數作圖法(Lineweaver-Burk法)測定LDHA純化蛋白的Km和Vmax(Talaiezadehetal.,2015)。在pH7.0、25 ℃的緩沖液的條件之下,分別測定LDHA蛋白在丙酮酸、NADH、乳酸、NAD+4種底物下的Km和Vmax,底物終濃度分別為丙酮酸(0.05~1.00 mmol·L-1)、NADH(0.066~0.220 mmol·L-1)、乳酸(10~300 mmol·L-1)、NAD+為(0.25~3.00 mmol·L-1)。
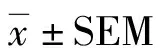
2 結果
2.1 Ldha基因的克隆與原核表達載體構建
利用NCBI的GenBank數據庫中與黃胸鼠親緣關系較近的褐家鼠Ldha基因mRNA參考序列(NM_017025.1)設計特異性引物。從黃胸鼠骨骼肌組織中提取總RNA,并通過RT-PCR擴增目的基因,在約1 000 bp處有1條明亮條帶,與目的片段大小一致(圖1:A)。膠回收該片段并克隆至pGM-T載體上,雙酶切鑒定和測序確認成功克隆了黃胸鼠Ldha基因編碼區序列,再亞克隆至pET28α原核表達載體,菌落PCR擴增結果顯示一明亮且大小正確條帶(圖1:B),樣品經雙酶切鑒定,目標條帶與預期大小一致(圖1:C),最后送公司測序確認重組原核表達載體pET28α-Ldha構建成功。
2.2 Ldha基因的生物信息學分析
ExPASy-Translate tool在線網站分析Ldha基因編碼序列共編碼332個氨基酸,分子量為36 388.47,分子式為C1632H2658N436O474S13,負電荷氨基酸殘基34個,正電荷氨基酸殘基38個,等電點為8.65。其中,亮氨酸(Leu)含量最高,占11.4%,半胱氨酸(Cys)含量最低,占1.5%。半衰期30 h(哺乳動物),親水性平均值0.069(>0),不穩定系數為23.38(<40);脂肪族指數較高(110.87),推測其為耐熱的穩定性蛋白。SMOPA預測LDHA蛋白的二級結構:α-螺旋43.37%、β-轉角7.83%、無規則卷曲28.92%、伸展片段19.88%(圖2:A)。SWISS-MODEL預測LDHA蛋白的三級結構:以螺旋為主,與LDHA二級結構相符(圖2:B)。在MEGA7.0中采用鄰近法(Neighbor-Joining,NJ)構建了Ldha序列系統進化樹,以斑馬魚Daniorerio作為外群,具有較高的節點支持率。結果顯示黃胸鼠與褐家鼠和黑家鼠R.rattus的親緣性最近,其次是小家鼠,且 4種鼠起源于一支(圖2:C)。與NCBI的GenBank數據庫中已有部分物種Ldha編碼序列進行比較,可知黃胸鼠Ldha編碼序列與褐家鼠和黑家鼠的一致性為99.30%,氨基酸的一致性為99.10%,說明黃胸鼠與褐家鼠、黑家鼠是近緣種,而與小家鼠的親緣關系較遠,與豚鼠Caviaporcellus和人Homosapiens的親緣關系更遠(表1)。
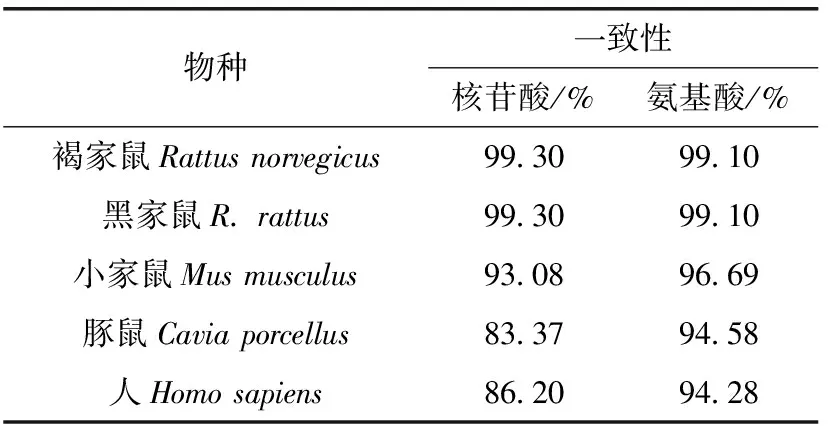
表1 黃胸鼠Ldha編碼序列和氨基酸序列與幾個物種的比較
2.3 LDHA蛋白的誘導表達及條件優化
將已轉入pET28α-Ldha重組質粒的菌株在 37 ℃含有100 μg·mL-1卡那霉素的條件下進行培養,當菌液的OD600在0.6~0.8之間時,加入終濃度為1 mmol·L-1的IPTG在30 ℃誘導4 h,收集誘導前后的菌液提取總蛋白進行SDS-PAGE鑒定,結果顯示蛋白表達成功(圖3:A)。按照1.2.3所述步驟進行蛋白原核誘導表達條件的優化,隨著時間的延長,表達蛋白的含量在不斷積累,但是當誘導表達6 h后蛋白表達量增加不明顯(圖3:B);隨著溫度的升高,表達蛋白含量也在不斷增加,但30 ℃與37 ℃的表達量相差不大(圖3:C);而IPTG藥物濃度對于蛋白的表達影響不明顯(圖3:D)。又由于低溫誘導可以提高大腸桿菌重組表達蛋白的可溶性,以及增加IPTG藥物濃度會影響大腸桿菌的基礎代謝。綜上,為獲得較大量可溶性蛋白的表達,蛋白表達的條件確定為:30 ℃ 6 h,IPTG的誘導濃度100 μmol·L-1。
2.4 LDHA蛋白的純化與鑒定
取經過誘導表達的菌液重懸于PBS緩沖液并超聲破碎,離心取上清過濾后上柱于Ni-瓊脂糖凝膠6FF柱進行純化,將純化過程中收集的洗脫樣品進行SDS-PAGE實驗驗證。結果顯示上清的穿透液基本上檢測不到目的蛋白,說明目的蛋白幾乎全部被吸附在親和層析柱上,當洗脫液的咪唑濃度在150 mmol·L-1和200 mmol·L-1可將目的蛋白大量洗脫(圖4:A),將這2種洗脫液的洗脫收集液進行透析和濃縮后作為后續實驗的純化蛋白樣品。將純化蛋白樣品進行Western Blot鑒定,應用LDHA特異抗體檢測,顯示此純化蛋白樣品為LDHA蛋白(圖4:B),表明所表達蛋白為黃胸鼠的LDHA蛋白。
2.5 LDHA表達蛋白的酶比活性測定和酶譜分析
由于LDH可催化乳酸與丙酮酸之間的相互轉變,因此黃胸鼠LDHA蛋白的酶比活性測定分為從丙酮酸至乳酸和從乳酸至丙酮酸2個方向,主要通過測定NADH的濃度變化來檢測LDH的活性。在同一反應條件之下,從丙酮酸至乳酸的比活性為113.760 U·mg-1±1.463 U·mg-1,而從乳酸至丙酮酸的比活性僅為2.180 U·mg-1±0.125 U·mg-1(圖5:A)。LDH同工酶酶譜顯示,純化的LDHA原核表達蛋白只有1條帶,其大小介于對照組的LDH4與LDH5之間,進一步說明純化的蛋白具有LDH的活性(圖5:B)。
2.6 LDHA蛋白的酶動力學性質分析
在pH7.0、25 ℃下,僅改變1種底物的濃度測定純化蛋白催化反應的速率,采用雙倒數作圖法(Lineweaver-Burk法)計算酶對不同底物的Km值和Vmax。結果顯示黃胸鼠LDHA純化蛋白對丙酮酸的Km值為0.170 mmol·L-1±0.193 mmol·L-1、Vmax為37.73 μmol·(L·min)-1±1.46 μmol·(L·min)-1(圖6:A);對還原性煙酰胺腺嘌呤二核苷酸(NADH)的Km值為0.088 mmol·L-1±0.008 mmol·L-1、Vmax為49.02 μmol·(L·min)-1±1.22 μmol·(L·min)-1(圖6:B);對乳酸的Km值為22.54 mmol·L-1±0.007 mmol·L-1、Vmax為10.87 μmol·(L·min)-1±0.33 μmol·(L·min)-1(圖6:C);對氧化性煙酰胺腺嘌呤二核苷酸(NAD+)的Km值為0.413 mmol·L-1±0.069 mmol·L-1、Vmax為6.301 μmol·(L·min)-1±0.05 μmol·(L·min)-1(圖6:D),這些結果在一定程度上表明LDHA蛋白與丙酮酸和NADH的親和力遠大于對乳酸和NAD+的親和力,再次說明LDHA酶蛋白更易催化丙酮酸轉變為乳酸。
3 討論
LDH作為參與體內糖代謝的重要酶,特別是在癌細胞的糖的有氧酵解代謝中處于十分重要的 地位,被認為是癌癥治療的理想靶點之一,在腫瘤研究中LDH被高度關注(Wilpeetal.,2020;Woodfordetal.,2020)。由于LDH結構和功能不僅非常重要,也具有一定的復雜性,隨著研究的深入,不斷有新的進展(Woodfordetal.,2020)。因此不僅需要對人的LDH進行深入研究,也有必要對其他物種的LDH開展細致的研究(Fengetal.,2018)。本研究首次克隆了黃胸鼠Ldha基因并進行了原核表達,純化表達蛋白后通過Western Blot鑒定其為LDHA蛋白,最后測定了該蛋白的酶活性和Km值。
黃胸鼠雖然是常見家棲鼠,但是其基因組還未被測序,目前關于黃胸鼠的研究也不多(Adhikarietal.,2018;Guoetal.,2019)。本研究首次克隆黃胸鼠Ldha基因編碼序列后,序列分析發現其與褐家鼠和黑家鼠的序列十分相似,核苷酸和氨基酸序列一致性均達到99%以上。說明這3種鼠雖然同科不同屬,但是它們的基因組很相似,所以把它們歸為近緣種。目前不僅未見對黃胸鼠LDH的研究報道,同樣也未見對褐家鼠和黑家鼠的研究報道,僅見來源于褐家鼠的大鼠有少量關于LDH研究(Nowickietal.,2015)。
檢測酶活性和酶特征性常數(Km值)是研究酶學性質的重點(Talaiezadehetal.,2015;Yangetal.,2020)。本研究通過紫外分光光度法分別檢測了催化從丙酮酸生成乳酸和從乳酸生成丙酮酸2個方向的純化蛋白LDHA酶比活性,發現LDHA催化丙酮酸生成乳酸的酶比活性是催化乳酸生成丙酮酸的50余倍;此外,純化蛋白LDHA以丙酮酸為底物的平均Km值為0.170 mmol·L-1±0.193 mmol·L-1,而以乳酸為底物的平均Km值為22.540 mmol·L-1±0.007 mmol·L-1。上述結果均說明純化的LDHA蛋白更容易催化丙酮酸生成乳酸,這與全部由LDHA亞基組成的LDH5同工酶的性質一致,同工酶雖然催化相同的化學反應,但是它們的功能是有差異的,這可以從酶學性質上得以體現。LDH5同工酶全部由Ldha基因編碼的M亞基組成,更容易催化丙酮酸轉變為乳酸,而LDH1同工酶全部由Ldhb基因編碼的H亞基組成,更容易催化乳酸轉變為丙酮酸(Augoffetal.,2015;Khanetal.,2020)。本研究檢測到純化的黃胸鼠LDHA蛋白催化丙酮酸生成乳酸的酶比活性是催化乳酸生成丙酮酸的50余倍,并且LDHA純化蛋白以乳酸為底物的平均Km值是以丙酮酸為底物的130余倍,說明LDHA酶蛋白與乳酸的親和力比與丙酮酸的親和力要小很多。這些結果均印證了LDHA蛋白組成的LDH5同工酶的確更容易催化丙酮酸轉變為乳酸。雖然LDH在細胞的物質代謝中十分重要,但是有關鼠類LDH酶學性質的研究并不多。熊舜斌和許根俊(1995)檢測到原核表達純化的LDHA酶蛋白以丙酮酸為底物的Km值為0.103 mmol·L-1,與本研究中黃胸鼠的接近。但是Nowicki等(2015)原核表達不帶蛋白標簽的大鼠LDHA蛋白并檢測其以丙酮酸為底物的平均酶比活性為310 U·mg-1±1.463 U·mg-1,平均Km值為0.53 mmol·L-1±0.08 mmol·L-1,均高于黃胸鼠所測數值。這些差異可能是由于檢測條件和氨基酸序列不同所導致的。黃胸鼠和大鼠的LDHA氨基酸序列相似,但是序列比對分析發現,黃胸鼠LDHA活性中心區域的第229位氨基酸為非極性的甘氨酸,而大鼠的為酸性的天冬氨酸,這種改變可能導致其酶學性質的差異。特別值得注意的是本研究還采用本實驗室建立的LDH同工酶檢測技術檢測了LDHA純化蛋白的酶活性(Lietal.,2019)。純化蛋白不僅有酶活性,且僅有1條帶,說明純化的LDHA只形成了 1種同工酶。Nowicki等(2015)、Wang等(2016)的研究均認為純化表達的LDHA形成了四聚體的LDH5同工酶,而本研究結果顯示LDHA純化蛋白位于對照組的黃胸鼠骨骼肌組織LDH4和LDH5同工酶之間,這有可能是純化蛋白樣品的pH、鹽度和His標簽等因素影響了蛋白質電泳。
4 結論
本文首次報道黃胸鼠Ldha基因的編碼序列并分析了其結構特點,獲得該基因原核表達純化蛋白后經Western Blot和酶譜分析驗證表達蛋白為LDHA,檢測了其酶比活性、Km和Vmax等酶學性質,可為后續研究不同物種之間LDH氨基酸序列差異與酶學性質之間的關系、LDH的催化機制及抑制劑藥物篩選等奠定基礎。

