氨基酸螯合鈣的結構表征和功能特性研究
胡靜榮,郭艷,來靜,朱迎春
(山西農業大學食品科學與工程學院,山西 太谷 030801)
氨基酸螯合鈣現作為第三代補鈣制劑,不僅解決了第一代補鈣制劑(無機鈣)難溶于水、利用率低、容易造成結石的問題,也避免了第二代補鈣制劑(傳統有機鈣)鈣含量低、毒副作用大的缺點,而且具有穩定性好、易吸收、在補充鈣的同時還可以補充人體必需氨基酸等優點。相關研究[1]表明氨基酸螯合鈣具有較高的生物利用性,因為作為配體的氨基酸具有保護鈣離子的作用,避免了直接吸收鈣離子對胃腸道造成的損傷,保持了鈣離子的生理活性。
氨基酸螯合鈣是氨基酸與可溶性鈣離子反應生成的。當氨基酸與鈣離子發生反應后,鈣離子以白色晶體狀吸附在氨基酸內部及表面,以配位共價鍵的方式結合。對于其結合方式,劉閃等[2]通過紅外光譜掃描和電鏡掃描觀察表明,鈣離子與膠原多肽發生了螯合反應,結合方式有離子結合、配位結合和吸附作用。
在功能特性方面,氨基酸螯合鈣含有一定的游離氨基酸、多肽等,其生物利用度和活性功能會更強。楊賢慶等[3]測定了復合氨基酸螯合鈣的總還原能力和3種自由基清除率,表明復合氨基酸螯合鈣在一定濃度范圍內,濃度越大,抗氧化能力越好;劉文穎等[4]通過體外胃腸道模擬消化試驗表明海洋骨膠原低聚肽鈣配合物具有一定的消化穩定性。
為了更深入地了解氨基酸螯合鈣的結構及功能特性,本試驗利用紫外光譜、紅外光譜、掃描電鏡對氨基酸螯合鈣進行結構分析,通過DPPH自由基清除率、羥基自由基清除率、超氧陰離子自由基清除率及總還原能力等指標測定其抗氧化活性,利用牛津杯試驗法分析其抑菌性,最后通過模擬消化吸收試驗考察對其胃腸道的穩定性,探究氨基酸螯合鈣能否被人體更好地消化吸收。
1 材料與方法
1.1 材料與試劑
氨基酸螯合鈣:山西農業大學畜產品加工實驗室以驢骨泥為原料,通過酶解、發酵、螯合、冷凍干燥等工藝制備而成。其中未進行螯合反應的驢骨泥酶解物作為對照。
指示菌[金黃色葡萄球菌(Staphylococcus aureus)、大腸桿菌(Escherichia coli)、沙門氏菌(Salmonella)]:山西農業大學畜產品加工實驗室保藏。
肉膏蛋白胨培養基:牛肉膏0.5 g、蛋白胨1.0 g、瓊脂 2.0 g、NaCl 0.5 g、水 100 mL、pH7.2、壓力 0.10 MPa條件下滅菌20 min。
氫氧化鈉、磷酸二氫鈉、磷酸氫二鈉、三氯化鐵、鐵氰化鉀、三氯乙酸、鄰苯三酚、硫酸亞鐵、雙氧水、水楊酸、無水乙醇(均為分析純):天津化學試劑一廠;胰蛋白酶(250 U/mg)、胃蛋白酶(3 000 U/mg):廣州齊云生物技術有限公司;三羥甲基氨基甲烷鹽酸鹽(tris hydrochloride,Tris-HCl)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)(均為分析純):北京索萊寶科技有限公司。
1.2 儀器與設備
酸度計(PB-10):瑞典Sartorius公司;電子恒溫水浴鍋(ZKW-4):常熟市天量儀器有限責任公司;電子天平(LT-100型):北京中興偉業公司;離心機(ST40R):德國Theromo Scientific公司;分析天平(CPA):北京賽多利斯儀器系統有限公司;壓力蒸汽滅菌鍋(BL-50立式):上海東亞壓力容器制造有限公司;紫外可見分光光度計(UV-1800)、傅里葉紅外光譜儀(affinity-1):日本島津公司;掃描電鏡(S-3400N):日本Hitachi公司。
1.3 方法
1.3.1 氨基酸螯合鈣的結構表征
1.3.1.1 紅外光譜分析
參照林慧敏[5]的方法進行紅外光譜分析。使用傅里葉紅外光譜儀記錄400 cm-1~4 000 cm-1的光譜,分辨率為4 cm-1,掃描數為32。
1.3.1.2 紫外掃描分析
參照陳孟等[6]的方法進行紫外掃描分析。分別對氨基酸螯合鈣和酶解物溶液進行紫外光譜掃描,掃描范圍210 nm~400 nm。
1.3.1.3 掃描電鏡分析
參照付文雯[7]的方法進行電鏡掃描。將樣品用導電雙面帶固定在金屬樣品平臺上,將其置于離子濺射儀器的樣品室中,在15mA的電流下噴金90s后進行觀察。
1.3.2 氨基酸螯合鈣抗氧化活性測定
用蒸餾水將得到的氨基酸螯合鈣和酶解物分別配制成 2、4、6、8、10 mg/mL 的溶液,測定 DPPH 自由基清除率、超氧陰離子自由基清除率、羥基自由基清除率及總還原能力。
1.3.2.1 DPPH自由基清除率的測定
參照GARCíA-MORENO等[8]的方法并稍作改進。用無水乙醇配制1×10-4mol/L DPPH溶液,避光冷藏,將待測樣品稀釋10倍~100倍;將2 mL測試樣品溶液與2 mL DPPH溶液加入到同一試管中,搖勻,避光反應30 min后,測定波長517 nm處吸光度Ai;同時測定2 mL DPPH溶液與2 mL無水乙醇混合后的吸光度A0,以及2 mL測試樣品溶液與2 mL無水乙醇混合后的吸光度Aj。DPPH自由基清除率計算公式如下。

1.3.2.2 羥基自由基清除率的測定
采用鄰二氮菲-Fe2+氧化法[9-10]。依次準確移取等體積(1 mL)的 2 mmol/L FeSO4溶液、6 mmol/L 水楊酸溶液、6 mmol/L H2O2溶液,混合搖勻后快速在510 nm處測定吸光度A0值。在反應體系中加入1 mL樣品溶液,搖勻后立即測定吸光度Ai值。計算公式如下。

1.3.2.3 超氧陰離子自由基清除率
采用鄰苯三酚自氧化法[11-12],稍作改進。依次準確移取 5.0 mL 0.05 mol/L Tris-HCl(pH8.2),置于 25℃水浴20min后,分別加入0.5 mL蒸餾水和0.5 mL 2.5 mmol/L鄰苯三酚溶液,混合均勻后在25℃水浴反應5 min。立即用1 mL 8 mmol/L HCl溶液終止反應,在299 nm處測吸光度A0,在反應體系中加入不同濃度待測樣品溶液0.5 mL,搖勻后立即測定吸光度Ai值。計算公式如下。
1.3.2.4 總還原能力的測定
參照陳英等[13]的方法并稍作改進。取2 mL待測樣品溶液,依次加入2 mL 0.2 mol/L磷酸鹽緩沖液(pH6.6)、2 mL 1.0%K3[Fe(CN)6],空白用蒸餾水代替樣液,置于具塞試管中,迅速混勻,置于50℃水浴中反應20 min,冰水冷卻,再加2 mL 10%三氯乙酸,混勻后,取2 mL上清液,加2 mL蒸餾水和0.4 mL 0.1%FeCl3,混勻,測定各樣品在700 nm下的吸光度Ai值。
1.3.3 抑菌性測定
抑菌性能利用牛津杯法進行。牛津杯試驗法按照參考文獻[14-15]的方法并稍作改進。
1)樣品的制備:取氨基酸螯合鈣用蒸餾水溶解,配制成濃度為 5、10、30、50 mg/mL 的溶液。
2)供試菌懸液制備:將大腸桿菌、金黃色葡萄球菌、沙門氏菌接種到肉膏蛋白胨培養基中活化兩次,使菌懸液濃度達到 6 lg(CFU/mL)~7 lg(CFU/mL)備用。
3)平皿的制備:將配制好的肉膏蛋白胨培養基冷卻至50℃~60℃,傾注于經干熱滅菌的培養皿內,待培養基凝固后備用。
4)涂平皿:用滅菌移液槍頭分別吸取0.20 mL供試菌懸液于平皿內,用無菌涂布器將菌液涂布均勻,放置片刻。
5)用無菌鑷子夾取已滅菌的牛津杯在酒精燈上迅速灼燒后放到含菌平板上,輕輕按壓使每個牛津杯杯底與培養基連接緊湊,每個平板等距放入3個牛津杯,其中兩個牛津杯用移液槍加入0.20 mL的氨基酸螯合鈣溶液,另一個牛津杯加入0.20 mL無菌生理鹽水作對照,每種抑菌液做3個重復。然后將平皿正置放入4℃冰箱10 h使其擴散,再于37℃恒溫箱培養,培養24 h后觀察并測量抑菌圈大小。

1.3.4 氨基酸螯合物體外模擬消化吸收試驗
體外胃腸模擬消化方法參照汪婧瑜[16]的方法并稍作修改。
1.3.4.1 胃模擬消化試驗
稱取制備好的螯合物,用蒸餾水溶解,配制濃度為1.0 mg/mL溶液。再用1 mol/L的鹽酸調pH值至2.0,37℃預熱5 min后加入4%(酶/底物)胃蛋白酶,37℃水浴模擬胃消化過程,振蕩2.0 h后取出反應液,沸水浴滅酶5 min,冷卻至室溫25℃后,5 000 r/min離心10 min,取上清液利用EDTA絡合滴定法分別測定上清液中鈣離子含量和溶液中總鈣含量。
1.3.4.2 腸模擬消化試驗
將胃消化2.0 h的消化液,用1.0 mol/L NaOH調至pH7.4,按4%(酶/底物)的比例加入胰蛋白酶。37℃水浴模擬腸消化過程,2.0 h后沸水浴滅酶5 min,冷卻至25℃后,8 000r/min離心10min,取上清液按照EDTA絡合滴定法分別測定上清液中鈣離子含量和溶液中總鈣含量。
1.4 數據處理
采用Microsoft Excel 2007軟件對試驗數據進行統計分析,并應用Origin Pro 8.0繪圖軟件制圖。
2 結果與分析
2.1 氨基酸螯合鈣的結構表征試驗結果分析
2.1.1 氨基酸螯合鈣與酶解物的紅外光譜分析
圖1為氨基酸螯合鈣與酶解物的紅外光譜對比圖。

圖1 氨基酸螯合鈣與酶解物的紅外光譜分析Fig.1 Infrared spectrum analysis of amino acid chelate calcium and enzymatic lysates
紅外光譜整個范圍可分為兩個區域,波數為1 300 cm-1~4 000 cm-1的區域稱為官能團區,在這個區域內可以區別不同官能團的特征吸收峰。波數為600 cm-1~1 300 cm-1的區域稱為指紋區,此區的吸收峰多而密,且比較復雜,能反映整個分子的特征,因此可作為判斷分子結構的佐證[17]。從圖1可以看出,氨基酸螯合鈣的紅外光譜較酶解物的紅外光譜發生了明顯變化。由酶解物的紅外光譜可知,在特征區,-NH2的吸收峰在3 276.55 cm-1,C=O吸收峰在1 652.44 cm-1,-COO-的吸收峰在1 462.32 cm-1;對比酶解物的紅外光譜圖,可以發現氨基酸與鈣進行螯合后,整個波形發生了移動。在特征區,氨基的伸縮振動吸收峰(N—H)紅移到了3 263.55 cm-1,說明氨基酸中的N—H鍵發生了化學變化;1 652.44 cm-1附近是酰胺Ⅰ帶的C=O伸縮振動,螯合后藍移到1 653.29 cm-1,-COO-發生了伸縮,移動到1 404.65 cm-1,說明氨基酸的羧基和氨基均參與了螯合反應。同時官能團的特征吸收峰強度的改變與位置的移動證明了螯合反應后有新物質的生成。指紋區922.16 cm-1的吸收峰是O-H面內變形振動和磷酸基團的變化引起的,說明含有游離的-COOH。氨基酸螯合鈣圖譜中此吸收峰消失,表明不存在游離的-COOH,推測其與鈣離子以共價鍵的方式結合,由此進一步證實反應產物確實為氨基酸螯合鈣。
2.1.2 氨基酸螯合鈣與酶解物的紫外光譜分析
圖2為氨基酸螯合鈣與酶解物的紫外光譜分析。

圖2 氨基酸螯合鈣與酶解物的紫外光譜分析Fig.2 Ultraviolet spectrum analysis of amino acid chelate calcium and enzymatic lysates
物質結構的改變導致紫外掃描光譜圖中官能團的特征吸收峰的波長與吸收強度發生變化,所以采用紫外光譜分析能初步判斷是否有新物質的生成[18-19]。由圖2所示,氨基酸螯合鈣與酶解物的紫外吸收光譜發生了明顯的改變。氨基酸螯合鈣較酶解物而言,其最大吸收峰從205.0 nm移到了213.5 nm,吸收峰尖而窄,且吸光度值顯著增強,由2.88增強到4.69。研究表明氨基酸和鈣發生螯合時,螯合物的生成會使其配位體對光吸收性能發生改變,相應原子的價電子發生躍遷,所需要的躍遷能量高于原反應物,因此,伴隨著新物質即氨基酸螯合鈣的生成,物質結構發生改變,官能團的特征吸收峰的波長增加,吸收強度增強。
2.1.3 氨基酸螯合鈣的電鏡掃描分析
圖3為氨基酸螯合鈣電鏡掃描圖。

圖3 氨基酸螯合鈣電鏡掃描圖Fig.3 Scanning electron microscopy of amino acid chelate calcium
研究顯示氨基酸與鈣之間通過離子結合、配位結合及一定的吸附作用發生螯合,鈣離子以白色晶體狀吸附在氨基酸內部及表面[2]。由圖3可以看到,鈣離子以白色顆粒的形式鑲嵌在氨基酸中,還有一部分吸附在氨基酸表面,因此通過掃描電鏡從物質微觀結構層面,再次證明了氨基酸螯合鈣的形成。付文雯[7]對牛骨膠原多肽螯合鈣的電鏡掃描圖也顯示由于多肽與鈣之間的吸附作用,多肽表面“鑲嵌”著白色晶體。
2.2 氨基酸螯合鈣抗氧化試驗結果
2.2.1 氨基酸螯合鈣DPPH自由基清除率
圖4為氨基酸螯合鈣與酶解物對DPPH自由基的清除率。

圖4 氨基酸螯合鈣與酶解物對DPPH自由基的清除率Fig.4 DPPH radical clearance rate of amino acid chelate calcium and enzymatic lysates
由圖4可知,氨基酸螯合鈣對DPPH自由基具有一定的清除作用,且相同濃度下,氨基酸螯合鈣對DPPH自由基清除能力高于酶解物。特別是在較低濃度表現明顯:當濃度為2 mg/mL時,氨基酸螯合鈣對DPPH自由基清除率是酶解物的2.2倍。氨基酸螯合鈣和酶解物DPPH自由基清除率的IC50值分別為0.13、6.21 mg/mL。可見氨基酸螯合鈣抗氧化能力高于酶解物。表明鈣離子螯合活性與其抗氧化特性存在關聯,這與楊賢慶等[3]的研究結果一致。
2.2.2 氨基酸螯合鈣羥基自由基清除率
圖5為氨基酸螯合鈣與酶解物對羥基自由基的清除率。
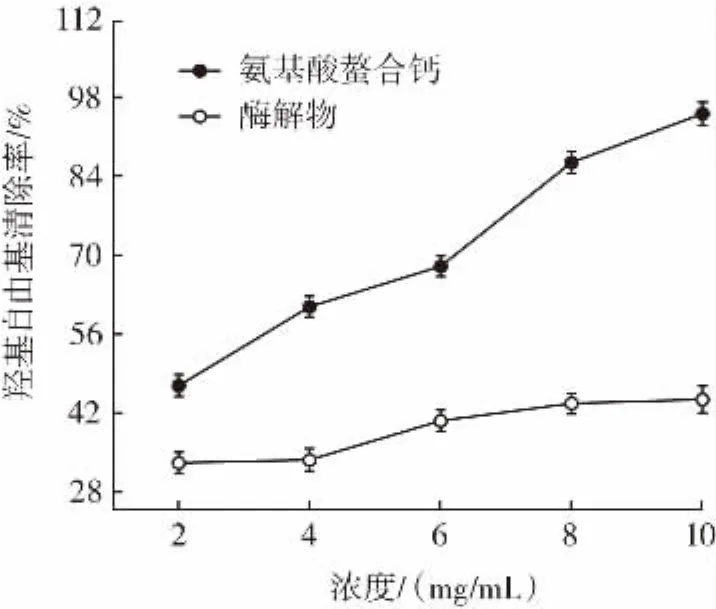
圖5 氨基酸螯合鈣與酶解物對羥基自由基的清除率Fig.5 The scavenging rate of hydroxyl radical by amino acid chelate calcium and enzymatic lysates
由圖5可知,氨基酸螯合鈣對羥基自由基具有一定的清除作用,且清除能力與濃度呈明顯的量效關系。氨基酸螯合鈣與酶解物的IC50值分別為2.40、15.22 mg/mL,可見,氨基酸螯合鈣對羥基自由基的清除效果優于酶解物,并且當濃度為10 mg/mL時,其清除率分別為95.05%、44.40%,這表明經過螯合之后,產物對羥基自由基的清除率比之前提高了114%倍。
2.2.3 氨基酸螯合鈣超氧陰離子自由基清除率
圖6為氨基酸螯合鈣與酶解物對超氧陰離子自由基的清除率。

圖6 氨基酸螯合鈣與酶解物對超氧陰離子自由基的清除率Fig.6 The scavenging rate of superoxide anion radical by amino acid chelate calcium and enzymatic lysates
由圖6可知,隨著濃度的增大,氨基酸螯合鈣對超氧陰離子自由基的抑制效果也不斷增強。相同濃度下,氨基酸螯合鈣對超氧陰離子自由基的清除率均高于酶解物。酶解物IC50值為13.95 mg/mL,氨基酸螯合鈣IC50值為2.77 mg/mL,但較其對羥基自由基的清除效果(IC50為2.40 mg/mL)則略差一些,可能是因為具有超氧陰離子自由基清除活性的氨基酸殘基還沒有暴露出來。而氨基酸螯合鈣對DPPH自由基的清除效果最好,其IC50值為0.13 mg/mL。
2.2.4 氨基酸螯合鈣總還原能力
圖7為氨基酸螯合鈣與酶解物的總還原能力。

圖7 氨基酸螯合鈣與酶解物總還原能力Fig.7 The total reducing capacity of amino acid chelate calcium and enzymatic lysates
從圖7中可以看出,氨基酸螯合鈣和酶解物的總還原能力與其濃度呈正相關,均隨著濃度的增加呈上升趨勢,且氨基酸螯合鈣的總還原能力較酶解物高,當濃度為10 mg/mL時,氨基酸螯合鈣的總還原能力是酶解物的1.31倍。
2.3 氨基酸螯合鈣抑菌性
通過測定氨基酸螯合鈣對3種供試菌的抑菌活性來研究其對細菌的抑菌效果。圖8為抑制效果圖,表1為氨基酸螯合鈣對3種供試菌的抑菌圈直徑測定結果。

圖8 3種供試菌的抑菌活性Fig.8 The antibacterial activity of three tested strains

表1 3種供試菌的抑菌活性Table 1 The antibacterial activity of three tested strains
由表1可知,氨基酸螯合鈣對3種供試菌均有抑制作用。當氨基酸螯合鈣濃度為50 mg/mL時,抑菌圈(9.48 mm~13.53 mm)均很明顯;濃度為30 mg/mL時,抑菌圈直徑在8.02mm~11.16mm;當濃度為10mg/mL時,金黃色葡萄球菌、大腸桿菌的抑菌圈直徑在7.11 mm~8.09 mm,當濃度為5 mg/mL時,抑菌圈直徑均小于7 mm,認為其抑菌效果不明顯。3種供試菌比較,氨基酸螯合鈣對金黃色葡萄球菌的抑制效果強于對大腸桿菌、沙門氏菌的抑制效果。夏松養等[20]發現,螯合作用增加了反應產物的電子受體和電子供體數量,改善了螯合物環狀結構的電子分布,顯著增強了電子緩沖能力,進而使抑菌作用得以加強。
2.4 模擬胃腸道消化試驗結果
鈣離子主要在人體腸道內(十二指腸和空腸上端黏膜)被吸收利用[21],游離態的鈣離子易與OH-形成沉淀,降低生物利用率,而以螯合形式存在的鈣離子具有較好的吸收性[22]。圖9為氨基酸螯合鈣在消化過程中鈣離子溶解率的變化。
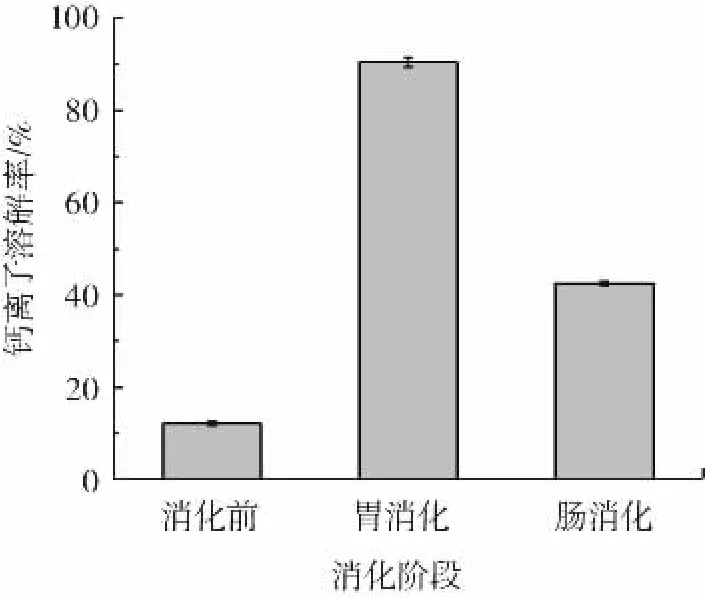
圖9 氨基酸螯合鈣在消化過程中鈣離子溶解率的變化Fig.9 The change of the dissolution rate of calcium ions in the process of digestion
由圖9可知,消化前,游離鈣離子含量為12.67%,經過胃蛋白酶2 h消化后,氨基酸螯合鈣的鈣溶解率達到90.38%。只有極小部分存在于氨基酸螯合鈣中未溶出,表明在模擬胃環境中鈣釋放性能良好且具有一定的耐受性。而經腸消化后,鈣離子溶解率為42.50%。劉文穎等[4]也有相似的報道。鈣離子溶解率下降的可能原因:1)腸道的堿性環境使鈣離子與OH-結合生成氫氧化鈣,沉淀于腸道壁,降低了溶解率;2)H+濃度下降和pH值的升高增強了鈣離子與腸道中氨基酸中羧基和氨基的螯合能力,使得游離態的鈣離子再次被螯合形成配位鍵較為穩定的氨基酸螯合物[23]。
3 結論
本試驗對氨基酸螯合鈣的結構與功能特性進行研究,結論如下:1)對螯合產物進行紫外光譜、紅外光譜及掃描電鏡分析,確證了氨基酸螯合鈣的形成。2)氨基酸螯合鈣對DPPH自由基、羥基自由基和超氧陰離子自由基均具有較好的清除率,且對DPPH自由基的清除能力最強。總還原能力隨濃度的增加而增大,與未發生螯合反應的酶解物比較,氨基酸與鈣螯合后抗氧化性顯著增強。3)氨基酸螯合鈣對金黃色葡萄球菌、大腸桿菌和沙門氏菌均具有抑菌作用,對金黃色葡萄球菌的抑菌效果最佳。4)體外模擬胃腸道消化結果發現經胃消化后鈣溶解率達到90.38%,后經腸道消化后,鈣溶解率維持在42.50%。

