常壓蒸汽處理對(duì)全麥粉脂肪相關(guān)酶活性及微生物的影響
杜昱蒙,任國(guó)寶,任晨剛,4,陳 潛,甘婉強(qiáng),陳 艷?
(1. 中糧營(yíng)養(yǎng)健康研究院,北京 102209;2. 新希望六和股份有限公司,北京 100020;3. 中糧海嘉(廈門(mén))面業(yè)有限公司,福建 廈門(mén) 361000;4. 營(yíng)養(yǎng)健康與食品安全北京市重點(diǎn)實(shí)驗(yàn)室(北京市科委),北京 102209)
全麥粉含有豐富的維生素、膳食纖維及多種微量元素,越來(lái)越受到崇尚健康、綠色、自然的消費(fèi)者的青睞。小麥中的大部分活性脂肪酶(75%~80%)分布在籽粒麩皮中,(20%~25%)分布于胚芽中[1]。小麥籽粒經(jīng)過(guò)研磨制備全麥粉時(shí),區(qū)隔麥麩、胚芽、胚乳的區(qū)室被破壞,原本儲(chǔ)藏在胚芽、麩皮細(xì)胞中的脂肪和酶被釋放。諸多研究表明,影響全谷物粉品質(zhì)及貨架期穩(wěn)定性的最關(guān)鍵因素為脂肪的分解及氧化[2]。低溫貯藏可以有效減緩脂肪的分解速度,在-20 ℃條件下貯藏20周的全麥粉幾乎未發(fā)生脂肪分解,但冷鏈運(yùn)輸及貯藏的成本過(guò)高,難以大范圍應(yīng)用[3]。也有學(xué)者通過(guò)氣調(diào)包裝和在包裝中加入抗氧化劑等措施延緩脂肪分解,但收效甚微,原因是脂肪水解酸敗是酶促反應(yīng),并不受環(huán)境中的氧氣含量的影響[4],而游離脂肪酸的氧化速度過(guò)快,導(dǎo)致抗氧化劑無(wú)法及時(shí)起效。因此,提高全谷物粉穩(wěn)定性的最佳方法是抑制脂肪酶及脂肪氧化酶的活性。
對(duì)此,國(guó)內(nèi)外有大量的相關(guān)研究報(bào)道。目前,應(yīng)用比較廣泛的滅酶工藝包括:熱處理(干熱或濕熱),微波處理,擠壓處理等[5]。其中,使用蒸汽處理鈍化脂肪酶及脂肪氧化酶的研究較為廣泛,蒸汽處理可大致分為過(guò)熱蒸汽和常壓蒸汽處理。過(guò)熱蒸汽處理小麥籽粒,顯著減少了全麥粉中脂肪酶、脂氧合酶以及多酚氧化酶的活性[6]。但是,使用過(guò)熱蒸汽處理麩皮會(huì)在一定程度上改變麩皮的微觀結(jié)構(gòu)和面團(tuán)的流變特性,從而對(duì)全麥粉的應(yīng)用品質(zhì)產(chǎn)生一定程度的影響[7-8]。另一方面,過(guò)熱蒸汽處理對(duì)于設(shè)備及操作人員的專業(yè)性要求較高,對(duì)于生產(chǎn)企業(yè)負(fù)擔(dān)較大。對(duì)麩皮進(jìn)行常壓蒸汽處理是抑制全麥粉微生物含量及酶活性最為經(jīng)濟(jì)、有效的手段之一。同時(shí),常壓蒸汽處理[9]對(duì)于維持麩皮形態(tài)、色澤等方面也存在一定的積極意義,可以作為穩(wěn)態(tài)化全麥粉生產(chǎn)的常規(guī)處理方法之一。
全麥粉中的微生物也是影響全麥粉貨架期的重要因素。目前,小麥粉國(guó)標(biāo)中尚未有微生物的相關(guān)標(biāo)準(zhǔn),但許多食品企業(yè)已經(jīng)開(kāi)始逐步建立衛(wèi)生相關(guān)的內(nèi)控標(biāo)準(zhǔn)。小麥中的微生物主要集中在小麥籽粒的表面,seiler 等報(bào)道[10],小麥的菌落總數(shù)(6.4 log CFU/g)遠(yuǎn)遠(yuǎn)高于面粉的菌落總數(shù)(1.9 log CFU/g),小麥的霉菌(4.3 log CFU/g)為面粉霉菌(3.7 log CFU/g)的2倍。楊少武的研究表明,各系統(tǒng)粉嗜溫芽孢菌含量也存在較大差異,接近表皮部分嗜溫芽孢菌含量較中心胚乳部分含量高[11]。未經(jīng)任何處理的全麥粉微生物含量遠(yuǎn)遠(yuǎn)高于普通面粉,也會(huì)對(duì)后續(xù)產(chǎn)品的生產(chǎn)造成較大的威脅。
因此,本研究評(píng)估了不同常壓蒸汽處理強(qiáng)度對(duì)麩皮微生物及酶活的影響,并綜合評(píng)價(jià)蒸汽處理麩皮制備的穩(wěn)態(tài)化全麥粉保質(zhì)期,為工業(yè)化生產(chǎn)穩(wěn)態(tài)化全麥粉提供參考。
1 材料與方法
1.1 實(shí)驗(yàn)材料
國(guó)產(chǎn)全麥粉Ⅰ、Ⅱ、Ⅲ(金山全麥粉:益海嘉里(昆山)食品工業(yè)有限公司;孖叁牌全麥粉:肇慶市福加德面粉有限公司;一風(fēng)吹全麥粉:河南金苑糧油有限公司);進(jìn)口紅磨坊全麥粉:美國(guó)鮑勃紅磨坊;硬紅春麥,2019年9月收獲,2020年1月到港后取樣在恒溫樣品庫(kù)中儲(chǔ)藏(23 ℃,RH60%):加拿大西部;氫氧化鈉、無(wú)水乙醇、乙醇(95%)、鄰苯二甲酸氫鉀、酚酞(99%)、濃硫酸、丙酮、石油醚(沸程 30~60 ℃)(均為分析純):國(guó)藥集團(tuán)化學(xué)試劑有限公司。
1.2 儀器與設(shè)備
小型實(shí)驗(yàn)?zāi)シ蹤C(jī)(Quadrumat Junior):德國(guó)布拉班德儀器設(shè)備有限公司;全自動(dòng)旋風(fēng)磨(M3100):波通瑞華科學(xué)儀器(北京)有限公司;Titrette?數(shù)字瓶口滴定器:德國(guó)普蘭德公司;分光光度計(jì)(UV-4802):尤尼柯(上海)儀器有限公司;激光粒度儀(Mastersizer 3000):英國(guó)馬爾文公司;醫(yī)用臺(tái)式離心機(jī)(TDZ5-WS):長(zhǎng)沙平凡儀器儀表有限公司;多功能蒸汽鍋(10L,WSYH26A):美的集團(tuán)股份有限公司。
1.3 實(shí)驗(yàn)方法
1.3.1 全籽粒全麥粉制備
使用小型實(shí)驗(yàn)?zāi)シ蹤C(jī)將小麥籽粒研磨成粉,并分離胚乳及麩皮,得到出率70%面粉及30%麩皮(含粉)。再使用全自動(dòng)旋風(fēng)磨粉機(jī)對(duì)麩皮進(jìn)行研磨(篩片孔徑 0.8 mm),使所有麩皮粉可通過(guò)80目篩,再將麩皮粉和出率為70%的自制面粉混合,得到全籽粒全麥粉。
1.3.2 穩(wěn)態(tài)化麩皮粉及全麥粉制備
穩(wěn)態(tài)化麩皮粉:使用小型實(shí)驗(yàn)?zāi)シ蹤C(jī)將小麥籽粒研磨成粉,并分離胚乳及麩皮,得到出率70%面粉及30%麩皮。將蒸汽鍋中水加熱煮沸,取150 g麩皮鋪于篩網(wǎng)上(篩面30 cm×30 cm),將篩網(wǎng)放在蒸汽鍋上方分別加熱指定時(shí)間,加熱后麩皮放入烘箱中,80 ℃烘干,將麩皮水分烘干至11%~12%,再使用全自動(dòng)旋風(fēng)磨粉機(jī)對(duì)麩皮進(jìn)行研磨(篩片孔徑 0.8 mm),使所有麩皮粉可通過(guò)80目篩。
穩(wěn)態(tài)化全麥粉:將穩(wěn)態(tài)化處理后的麩皮粉按30%的比例與出粉率 70%的面粉混合后,制成穩(wěn)態(tài)化全麥粉。
1.3.3 粒徑測(cè)量
使用馬爾文Mastersizer 3000激光粒度儀,采用干法粒徑測(cè)試系統(tǒng)。參數(shù):氣壓:1.5 bar;進(jìn)樣速度:40%;折射率:1.59;顆粒密度:1.05 g/m3;測(cè)量次數(shù):1;背景測(cè)量持續(xù)時(shí)間:10 s;樣品測(cè)量持續(xù)時(shí)間:20 s;背景穩(wěn)定時(shí)間:120 s。
1.3.4 脂肪酸值測(cè)定
脂肪酸值參考GB/T 15684—2015《谷物碾磨制品 脂肪酸值的測(cè)定》測(cè)定。
1.3.5 脂肪酶活性測(cè)定
脂肪酶活性測(cè)定參考 Domenico R等報(bào)道[12]的方法;使用磷酸鹽緩沖液配制(pH7.5,0.2 mol/L)配制10.75 mMp-硝基苯丁酸酯溶液,稱量麩皮樣品0.02 g和9 mL磷酸鹽緩沖液于試管中,加入1 mLp-硝基苯丁酸酯溶液,混勻后,25 ℃水浴20 min,1 000 r/min 離心 5 min,在加入p-硝基苯丁酸酯溶液后的30 min取上清測(cè)試其在400 nm處的吸光值。使用對(duì)硝基苯酚做標(biāo)準(zhǔn)曲線,計(jì)算p-硝基苯丁酸酯的氧化情況,從而評(píng)估脂肪酶活性。
1.3.6 脂肪氧化酶活測(cè)定
脂肪氧化酶活測(cè)定參考Cato L等報(bào)道[13]的方法。酶提取液:將 2 g樣品和 10 mL緩沖液(0.1 mol/L,pH 7.5 磷酸緩沖液)混合,冰水浴提取 30 min,4 ℃,3 000 r/min 離心 20 min,取上清液。
底物配制:0.125 mL吐溫20分散于2.5 mL,pH 9.0的0.05 mol/L硼酸鹽緩沖液中,搖動(dòng)下逐滴加入0.150 mL的亞油酸,充分混勻使亞油酸的微細(xì)狀體分散于液體中,加入1 mol/L氫氧化鈉0.325 mL搖動(dòng)使體系成為清澈透明的溶液,然后加入硼酸鹽緩沖液22.5 mL,用1 mol/L鹽酸調(diào)pH至7.0,用清水定容至50 mL。
分別加 0.5 mol/L,pH5.5乙酸鹽緩沖液3.86 mL,提取酶液 20 μL,底物 120 μL 于試管中,混合均勻,于234 nm處,記錄吸光值,3 min后再次記錄吸光值。
酶活的定義:在20 ℃,234 nm處,以亞油酸為底物時(shí),反應(yīng)體系每分鐘增加吸光度 0.001為一個(gè)活力單位。
1.3.7 全麥粉的保質(zhì)期測(cè)試
采用鋁箔袋包裝(每包 30 g),對(duì)全麥粉進(jìn)行長(zhǎng)期穩(wěn)定性試驗(yàn)和加速破壞性試驗(yàn)[14],以脂肪酸值為評(píng)價(jià)指標(biāo)。長(zhǎng)期穩(wěn)定性試驗(yàn)的樣品在常溫(25±1)℃、濕度50%的條件下進(jìn)行,取樣間隔30 d。加速破壞性試驗(yàn)溫度為 35、45 ℃,濕度 50%。其中,35 ℃貯藏樣品取樣時(shí)間間隔為 15 d、45 ℃為 8 d。根據(jù)標(biāo)準(zhǔn) LS/T 3244—2015《全麥粉》規(guī)定,以全麥粉的脂肪酸值(以干基 KOH計(jì))達(dá)到116 mg/100g時(shí)的日期作為保質(zhì)期參考限。
1.3.8 微生物檢測(cè)方法
菌落總數(shù):參考GB 4789.2—2016《食品安全國(guó)家標(biāo)準(zhǔn) 食品微生物學(xué)檢驗(yàn) 菌落總數(shù)》測(cè)定;
霉菌:參考GB 4789.15—2016《食品安全國(guó)家標(biāo)準(zhǔn) 食品微生物學(xué)檢驗(yàn) 霉菌和酵母計(jì)數(shù)》測(cè)定;
大腸菌群:參考GB 4789.3—2016 《食品安全國(guó)家標(biāo)準(zhǔn) 食品微生物學(xué)檢驗(yàn) 大腸菌群計(jì)數(shù)》測(cè)定;
總芽孢桿菌:與菌落總數(shù)測(cè)定方法相同,需增加在制備完成1∶10的樣品勻液后,將其放置于試管中,在80 ℃水浴條件下加熱10 min,并使用冷卻后的樣品勻液進(jìn)行后續(xù)的測(cè)試,計(jì)數(shù)與結(jié)果統(tǒng)計(jì)方法均與GB 4789.2—2016相同。
1.4 數(shù)據(jù)分析
使用 SPSS 16.0進(jìn)行數(shù)據(jù)統(tǒng)計(jì)分析。部分結(jié)果以平均值±標(biāo)準(zhǔn)差表示,指標(biāo)內(nèi)部的均值比較采用單因素方差分析,多重比較采用鄧肯法,采用95%置信度(P<0.05)。
2 結(jié)果與分析
2.1 市售全麥粉貨架期關(guān)鍵指標(biāo)對(duì)比
選取四款市售全麥粉與自制全麥粉的關(guān)鍵指標(biāo)進(jìn)行對(duì)比。其中,有三款國(guó)產(chǎn)全麥粉、一款進(jìn)口全麥粉,國(guó)產(chǎn)全麥粉的膳食纖維均在10%~11%的范圍內(nèi),樣品間膳食纖維含量差別不顯著,進(jìn)口全麥粉膳食纖維含量為 15.6%,明顯高于國(guó)內(nèi)全麥粉的平均水平。
根據(jù)標(biāo)準(zhǔn)LS/T 3244—2015《全麥粉》規(guī)定,理化指標(biāo)應(yīng)符合總膳食纖維≥9.0%,表1中的市售及自制全籽粒全麥粉均符合全麥粉關(guān)鍵指標(biāo)的要求。市售四款全麥粉的粒徑差異較明顯,其中國(guó)產(chǎn)全麥粉Ⅱ粒徑最大,其次為國(guó)產(chǎn)全麥粉Ⅰ和國(guó)產(chǎn)全麥粉Ⅲ,其中進(jìn)口全麥粉和自制全籽粒全麥粉的粒徑最小。

表1 市售及自制全麥粉膳食纖維及粒徑分析Table 1 Dietary fiber content and particle size distribution of the whole wheat flour samples
限制全麥粉貨架期的主要問(wèn)題是酸敗和哈敗,其中起到關(guān)鍵性作用的兩種物質(zhì)為脂肪酶和脂肪氧化酶,表1~2結(jié)果顯示,市售及自制全麥粉經(jīng)過(guò)3個(gè)月相同條件儲(chǔ)藏后,其脂肪酸值均處于較高水平,根據(jù)標(biāo)準(zhǔn)LS/T 3244—2015《全麥粉》規(guī)定,全麥粉脂肪酸值(以干基 KOH計(jì))≤116 mg/100g。在貯藏3個(gè)月后,全麥粉的脂肪酸值均高于標(biāo)準(zhǔn)要求或處于臨界值附近。這與前期的研究結(jié)果一致[15]。

表2 市售及自制全麥粉脂肪酶系及脂肪酸值Table 2 Fatty acid value and enzyme activity of the whole wheat flour samples
另一方面,全麥粉的微生物含量較高,且含有大量不易被殺死的芽孢,這也間接導(dǎo)致全麥制品中菌落總數(shù)超標(biāo)的問(wèn)題。因此,在全麥粉生產(chǎn)過(guò)程中,微生物含量也是影響全麥粉應(yīng)用品質(zhì)的重要環(huán)節(jié)。
如表3所示,國(guó)產(chǎn)全麥粉Ⅰ和國(guó)產(chǎn)全麥粉Ⅱ的菌落總數(shù)較高,分別為8.0×103CFU/g和1.0×104CFU/g,國(guó)產(chǎn)全麥粉Ⅲ和自制全籽粒全麥粉的菌落總數(shù)較低,分別為 9.5×103CFU/g和 4.0×103CFU/g。進(jìn)口全麥粉的菌落總數(shù)含量較低,為8×102CFU/g。其中,進(jìn)口全麥粉的霉菌含量最低,為10 CFU/g,國(guó)產(chǎn)全麥粉Ⅱ的霉菌總數(shù)90 CFU/g,其他全麥粉的霉菌含量為2.6~7.3×102CFU/g,進(jìn)口小麥粉總芽孢數(shù)較低,為15 CFU/g,除國(guó)產(chǎn)全麥粉Ⅰ號(hào)外,其他國(guó)產(chǎn)全麥粉和自制全麥粉芽孢含量較高,為1.8~3.5×102CFU/g,其結(jié)果基本與文獻(xiàn)報(bào)道的結(jié)果一致。研究表明,小麥籽粒中芽孢含量超過(guò)4.3 log CFU/g,即會(huì)對(duì)面包產(chǎn)生不利影響[16]。Berghofer[17]等調(diào)查顯示,澳大利亞小麥粉中細(xì)菌總數(shù) 103CFU/g、芽孢為 102CFU/g、大腸菌群為 10 CFU/g、霉菌和酵母菌的含量為102CFU/g。國(guó)內(nèi)部分小麥粉種微生物含量較澳洲小麥粉高,其中菌落總數(shù)在 3.4×103~ 1.8×105CFU/g之間;霉菌含量在 40 ~1.1×103CFU/g 的范圍內(nèi),其原因推測(cè)與國(guó)產(chǎn)小麥種植未實(shí)現(xiàn)集中種植、收儲(chǔ)和管理,存在微生物控制不嚴(yán)格,品質(zhì)差異大等問(wèn)題[18]。
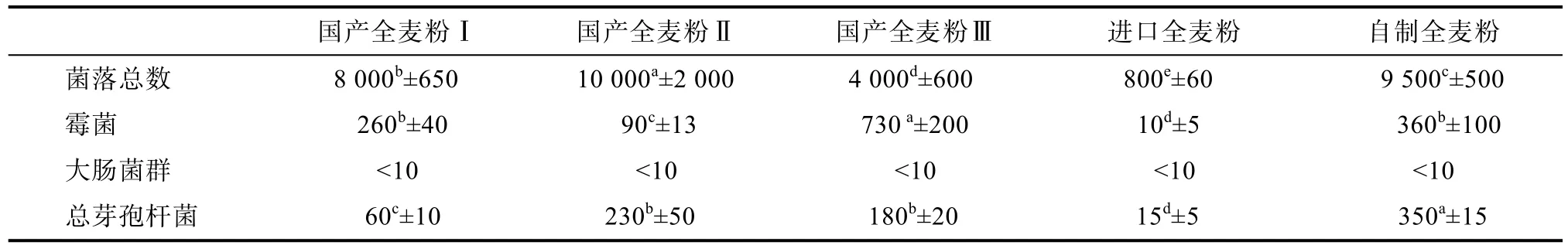
表3 市售全麥粉微生物情況Table 3 Microbiological condition of the whole wheat flour samples CFU/g
2.2 常壓蒸汽處理對(duì)麩皮微生物及脂肪酶活的影響
如表4所示,將麩皮部分分別進(jìn)行5~60 min不同時(shí)長(zhǎng)的蒸汽處理。結(jié)果表明,麩皮中菌落總數(shù)數(shù)值最大,芽孢其次,霉菌和酵母含量較少,且不耐熱,極易被殺死。經(jīng)過(guò)10 min的常壓蒸汽處理后,麩皮中的菌落總數(shù)從2.2×105CFU/g下降至 1.4×102CFU/g,芽孢從 1.2×103CFU/g 下降至 1.1×102CFU/g;常壓蒸汽處理 20 min 后,菌落總數(shù)和芽孢均降至100 CFU/g以下,達(dá)到較低水平。

表4 不同汽蒸時(shí)間處理麩皮的微生物情況Table 4 Microbiological condition of the bran with steam treatment in different time CFU/g
由于小麥、燕麥等籽粒的脂肪酶主要集中在麩皮部分,因此,可以采用先分離出麩皮部分進(jìn)行單獨(dú)的滅酶處理,再將麩皮回添至面粉中的方法制備全谷物粉,Rose(2008)報(bào)道,使用微波(1 000 W)和蒸汽(60 s)處理麩皮,其脂肪酶活性分別減少了93%和96%[19]。脂肪酶和脂肪氧化酶對(duì)于熱處理較為敏感,實(shí)驗(yàn)結(jié)果如圖1所示,常壓蒸汽處理5 min以上,脂肪酶失活率可達(dá)90%以上,脂肪氧化酶在常壓蒸汽處理10 min后失活率可達(dá)80%以上。

圖1 不同汽蒸時(shí)間處理麩皮脂肪相關(guān)酶鈍化情況Fig.1 Passivation rate of the lipase and lipoxygenase in bran with steam treatment in different times
2.3 穩(wěn)態(tài)化全麥粉貨架期測(cè)試
基于上述麩皮處理結(jié)果,選取蒸汽處理10 min的麩皮粉與自制的出率70%的面粉混合,制成穩(wěn)態(tài)化全麥粉,并對(duì)其進(jìn)行貨架期評(píng)價(jià)。實(shí)驗(yàn)結(jié)果如表5和圖2所示,經(jīng)過(guò)穩(wěn)態(tài)化處理后的全麥粉菌落總數(shù)降低至1 000以下,脂肪酶及脂肪氧化酶活性降低60%以上。

表5 穩(wěn)態(tài)化全麥粉微生物情況Table 5 Microbiological condition of stabilized whole wheat flour CFU/g

圖2 穩(wěn)態(tài)化全麥粉粉脂肪相關(guān)酶活性Fig.2 Enzyme activity of stabilized whole wheat flour samples
2.3.1 全麥粉貨架期內(nèi)菌落總數(shù)測(cè)試
對(duì)上述全麥粉進(jìn)行貨架期穩(wěn)定性試驗(yàn),不同儲(chǔ)藏溫度下穩(wěn)態(tài)化全麥粉菌落總數(shù)變化情況結(jié)果見(jiàn)圖3。

圖3 不同儲(chǔ)藏溫度下穩(wěn)態(tài)化全麥粉菌落總數(shù)變化情況Fig.3 Changes in total plate count of the stabilized whole wheat flour in a long-term storage test
穩(wěn)態(tài)化全麥粉在儲(chǔ)藏期間菌落總數(shù)呈現(xiàn)下降的趨勢(shì),貯藏溫度越高,菌落總數(shù)下降越顯著。貯藏120 d后,45 ℃存放全麥粉菌落總數(shù)下降至60 CFU/g,35 ℃存放全麥粉菌落總數(shù)下降至220 CFU/g,25 ℃存放全麥粉菌落總數(shù)下降至750 CFU/g。這主要是由于面粉水分含量較低,不適合微生物的生長(zhǎng)和繁殖,尤其是當(dāng)溫度較高的情況下,部分不耐熱的微生物更加難以存活。
2.3.2 全麥粉貨架期內(nèi)脂肪酸值測(cè)試
如圖4~6所示,全籽粒全麥粉在25、35、45 ℃條件下的保質(zhì)期(脂肪酸值達(dá)到116 mgKOH/100g)分別為95、51、26 d,根據(jù)食品保質(zhì)期通用指南中的方法計(jì)算,其Q10=1.86~1.96,也就是說(shuō)溫度每升高10 ℃,其保質(zhì)期縮短1.86~1.96倍。穩(wěn)態(tài)化全麥粉在25、35、45 ℃條件下儲(chǔ)藏120 d后,脂肪酸值均未超過(guò) 116 mgKOH/100g,因此無(wú)法通過(guò)超出脂肪酸值限量的日期來(lái)判斷其準(zhǔn)確貨架期。基于前期的研究和文獻(xiàn)報(bào)道[20],面粉脂肪酸值隨時(shí)間的變化基本成線性,因此對(duì)三種儲(chǔ)藏溫度下面粉脂肪酸值上升趨勢(shì)曲線進(jìn)行線性擬合,發(fā)現(xiàn)其R2均大于0.99。斜率分別為k25=0.077 8;k35=0.158 5;k45=0.327 5。根據(jù)這一趨勢(shì)推算出其Q10=2.04~2.07。在 45 ℃條件下存放 120 d 的穩(wěn)態(tài)化全麥粉,脂肪酸值為92.18 mgKOH/100g,按照Q10=2.04~2.07推測(cè),穩(wěn)態(tài)化全麥粉若在25 ℃條件下存放499~514 d(即16~17個(gè)月左右),其脂肪酸值為92.18 mgKOH/100 g,未超出標(biāo)準(zhǔn)限量。因此,推測(cè)穩(wěn)態(tài)化全麥粉的貨架期至少為16~17個(gè)月。

圖4 25 ℃儲(chǔ)藏全麥粉脂肪酸值變化情況Fig.4 Changes in fatty acid value of the whole wheat flours in a long-term storage test (25 ℃)

圖5 35 ℃儲(chǔ)藏全麥粉脂肪酸值變化情況Fig.5 Changes in fatty acid value of the whole wheat flours in a long-term storage test (35 ℃)
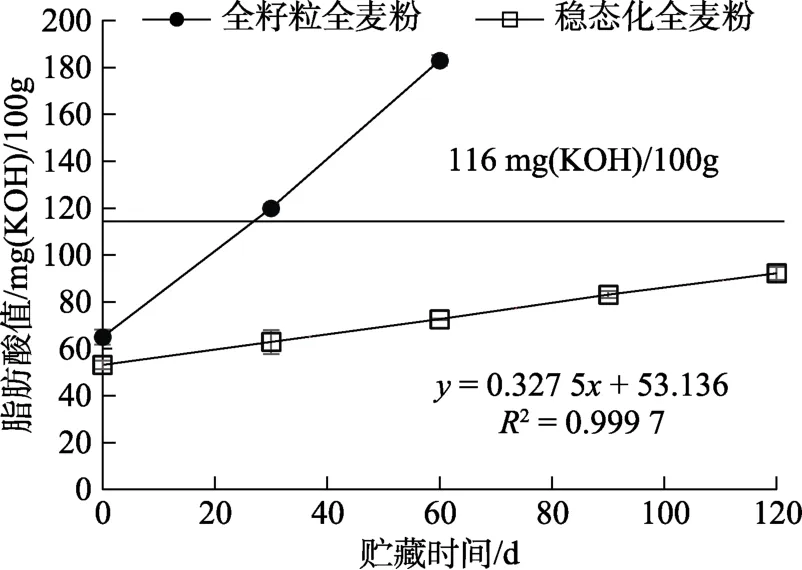
圖6 45 ℃儲(chǔ)藏全麥粉脂肪酸值變化情況Fig.6 Changes in fatty acid value of the whole wheat flours in a long-term storage test (45 ℃)
3 結(jié)論
通過(guò)前期的市場(chǎng)產(chǎn)品調(diào)研及文獻(xiàn)查閱結(jié)果顯示,與普通面粉相比,全麥粉的微生物情況和脂肪酶等引起的脂肪酸值過(guò)高和哈敗等問(wèn)題是影響其保質(zhì)期的關(guān)鍵因素。通過(guò)對(duì)微生物和酶含量較高的麩皮部分進(jìn)行蒸汽處理,可有效延長(zhǎng)全麥粉貨架期,提升全麥粉的貨架期穩(wěn)定性,極大豐富全麥粉的貯藏及應(yīng)用范圍。結(jié)果表明,麩皮經(jīng)常壓蒸汽處理10 min以上的穩(wěn)態(tài)化全麥粉,菌落總數(shù)從 9.5×103CFU/g 降低至 8.8×102CFU/g,總芽孢數(shù)從 450 CFU/g降低至10 CFU/g,并在不同溫度貯藏期間呈現(xiàn)下降的趨勢(shì)。脂肪酶和脂肪氧化酶活性降低60%以上。據(jù)推測(cè),其貨架期至少為16~17個(gè)月。

