注水黏膜切開刀推進式內鏡黏膜下剝離術切除早癌及癌前病變的應用研究
熊英,韓靜,朱亞男,于曉歡,陳玉杰,侯叢然,于占江,高雪梅,張金卓
[1.保定市第一中心醫院消化三科(河北省分子病理與腫瘤早期診斷重點實驗室),河北保定 071000;2.保定市第一中心醫院內鏡診療中心,河北保定 071000]
我國是胃癌高發區之一。隨著內鏡清晰度的提高、色素內鏡、電子染色內鏡和放大內鏡等技術的廣泛應用,早期胃癌及癌前病變的發現率逐年升高[1-2]。有研究[3]表明,內鏡黏膜下剝離術(endoscopic submucosal dissection,ESD)治療早期胃癌及癌前病變的有效率和術后復發率與外科手術相近[4-5],已逐漸代替外科手術成為治療早期胃癌的首選方法。賁門黏膜下血管及脂肪組織豐富,ESD術中易產生煙霧及切斷血管引起活動性出血;黏膜下層組織相對疏松,易導致黏膜下注射液彌散吸收快,病變抬舉時間短;賁門區域空間相對狹小,翻轉內鏡位置較高不易夠到病變,內鏡操控較困難;而大面積的賁門黏膜病變,ESD手術時間長,并發癥發生率高。因此,賁門ESD一直被內鏡醫生認為是胃ESD中最困難的術式[6]。
近年來,ESD手術器械發展迅速,注水型電刀實現了黏膜下注射與切開和剝離同時進行,避免了反復更換器械的缺點。本文應用注水型電刀行推進式內鏡黏膜下剝離術(pushing endoscopic submucosal dissection,PESD),可以在直鏡身狀態下于病變口側邊注水邊剝離至病變肛側。現報道如下:
1 資料與方法
1.1 一般資料
選取2017年1月-2020年12月保定市第一中心醫院內鏡診療中心通過白光胃鏡和色素胃鏡尋找賁門區域可疑病灶、經活組織病理證實為賁門早癌或高級別上皮內瘤變、病變最大徑>2.0 cm 的病例43 例,術前經電子染色+放大內鏡及超聲內鏡評估病變局限于黏膜下層以上者。其中,男29 例,女14 例。所有內鏡手術均由同1 名具有500 例次以上ESD 經驗的高年資內鏡醫師完成,采用雙盲法隨機分配ESD 和PESD 治療,由助理將ESD 和PESD 的手術方式裝入相同的非透明信封中,由患者抽取裝有手術方式的信封并簽署手術知情同意書,再由助理告知術者具體手術方式。本研究是前瞻性研究,已獲得保定市第一中心醫院倫理委員會的批準。
剔除標準:①活檢病理提示低分化腺癌或印戒細胞癌;②術前放大內鏡及超聲內鏡評估病變浸潤深度超過黏膜下層深層;③術前CT 等檢查發現>1.0 cm的淋巴結或遠端轉移。
1.2 手術方法及術后處理
1.2.1 內鏡與器械GIF-Q260J 內鏡、透明帽、GIF-H260Z、GIF-H290Z 放大胃鏡及黑帽(生產廠家:奧林巴斯);黏膜注射針[生產廠家:安瑞醫療器械(杭州) 有限公司,型號:AMH-SYB-2423-2304];注水型電刀(型號:MK-T-2/4-195)、止血鉗(生產廠家:南京微創醫學科技股份有限公司,型號:HBF-23/2000);一次性金屬夾(生產廠家:杭州安杰思醫學科技股份有限公司);高頻電刀[生產廠家:愛爾博(上海)醫療器械有限公司,型號:VIO 200D];氬離子凝固器[生產廠家:愛爾博(上海)醫療器械有限公司]。
1.2.2 ESD于胃底倒鏡白光發現賁門黏膜病變,用靛胭脂染色后病變邊界清晰,呈0~Ⅱc+Ⅱa型。然后標記病變范圍,每個標記點間隔0.3 cm,并于病變肛側雙標;環周切開病變周邊黏膜;沿黏膜下層中下2/3的部位進行剝離,剝離過程中需反復黏膜下注射。完整剝離病變后,用止血鉗電凝處理創面內暴露的血管;最后體外固定離體病變標本,靛胭脂染色后可見標記點完整。見圖1。
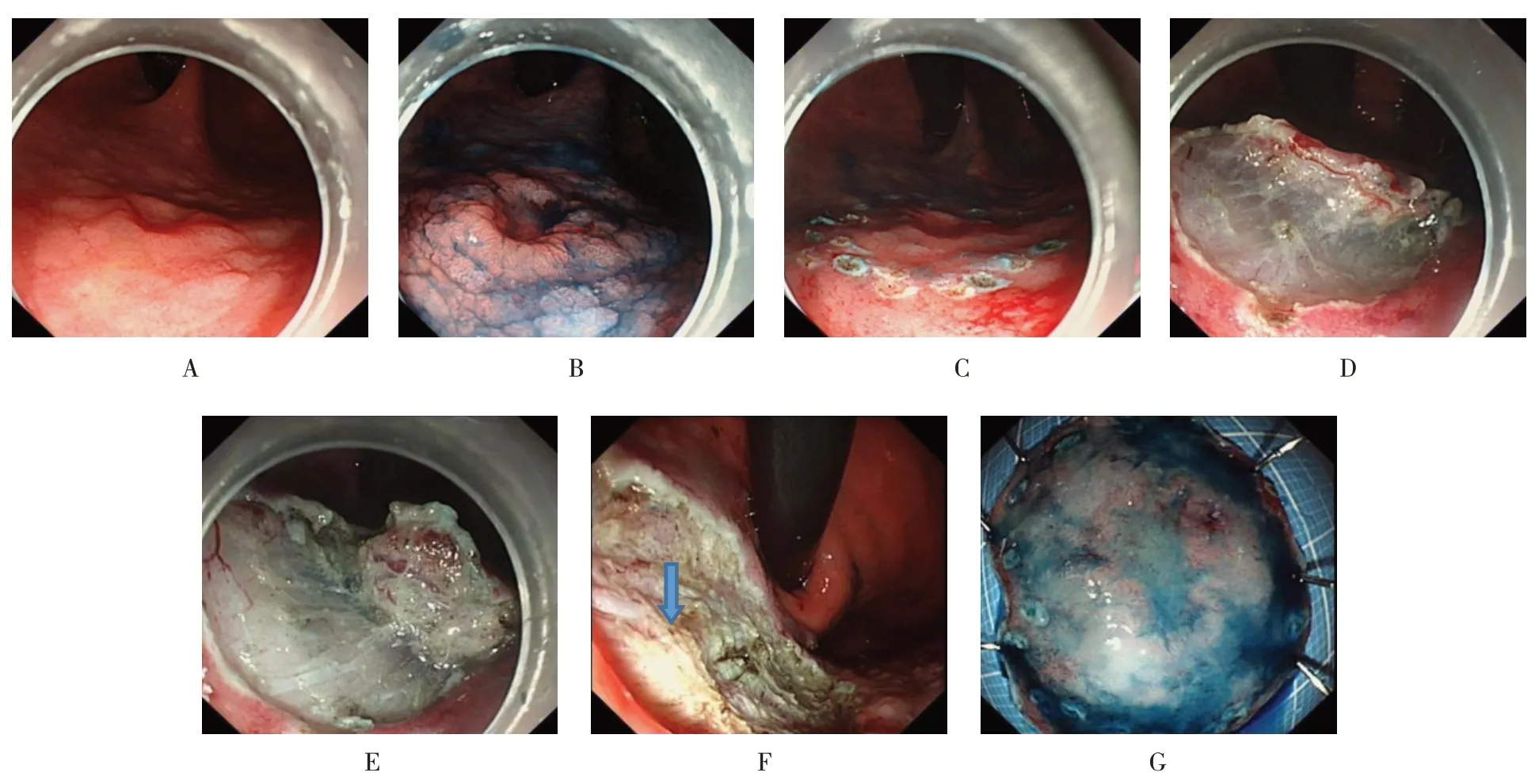
圖1 賁門ESD過程Fig.1 The procedure of ESD in cardia
1.2.3 PESD電子染色內鏡下觀察到病變(0~Ⅱc+Ⅱa型)區域后,用0.5%靛胭脂染色,以勾勒病變范圍及邊界,用內鏡下氬離子束凝固術(argon plasma coagulation,APC)于病變邊緣0.3~0.5 cm 處行環周標記,每個標記點間隔約0.3 cm,并標記病變口側或肛側。于病變口側標記點上方的黏膜下層注射含靛胭脂的1∶10萬腎上腺素鹽水,待病變抬舉,用注水型電刀在標記點外弧形切開黏膜。切開刀于黏膜下層2/3 處進行分離,依據先分離黏膜下層再沿標記點開邊的順序,邊注水邊剝離,從病變口側向肛側推進;開邊順序應依據重力,先切開重力對側的黏膜,使病變懸吊于胃內,再切開重力側黏膜。完整切除病變后,用止血鉗和APC 處理創面內暴露的小血管和血管斷端,必要時用金屬夾處理。取出切除的病變標本,固定于預先準備好的塑料泡沫板上,靛胭脂染色后觀察是否切除完整,標記口側和肛側,體外測量病變大小后放入福爾馬林液中固定送病理。見圖2。
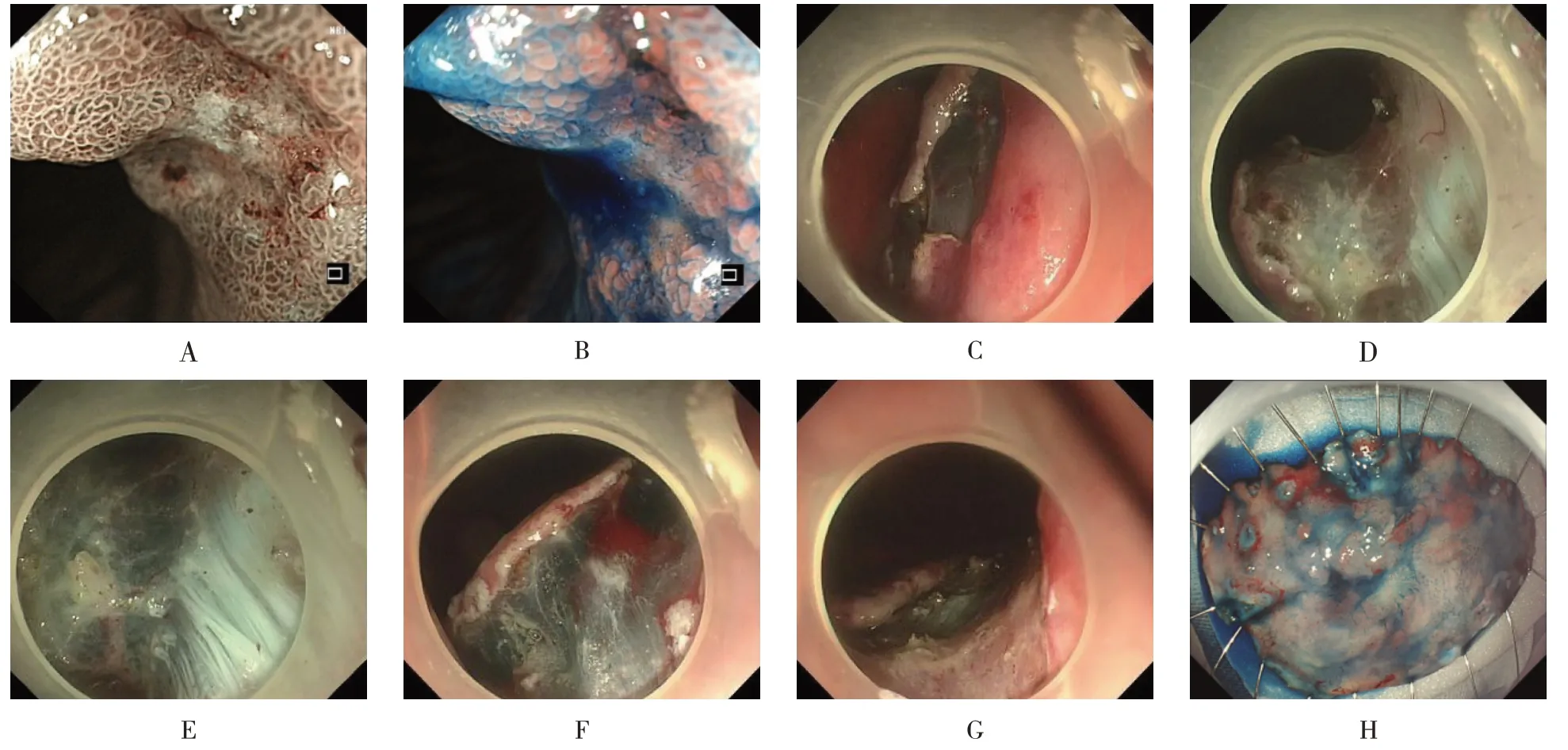
圖2 賁門早癌PESD過程Fig.2 The procedure of PESD in cardia
1.3 術后處理
患者術后禁食水48~72 h,常規靜脈營養補液并應用質子泵抑制劑。術中出血量較多、損傷固有肌層或穿孔的患者,術后禁食水72 h,給予靜脈抗生素預防感染,必要時行胃腸減壓。禁食結束后從流食逐漸過渡至半流食和軟食。于術后3、6 和12 個月復查胃鏡,觀察創面愈合情況、是否有病變殘留及復發等情況。
將所有切除的病變送病理檢查,以明確性質及浸潤深度,觀察切緣有無殘留及基底部有無病變累及。
1.4 記錄術中和術后相關情況
術中記錄每例患者的病變大小、病變剝離時間、術中出血和術中穿孔的情況。病變剝離時間指從黏膜下注射開始至病變完全切除結束所需的時間。術中出血指ESD術中電刀或止血鉗切斷血管引起的活動性出血,需要用止血鉗處理,不包括切緣及創面表面小血管滲血。
術后記錄遲發性出血及穿孔情況、術后病理結果和住院時間等。遲發性出血:ESD術后出血需再次內鏡下止血。遲發性穿孔:患者術中未見明顯穿孔,術后24 h后出現突發腹痛等穿孔跡象,并經影像學檢查證實。
1.5 統計學方法
選用SPSS 25.0 統計軟件對結果進行分析,計數資料以例(%)表示,行χ2檢驗,計量資料以均數±標準差(±s)表示,行配對t檢驗,P<0.05為差異有統計學意義。
2 結果
PESD 組(n=32)病變直徑2.0~8.0 cm,平均(5.1±2.9)cm;其中1處病變位于前壁,16處位于后壁,3處位于大彎側,12處位于小彎側;30處病變為一次性切除,2 處病變(賁門大彎側)為分塊切除;剝離時間19~112 min,平均(65.5±48.3)min;術中出血8例(25.0%),術中出血病例均成功內鏡下止血,無遲發性出血及穿孔發生,術后住院3~5 d。2處病變(1 處位于小彎側,1 處位于后壁)深度浸潤至黏膜下層深層(>500 μm),追加外科手術。1 處浸潤深度達460 μm(位于后側),患者及家屬拒絕外科手術,目前密切隨訪中,暫未發現復發及轉移。其他病變均為高級別上皮內瘤變或浸潤深度<300 μm的高中分化腺癌。
ESD 組(n=17) 病變直徑2.0~6.5 cm,平均(4.2±2.2)cm;2 處病變位于前壁,10 處位于后壁,5處位于小彎側;所有病變均為一次性切除;剝離時間26~157 min,平均(91.5±26.5)min;術中出血8例(47.1%),均成功內鏡下止血,術中穿孔2 例(11.8%),均給予金屬夾夾閉并內科保守治療取得成功,無遲發性出血和遲發性穿孔發生,術后住院3~6 d。1處病變(位于后壁)為高分化腺癌,浸潤深度超過黏膜下層500 μm,與患者及家屬協商,綜合考慮患者高齡(男,79 歲)且基礎疾病較多,未追加外科手術,目前密切隨訪中。1 處病變(位于后壁)術后病理提示為低分化腺癌(術前病理未檢測到低分化癌細胞),雖浸潤深度僅在黏膜下層100 μm,但考慮腫瘤惡性程度高、患者較年輕(男,52 歲)且一般情況良好,經患者及家屬同意后,追加外科手術切除。其余病變均為高級別上皮內瘤變或浸潤深度<300 μm 的高中分化腺癌。兩組手術相關情況比較見附表。

附表 兩組患者手術相關情況比較Attached table Comparison of operation related conditions between the two groups
3 討論
近年來,我國賁門癌在胃癌中所占比例逐年增加[1,5],由于賁門癌早期癥狀不明顯,超過90.0%的患者就診時已屬中晚期,其5年生存率不足20.0%。因賁門內鏡活檢取材困難,早期檢出率很低,影響了患者接受根治性治療的可能性和治療效果。隨著人們對健康的重視以及內鏡診斷水平的提高,特別是高清晰度內鏡、色素內鏡和放大內鏡等技術的發展,使早期賁門癌和癌前病變檢出率大幅提高,大部分早期賁門癌患者在內鏡下即可獲得根治性治療,5年生存率超過90.0%[7-8]。由于賁門的特殊解剖結構,手術難度在胃ESD中最大。
賁門ESD 的手術難點主要包括:①賁門空間狹窄,正鏡狀態下視野不佳,倒鏡狀態又因病變位置較高、內鏡角度不夠,導致操作困難;②傳統ESD的步驟是先開邊再剝離,但賁門黏膜下層組織疏松,完全開邊后黏膜下注射液彌散快,液體墊隆起時間短,在黏膜下注射后器械還沒有更換好的情況下,液體墊就消失了,盡管有研究[9-10]報道了許多應對方法,如:牙線法、磁石懸吊法和彈力線法等,但都是在無液體墊的情況下進行剝離,而對于內鏡操控水平不成熟的醫師或黏膜下層有粘連的病變者,在沒有液體墊的情況下剝離易發生穿孔,本研究ESD組病例術中穿孔發生率達11.8%,也證實了這一觀點,如果不完全開邊僅做“黏膜下隧道”,在打通“隧道”后切邊因為沒有著力點,在進一步切開時比較困難[11];③賁門處黏膜下血管豐富,在黏膜下液體隆起不充分的情況下,電切常導致活動性出血,影響操作視野,頻繁的電凝止血會造成組織過多的灼傷,產生較多的煙霧,影響視野,給ESD手術帶來困難,本研究ESD組術中出血率達47.1%。雖然術中出血和穿孔沒有延長患者住院時間,但延長了手術操作時間,增加了危險性,同時需要使用金屬夾和尼龍繩等器械,且術后要留置胃腸減壓管、靜脈應用抗生素等,加重了患者經濟負擔和身體上的不適。
注水型電刀實現了邊黏膜下注射邊剝離,且術中不用經常更換器械,縮短了ESD手術時間,由病變口側向肛側行PESD,避免了賁門區域內鏡需高位翻轉造成角度不夠的問題,還可以將注水、剝離同時進行,可以清晰地發現黏膜下層血管,提前用止血鉗或電刀電凝干預,最大程度地減少了出血和穿孔的發生。本研究中,PESD組術中穿孔發生率為0.0%,術中出血發生率為25.0%,均明顯低于ESD組(P<0.01),兩組病變平均大小無明顯差異(P>0.05),PESD組的剝離時間明顯少于ESD組(P<0.01),兩組完整切除率比較差異亦無統計學意義(P>0.05)。考慮原因可能為:①正鏡身狀態下內鏡可更好地進入到病變黏膜下層,視野良好,在電刀與固有肌層平行的情況下,不易出現穿孔;②由近至遠的推進式剝離方式,可以充分利用重力使病變懸吊于胃內,更好地顯示病變局部解剖結構;③由于電刀兼顧注水和剝離的作用,完全開邊后不存在液體彌散快的問題,黏膜下剝離過程中液體墊隆起狀態始終良好,使病變剝離速度更快;④賁門黏膜下層一些看似很粗的血管,其實是由很多細支的柵欄狀血管聚集而成[12],盲目電凝切斷會導致多個出血點一起出血,在黏膜下剝離時若發現較粗的血管,可以先于血管周圍注射液體墊,待血管叢分離成多個相對較細的血管后再逐個電凝切斷,對于分離后仍然粗大的血管,可采用止血鉗柔和電凝完全碳化后再切斷,以避免術中出血[13],而常規ESD由于要更換注射針等器械,過程較繁瑣,很多內鏡醫師會選擇直接電凝切斷,常導致活動性出血。
綜上所述,注水型電刀行PESD 是一種切除賁門區域較大面積早癌及癌前病變快捷且安全的治愈性切除方法,但本研究所涉及的樣本量較小,有待進一步大樣本的研究進行佐證。

