頸動脈體在COPD大鼠甲狀腺形態及功能變化中的作用
楊洋 蘇文凌 王小義 趙曉赟
(天津市胸科醫院 1內分泌科,天津 300000;2門診辦公室;3呼吸與危重癥醫學科)
甲狀腺是人體重要的內分泌器官,甲狀腺激素對人體的代謝具有重要意義。臨床中常發現慢性阻塞性阻肺疾病(COPD)患者、呼吸衰竭患者、阻塞性睡眠呼吸暫停低通氣綜合征患者伴有甲狀腺功能異常改變〔1,2〕,但對其機制的研究較少,本研究探討COPD大鼠甲狀腺的形態、病理及功能變化及其機制。
1 材料與方法
1.1材料 脂多糖(LPS)購自Sigma公司;前門牌香煙購自天津卷煙廠;自制動物煙霧箱;小動物肺功能儀購自北京廣源達科技發展有限公司。
1.2動物分組 雄性Wistar大鼠30只,體重200~250 g,購于天津市實驗動物中心。按隨機數字法分為COPD組20只和對照組10只。COPD造模成功后,再隨機分為頸動脈體化學損傷亞組(COPD-真損傷組)和頸動脈體假損傷亞組(COPD-假損傷組)各10只。
1.3COPD模型的建立 采用香煙熏霧聯合LPS法制作COPD模型〔3〕。實驗組氣管內注入LPS(0.2 ml),對照組氣管內注入0.2 ml 0.9%NaCl。分別在第1、15、30、45天注藥。實驗組采用煙熏法(前門牌香煙,焦油含量12 mg/支),2次/d,每次10支煙,每次1 h,共60 d。對照組放入煙熏箱,但不給予煙熏,共60 d。第30天進行肺功能檢測,第0.3秒用力呼氣容積(FEV0.3)與用力呼氣容積(FVC)比值小于70%,繼續造模,否則重新補充大鼠,最終通過病理鑒定。
1.4頸動脈體損傷手術 COPD造模成功后,行頸動脈體損傷手術:用水合氯醛以300 mg/kg劑量腹腔內注射進行麻醉,麻醉后仰臥綁定大鼠四肢;頸部去毛,用75%酒精對大鼠頸部皮膚進行消毒,沿頸中線做一長2 cm的縱行切口,充分暴露頸內結構后,鈍性分離出雙側頸動脈分叉部,至上下各1 cm;用彎頭鑷子從頸動脈分叉處夾起頸動脈,將浸泡有10%過氧化氫的寬約2 cm的濾紙條包裹頸動脈,停留3 min;取下濾紙,用0.01 mol/L磷酸鹽緩沖液(PBS)清洗刀口處3次后縫合;待大鼠蘇醒后送回動物房,保證食物和飲水供應。頸動脈體假手術:僅在用0.9%NaCl溶液浸泡的濾紙條包裹頸動脈,其他步驟操作方法與頸動脈體損傷手術組完全相同。
1.5血液及標本采集 COPD模型制備成功后,于第60天將大鼠腹腔注射10%水合氯醛溶液(0.3 ml/100 g)3 ml麻醉,由左心室插入靜脈針頭取血約10 ml處死,收集血液標本,離心后-80℃凍存待測。在冰床上迅速解剖分離出大鼠甲狀腺稱重后連同頸動脈放入中性緩沖甲醛固定液固定。
1.6甲狀腺功能相關指標 采用放射免疫分析法對大鼠血清三碘甲狀腺原氨酸(T3)、甲狀腺素(T4)、促甲狀腺素(TSH)、反T3(rT3)、甲狀腺過氧化物酶抗體(TG-Ab)、甲狀腺球蛋白抗體(TPO-Ab)進行測定(由北方醫學檢測中心完成)。
1.7甲狀腺及頸動脈體病理結構 固定好的甲狀腺和頸動脈,常規石蠟包埋、切片,蘇木素-伊紅(HE)染色,進行病理觀察。
1.8統計學分析 應用SPSS19.0軟件進行t檢驗。
2 結 果
2.1COPD大鼠模型制作成功 對照組肺組織機構清晰,肺泡完整沒有炎性滲出。COPD組肺泡結構被破壞,可見肺大皰形成,間質可見大量炎癥細胞,見圖1。
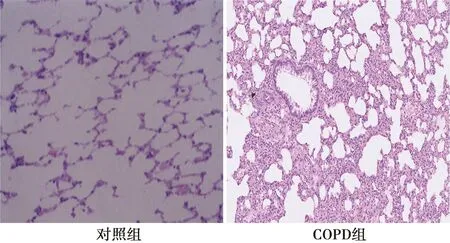
圖1 肺組織病理(HE,×40)
2.2各組甲狀腺重量比較 COPD-假損傷組甲狀腺重量為(69.96±14.62)mg,COPD-真損傷組為(47.21±5.97)mg,對照組為(45.20±4.89)mg,COPD-假損傷組與對照組和COPD-真損傷組比較差異有統計學意義(P<0.05)。
2.3各組血清T3、T4、TSH、rT3、TPOAb、TgAb水平變化 COPD-假損傷組TSH、T3、T4、rT3、TG-Ab、TPO-Ab水平與COPD-真損傷組和對照組比較差異有統計學意義(P<0.05),見表1。
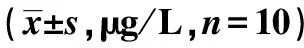
表1 各組血清T3、T4、TSH、rT3、TPOAb、TgAb水平比較
2.4各組甲狀腺、頸動脈體病理變化 對照組與COPD-真損傷組甲狀腺病理:濾泡大小基本一致,完整,圓形或橢圓形,充滿紅色膠質,染色均勻,濾泡間質無水腫,上皮細胞無增生。COPD-假損傷組甲狀腺病理:濾泡大小不一致,有破壞,可見胞質流出,可見異常增生。對照組和COPD-假損傷組頸動脈體可見大量成熟神經元細胞,少量上皮細胞。COPD-真損傷組可見少量神經元細胞,較多上皮細胞,見圖2。
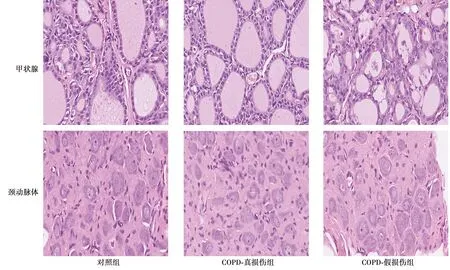
圖2 各組甲狀腺、頸動脈體變化(HE,×40)
3 討 論
下丘腦-垂體-甲狀腺系統在調節機體的各種病理狀態和應激反應下可以發生相應改變。下丘腦與腺垂體之間通過垂體門脈系統發生功能聯系,下丘腦產生的釋放激素和釋放抑制激素經垂體門脈系統調節腺垂體分泌活動,另一方面,腺垂體產生的各種激素又可通過垂體血液環流,到達下丘腦,反饋影響下丘腦功能活動。腺垂體產生的激素作用于全身靶器官(靶腺),同時接受其反饋調節,并反饋調節下丘腦功能,形成下丘腦-垂體-靶腺軸系統〔4~6〕。 甲狀腺、垂體、下丘腦等為高代謝器官,甲狀腺激素屬于高耗氧激素,所以對于缺氧反應比較敏感;缺氧持續加重,不僅甲狀腺自身分泌激素減少,垂體和下丘腦也會做出相應改變,進一步減少甲狀腺激素的釋放。所以可能出現TSH、T3、T4同時下降的可能。曾有文獻報道危重的COPD患者伴有垂體性甲狀腺功能減退,即甲功三項同時減低的情況〔7~9〕。未經補充甲狀腺激素,隨著原發疾病好轉,甲狀腺激素水平恢復正常,說明了甲狀腺激素水平的下降是適應性改變〔10〕。本研究結果證實了甲狀腺激素水平的下降不是甲狀腺自身疾病所致,與甲狀腺在缺氧條件下發生適應性改變相一致。既往動物實驗證實,間歇性缺氧大鼠模型能引起下丘腦-垂體-甲狀腺軸的功能紊亂〔11〕。本研究結果說明在慢性缺氧狀態下,甲狀腺發生了自身免疫反應,從而導致甲狀腺濾泡破壞,分泌功能下降。
本課題組一直致力于研究頸動脈體在COPD、阻塞性睡眠呼吸暫停綜合征等缺氧性疾病中的作用〔12〕。人類的頸動脈體長約6 mm,位于頸總動脈分叉處血管外膜的結締組織內,由該結締組織發出若干小隔伸入體內而將其分為若干小葉。供給頸動脈體的神經為由舌咽神經發出的竇神經,該神經是由傳入纖維組成,并認為頸動脈體為一化學感受器。電鏡下頸動脈體含有兩型細胞,Ⅰ型為顆粒性的主細胞,Ⅱ型為非顆粒性的支持細胞。一般認為Ⅰ型細胞具有化學感受功能,當缺氧發生時該細胞可釋放神經遞質,產生傳入神經興奮。頸動脈體的Ⅰ型細胞內含有兒茶酚胺,故認為頸動脈體屬于副神經節,類似內分泌組織〔13〕。既往有研究顯示頸動脈體位于頸總動脈分叉處,通過神經通路反饋到呼吸調劑中樞及運動中樞,再經過反射弧對呼吸驅動力和呼吸節律進行調節〔14〕。本研究結果提示頸動脈體可能介導了缺氧對甲狀腺的損傷。頸動脈體作為一種化學感受器,本實驗初步證明了其在缺氧與組織損傷之間的作用,具體機制有待進一步研究。

