皮下注射免疫球蛋白對實驗性自身免疫性重癥肌無力小鼠的治療效果
盛譽妍,何美霞,游普云,張迎娜,賀笑笑,沈 童,方 華,崔新征,高 峰1,,張清勇2,
1)鄭州大學第三附屬醫院教學辦公室 鄭州 450052 2)鄭州大學河南省醫藥科學研究院神經免疫重點實驗室 鄭州 450052 3)河南省人民醫院重癥肌無力綜合診療中心 鄭州 450003
重癥肌無力(myasthenia gravis,MG)是指由抗體介導、細胞免疫依賴、補體參與、主要累及神經肌肉接頭(neuromuscular junction,NMJ)突觸后膜乙酰膽堿受體(acetylcholine receptors,AChR)的獲得性自身免疫性疾病[1-2]。其中介導的抗體包括針對骨骼肌的AChR抗體、肌肉特異性酪氨酸激酶抗體和低密度脂蛋白受體相關蛋白4抗體[3]。MG臨床特征是波動性肌無力和易疲勞,肌無力癥狀隨活動而增加,隨休息而改善,嚴重時可累及呼吸肌導致窒息死亡。靜脈注射免疫球蛋白(intravenous immunoglobulin,IVIg)可有效中和循環中的自身抗體并調節免疫反應,以往常用于難治性MG和肌無力危象[4]。皮下注射免疫球蛋白(subcutaneous immunoglobulin,SCIg)作為目前熱門的新型免疫療法已引起人們的關注[5],但將SCIg運用于MG的日常治療還處于早期臨床研究階段。為此,我們以實驗性自身免疫性重癥肌無力(experimental autoimmune myasthenia gravis,EAMG)小鼠模型為研究對象,給予多點SCIg,觀察肌力、血清AChR-Ab水平和肌纖維超微結構的變化,探討SCIg對EAMG的治療效果,為尋求MG治療新方法提供實驗依據。
1 材料
1.1 實驗動物、藥品及試劑SPF級C57BL/6雌性小鼠50只,6~7周齡,體重15~18 g,購自北京維通利華實驗動物技術有限公司,生產許可證:SCXK(京)2016-0006。純化小鼠IgG凍干粉由武漢原谷生物科技有限責任公司合成,批號BMA202006002;鼠源性AChR-α亞基97~116肽段(R97-116)由上海淘普生物科技有限公司合成,批號TP-20057938。HRP標記的山羊抗小鼠IgG購自北京鼎國昌盛生物技術有限責任公司;完全弗氏佐劑、不完全弗氏佐劑均購自美國Sigma公司。小鼠IgG ELISA檢測試劑盒購自杭州聯科生物技術股份有限公司。
1.2 EAMG小鼠模型的制備參照Baggi等[6]方法,將R97-116、完全弗氏佐劑、PBS按50 μg、100 μL、100 μL的配比充分混合,制成油包乳劑。首次免疫:于小鼠背部上肩胛2點及雙后足墊底部皮下注射乳劑200 μL(含50 μg R97-116)。加強免疫:首次免疫后第4、8及12周進行3次加強免疫,于小鼠背部2點、兩后大腿各1點皮下注射R97-116、不完全弗氏佐劑、PBS混合的乳劑200 μL(含50 μg R97-116)。末次注射后第2周對小鼠進行評估。①Lennon評分≥1分[7]。②血清AChR-Ab陽性(ELISA法檢測)。③腓腸肌低頻重復神經電刺激第4個電位對第1個電位的衰減度大于10%。④新斯的明試驗陽性。滿足①且②、③、④中任意一項,則認為模型制備成功。
1.3 實驗分組隨機數字表法選取5只小鼠作為正常組:首次免疫注射等量PBS和完全弗氏佐劑混合乳劑,加強免疫注射等量PBS和不完全弗氏佐劑混合乳劑。其余45只按1.2造模,造模成功18只,隨機分為EAMG組4只、潑尼松組4只、SCIg低劑量組5只、SCIg高劑量組5只。正常組及EAMG組給予生理鹽水0.2 mL/d灌胃,潑尼松組給予潑尼松9 mg/(kg·d)灌胃,共灌胃2周。SCIg低、高劑量組:每周2次皮下注射IgG,每次至少間隔2 d,每次于4個部位(背部、大腿或臀部,劑量均分)并保持適當距離注射;第1周兩組劑量均為2.25 mg/g,第2周分別為2.25、4.50 mg/g[8-9]。
1.4 檢測指標及方法
1.4.1Lennon評分 小鼠第1次加強免疫后每隔1周測肌力,進行Lennon評分:正常肌力為0分;休息時不明顯、四肢較弱為1分;精神不振、前肢無力為2分;肌肉無力、無法抓握甚至呼吸困難為3分;接近死亡或死亡為4分。介于兩種表現之間計為0.5、1.5或2.5分。
1.4.2血清AChR-Ab水平、IgG含量測定 治療前剪尾、給藥2周后麻醉摘眼球采集小鼠血液標本,靜置離心后取血清。血清AChR-Ab水平測定:用R97-116(5 mg/L)100 μL/孔包被96孔板,加入1∶10稀釋的小鼠血清50 μL/孔,37 ℃溫浴30 min,洗滌,加入HRP標記的山羊抗小鼠IgG孵育30 min,洗板,加入底物TMB顯色,顏色最深時加2N硫酸溶液終止反應,采用酶標儀測定450 nm波長處的吸光度,以此表示血清AChR-Ab水平。血清IgG含量測定采用ELISA法,按照試劑盒說明書操作。
1.4.3外周血嗜中性粒細胞與淋巴細胞計數 將摘眼球取的血樣置于EDTA抗凝管中,用全自動血細胞分析儀測定白細胞計數(WBC)、嗜中性粒細胞計數(NEUT)和淋巴細胞計數(LYMPH),計算嗜中性粒細胞和淋巴細胞比值(NLR)。
1.4.4骨骼肌超微結構電鏡觀察 肌肉取材在低溫下進行,提前預冷手術器械。小鼠麻醉后,固定于平板上,剪開皮膚,取腓腸肌并切割修成1 mm3大小,于戊二醛中固定2 h(4 ℃),送至河南中醫藥大學中醫藥科學院進行電鏡觀察。
1.5 統計學處理采用SPSS 23.0進行數據分析。應用重復測量數據的方差分析比較EAMG組、潑尼松組、SCIg低劑量組、SCIg高劑量組小鼠Lennon評分和血清AChR-Ab水平;應用單因素方差分析比較5組小鼠血清IgG含量及外周血細胞計數,兩兩比較采用LSD-t檢驗。檢驗水準α=0.05。
2 結果
2.1 小鼠Lennon評分和血清AChR-Ab水平測定結果見表1。潑尼松組、SCIg組治療后血清AChR-Ab水平和Lennon評分均較治療前降低,SCIg高劑量組降低程度大于低劑量組。
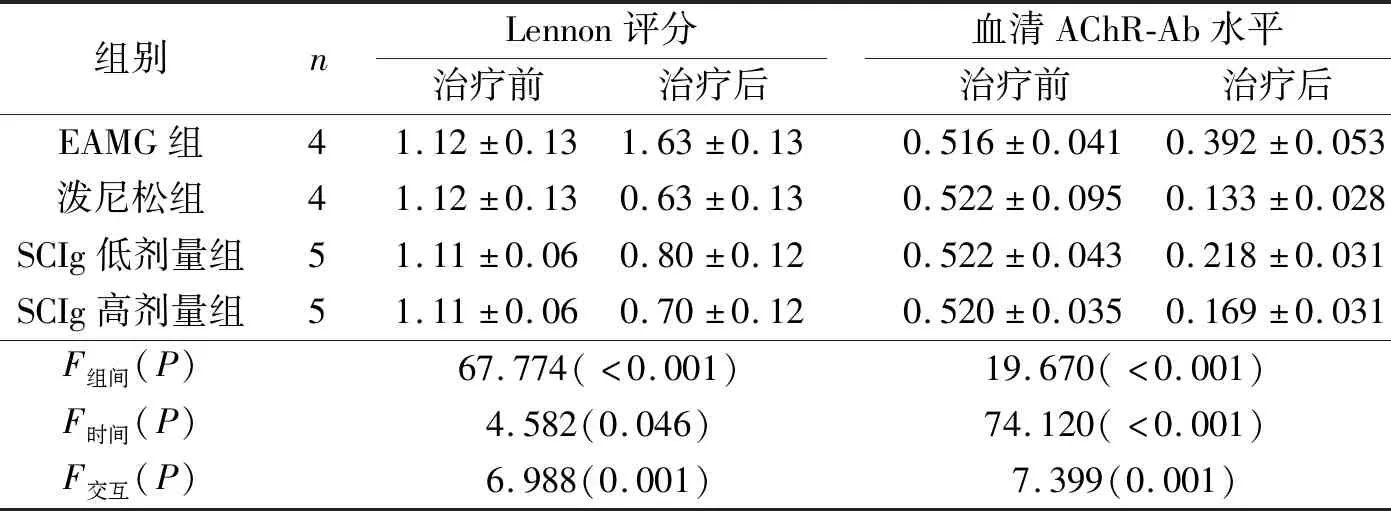
表1 4組小鼠Lennon評分和血清AChR-Ab水平的比較
2.2 小鼠血清IgG含量及外周血細胞計數結果見表2。與正常組相比,EAMG組血清IgG含量升高,NEUT增加,LYMPH降低,NLR升高。與EAMG組相比,潑尼松組血清IgG含量、WBC、NEUT、LYMPH均降低。與EAMG組相比,SCIg高劑量組血清IgG含量、NEUT和NLR降低。

表2 5組小鼠血清IgG含量、外周血細胞計數及NLR的比較
2.3 電鏡下骨骼肌超微結構見圖1。正常組肌纖維結構完整正常;EAMG組肌纖維間隙相對增寬,肌絲溶解紊亂,線粒體數量明顯減少,出現云絮狀病變及空泡化;潑尼松組肌纖維結構紊亂,肌絲溶解,線粒體嵴斷裂、空泡化;SCIg低劑量組肌纖維結構較清晰完整,肌纖維較稀疏,線粒體空泡化;SCIg高劑量組線粒體嵴致密度相對較為均勻,結構較為清晰,排列規律性恢復較好。

A:正常組;B:EAMG組;C:潑尼松組;D:SCIg低劑量組;E:SCIg高劑量組;1:×5 000;2:×30 000;箭頭指示為線粒體嵴圖1 5組小鼠骨骼肌線粒體超微結構電鏡觀察
3 討論
潑尼松是MG的一線免疫治療藥物,主要通過免疫抑制,緩解患者的臨床癥狀,有效控制MG,但典型的治療方案會導致至少30%的患者因給藥劑量和持續時間而發生不良反應[10]。治療性IgG由從幾千名健康獻血者血漿中獲得的正常IgG組成,對自身免疫性疾病有顯著的療效[8]。IgG以IVIg或SCIg的形式施用,由于IVIg有治療限制并可能導致全身不良事件,因此SCIg的使用變得越來越普遍,SCIg目前已成為MG的新興治療選擇。
本研究結果顯示,潑尼松和SCIg治療2周后,EAMG小鼠癥狀評分降低,肌無力癥狀緩解,血清AChR-Ab水平下降,說明SCIg與潑尼松一樣,可降低MG自身抗體水平,達到治療目的;潑尼松組EAMG小鼠治療后WBC、NEUT、LYMPH均有一定程度地降低,表明潑尼松在降低MG自身抗體濃度的同時,可導致小鼠細胞免疫功能減弱,增加感染的風險。而SCIg組EAMG小鼠治療后WBC、LYMPH變化不明顯,表明SCIg不影響小鼠的淋巴細胞數量,避免了感染的風險。本研究結果還顯示,SCIg高劑量組小鼠骨骼肌肌纖維線粒體嵴致密度均勻,結構較為清晰,排列恢復,說明SCIg能顯著改善EAMG小鼠肌纖維及線粒體功能。
越來越多的證據[11-13]表明,慢性炎癥可能與 MG的發病關系密切。NLR代表嗜中性粒細胞和淋巴細胞水平之間的平衡,可反映慢性炎性疾病的炎癥狀況[14-15]。NLR計算簡單,且穩定性較強[16-18]。有研究[19]證實 MG 患者NLR 明顯高于健康對照,且可能與 MG 嚴重程度有關。本研究中,EAMG組小鼠NLR明顯高于正常組;治療2周后,SCIg高劑量組小鼠NLR下降,說明高劑量SCIg可以降低EAMG小鼠體內的炎癥反應水平。
綜上所述,SCIg可能通過免疫調節作用,降低機體內炎癥反應水平,改善肌纖維線粒體的超微結構,從而改善EMAG小鼠的肌肉能量代謝、改善神經肌肉傳導,緩解肌無力癥狀;同時SCIg并不影響機體內淋巴細胞的數量,避免了感染的風險。SCIg有可能成為MG及其他自身免疫性疾病治療方案的新選擇。

