長鏈非編碼RNA LCPAT1對骨肉瘤細胞增殖、凋亡、侵襲的影響及機制
李季,段祥林
武漢市紅十字會醫院骨科,武漢430015
骨肉瘤(OS)是間質起源的惡性骨腫瘤,表現為成骨細胞分化和惡性類骨質形成,伴有局部腫脹和疼痛。OS是青少年常見的惡性骨腫瘤類型,占青少年惡性腫瘤的5%~10%,是青少年癌癥相關死亡的第六大原因[1]。OS的主要死亡原因是肺轉移,即使經過積極治療,OS患者的5年生存率仍低于20%[2]。長鏈非編碼RNA(LncRNA)是一類長度超過200nt,不具有編碼蛋白質功能的RNA分子[3]。最近研究表明[4],在OS發展過程中一系列的LncRNA分子存在差異性表達,如LncRNA BC040587、LncRNATUSC7和LncRNA MALAT1等。長鏈非編碼RNA LCPAT1(LncRNA LCPAT1)是最新鑒定的LncRNA分子,研究顯示,其在非小細胞肺癌[5]和乳腺癌[6]中表達上調,且發揮癌基因的作用。2020年3月—2021年1月,我們探討了LncRNA LCPAT1在OS細胞系中的表達、功能及機制。
1 材料與方法
1.1 材料 人成骨細胞系hFOB 1.19和OS細胞系Saos-2、U-2OS、MG-63均購自美國ATCC細胞庫,RPMI1640培養基購自美國Thermo Fisher公司。LncRNA LCPAT1過表達質粒(pcDNA3.1-LCPAT1)和LncRNA LCPAT1沉默表達質粒(LCPAT1-shRNA)及對照質粒由上海吉瑪生物科技有限公司合成,RIPA蛋白質提取試劑購自瑞士Roche公司,Transwell侵襲小室購自美國Invitrogen公司,LipofectamineTM3000 試劑購自美國Invitrogen公司,iScriptTMcDNA合成試劑盒購自美國Bio-Rad公司,FastStart Universal SYBR Green Master試劑盒購自瑞士羅氏公司,CCK-8試劑盒購自中國Beyotime生物公司,Annexin-V-FITC檢測試劑盒購自美國BioVision公司和流式細胞儀購自美國BD公司,蛋白印跡試劑盒購自武漢博士德生物工程有限公司。
1.2 細胞培養、轉染及分組 人成骨細胞系hFOB 1.19和OS細胞系Saos-2、U-2OS、MG-63均接種于含有10% FBS的RPMI1640培養基,37 ℃、5%CO2條件下培養。嚴格按照制作商提供的說明書操作,使用LipofectamineTM3000 試劑對OS細胞系Saos-2分別轉染pcDNA3.1- LCPAT1、LCPAT1-shRNA及對照質粒,并分成LCPAT1上調表達組(pcDNA3.1- LCPAT1組)、LCPAT1沉默表達組(sh-LCPAT1組)及對照組(NC組),通過qRT-PCR實驗驗證轉染效率,轉染后48 h,處理細胞用于下一步實驗。
1.3 LncRNA LCPAT1表達檢測 采用qRT-PCR法。使用iScriptTMcDNA合成試劑盒從1 μg分離的總RNA中生成cDNA。使用FastStart Universal SYBR Green Master試劑盒行qRT-PCR反應。反應體系:2.5 μL cDNA模板、1 μL正向引物(10 μmol/L)、1 μL反向引物(10 μmol/L)、10 μL 2×SYBR Green主混合物、5.5 μL ddH2O。反應步驟:95 ℃ 2 min、95 ℃ 15 s、60 ℃ 25 s、72 ℃ 60 s共40個循環。qRT-PCR反應引物如下:LncRNA LCPAT1 正向引物:5′-CCAGACACCTAACCAACTTCC-3′,反向引物:5′-GTGATCTCATCCCTCTTGCTT-3′;GAPDH正向引物:5′-AGAAGGCTGGGGCTCATTTG-3′,反向引物:5′-AGGGGCCATCCACAGTCTTC-3′。以GAPDH為內參,采用2-ΔΔCt法計算LncRNA LCPAT1相對表達量。
1.4 細胞增殖能力測定 采用CCK-8實驗。將pcDNA3.1-LCPAT1組、NC組及sh-LCPAT1三組細胞接種到96孔培養板(2×104/mL,100 μL/孔)中。在每孔中加入CCK-8試劑10 μL,并于37 ℃下繼續培養2 h。酶標儀于490 nm處測量光密度(OD)值,并以OD490值表示細胞活力。
1.5 細胞凋亡能力測定 將pcDNA3.1- LCPAT1組、NC組及sh-LCPAT1組按每組2×105個細胞收集于1.5 mL EP管中。在4 ℃以2 000×g離心后,棄上清液。添加500 μL結合緩沖液使細胞懸浮,并添加5 μL Annexin V-FITC,并于4 ℃下暗室孵育30 min。然后,加入5 μL碘化丙啶(PI),輕輕混合并在室溫下孵育5 min。使用Annexin-V-FITC檢測試劑盒和流式細胞儀檢測三組細胞凋亡率。
1.6 細胞侵襲能力測定 將pcDNA3.1-LCPAT1組、NC組及sh-LCPAT1組細胞接種于含有DMEM培養基的Transwell侵襲小室上室中,下室包含補充有10%FBS的DMEM培養基。溫育24 h后,用棉簽除去保留在上膜的細胞,用甲醇和0.1%結晶紫固定穿膜細胞,并在光學顯微鏡下計數穿膜細胞數,200倍視野下計數10個視野,取平均值。
1.7 EMT相關蛋白表達檢測 采用蛋白印跡分析法。用RIPA蛋白質提取試劑從pcDNA3.1-LCPAT1組、NC組及sh-LCPAT1組對數生長期細胞提取總蛋白,經Bio-Rad蛋白測定試劑盒測定蛋白總濃度。通過10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分離50 μg蛋白質,然后將其轉移至硝酸纖維素膜。在室溫下用5%脫脂奶封閉膜1 h,分別使用相應的一抗E-cadherin(1∶200)、N-cadherin (1∶200)、Snail (1∶200)、Twist1(1∶200)和GAPDH(1∶800) 在4 ℃孵育過夜,漂洗3次,每次10 min, 隨后用辣根過氧化物酶HRP兔二抗 (1∶500)室溫孵育1 h。使用ECL化學發光液進行顯色。灰度值使用ImageJ V1.49軟件進行分析。
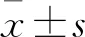
2 結果
2.1 OS細胞系、正常人成骨細胞系中LncRNA LCPAT1 表達比較 OS細胞系Saos-2、U-2OS、MG-63及正常人成骨細胞系hFOB 1.19中LncRNA LCPAT1相對表達量分別為0.83±0.05、0.61±0.03、1.02±0.07、0.13±0.03,OS細胞系Saos-2、U-2OS及MG-63中LncRNA LCPAT1相對表達量高于正常人成骨細胞系hFOB 1.19(P均<0.05)。
2.2 LncRNA LCPAT1對OS細胞增殖的影響 對OS細胞系U-2OS轉染pcDNA3.1-LCPAT1質粒上調LncRNA LCPAT1表達及沉默LncRNA LCPAT1表達后,pcDNA3.1-LCPAT1組、NC組、sh-LCPAT1組LncRNA LCPAT1相對表達量分別為16.3±1.4、8.2±1.2、2.1±0.5,pcDNA3.1-LCPAT1組LncRNA LCPAT1相對表達量高于NC組(P<0.05),sh-LCPAT1組LncRNA LCPAT1相對表達量低于NC組(P<0.05),提示轉染成功,可行后續實驗。CCK-8實驗示轉染24 h,pcDNA3.1-LCPAT1組、NC組及sh-LCPAT1組OD490值比較差異無統計學意義(P均>0.05),轉染48、72及96 h后,pcDNA3.1-LCPAT1組OD490值高于NC組及sh-LCPAT1組(P均<0.05),見表1。

表1 三組細胞增殖能力比較
2.3 LncRNA LCPAT1對OS細胞凋亡的影響 流式細胞術示,pcDNA3.1-LCPAT1組細胞凋亡率為(4.1±0.4)%,NC組為(8.7±0.6)%,sh-LCPAT1組為(13.4±0.8)%,pcDNA3.1-LCPAT1組細胞凋亡率低于NC組及sh-LCPAT1組(P均<0.05)。
2.4 LncRNA LCPAT1對OS細胞侵襲的影響 Transwell 實驗結果顯示,pcDNA3.1-LCPAT1組侵襲細胞數為(354±19)個,NC組為(172±13)個,sh-LCPAT1組為(68±9)個,pcDNA3.1-LCPAT1組侵襲細胞數多于NC組(P<0.05),sh-LCPAT1組侵襲細胞數少于NC組(P<0.05)。
2.5 LncRNA LCPAT1對OS EMT的影響 pcDNA3.1-LCPAT1組E-cadherin蛋白相對表達量低于NC組(P<0.05),pcDNA3.1-LCPAT1組N-cadherin、Snail、Twist1蛋白相對表達量高于NC組(P均<0.05)。sh-LCPAT1組E-cadherin蛋白相對表達量高于NC組(P<0.05),sh-LCPAT1組N-cadherin、Snail、Twist1蛋白相對表達量低于NC組(P均<0.05),見表2。

表2 三組U-2OS細胞EMT相關蛋白表達比較
3 討論
在OS和癌旁組織中多種LncRNA分子存在差異性表達,且LncRNA能通過多種途徑參與OS的發生和進展,可作為OS診斷、預后和治療的潛在分子標志物[7-8]。最近研究[9]顯示,LncRNA TDRG1在OS組織中表達上調,在體外可促進癌細胞增殖和侵襲過程,并通過激活癌細胞的PI3K/AKT 信號途徑而促進OS進展。ZHOU等[10]報道OS中LncRNA PVT1呈過表達,沉默LncRNA PVT1通過對miR-195發揮負調控作用,誘導細胞周期停滯和凋亡,并抑制OS細胞的遷移、增殖和侵襲。SONG等[11]報道,LncRNA PVT1通過miR-497/HK2途徑參與糖代謝和OS細胞的增殖。
LncRNA LCPAT1是最新發現的LncRNA分子,其在腫瘤中的作用尚未進行廣泛研究,目前僅在乳腺癌[6]患者中發現癌組織中LncRNA LCPAT1表達上調,并且其表達與乳腺癌TNM分期、轉移和不良預后相關。本研究發現,在體外培養的OS細胞系中LncRNA LCPAT1表達較人正常成骨細胞系hFOB 1.19表達上調。文獻報道,在非小細胞肺癌組織和細胞系中LncRNA LCPAT1表達上調[5],本研究結果與文獻相符。在體外培養的乳腺癌細胞系功能試驗中發現LncRNA LCPAT1可能通過激活微纖維相關蛋白2基因表達,進而促進癌細胞的增殖和侵襲過程[6]。經吸煙干預人正常肺上皮細胞系Beas-2B后,LncRNA LCPAT1可通過下調染色體濃縮調節蛋白2影響DNA雙鏈損傷修復過程,進而影響染色體結構穩定性[12]。在肺癌中,LncRNA LCPAT1在肺癌組織中高表達,且其高表達與啟動子甲基化程度呈負相關,在肺癌細胞系中下調LncRNA LCPAT1表達,肺癌細胞增殖、遷移、侵襲及自噬過程顯著被抑制,在動物體內實驗中,顯著抑制腫瘤增長[13]。
本研究通過體外培養OS細胞系(U-2OS細胞)中功能獲得和喪失實驗發現,上調OS細胞系中LncRNA LCPAT1表達后,可促進OS細胞增殖和侵襲,并抑制OS細胞凋亡。反之,下調OS細胞系中LncRNA LCPAT1表達后,可抑制OS細胞增殖和侵襲,并促進OS細胞凋亡,上述結果提示LncRNA LCPAT1在OS細胞系中發揮癌基因作用。在OS中LncRNA LCPAT1高表達可通過促進癌細胞增殖和侵襲且抑制凋亡而促進腫瘤進展,進而導致患者預后不良。前期研究我們發現,LncRNA LCPAT1高表達與OS病情進展及預后差相關。上述結果提示,通過抑制或下調OS組織中LncRNA LCPAT1表達可能為OS潛在的治療方式,其可能為OS潛在的治療靶點。
EMT被認為是癌癥發生的初始步驟,并且在癌細胞侵襲和轉移中發揮重要作用[13-14]。在OS的發生和進展過程中,EMT發揮重要作用,其調節涉及大量的基因、蛋白質、LncRNAs和miRNAs調節網絡[15]。最近研究顯示,在OS細胞系中LncRNA CRNDE高表達可激活Wnt/β-catenin 信號途徑促進癌細胞EMT過程而影響OS患者預后[16]。同時研究顯示,OS中LncRNA PGM5-AS1可調節miR-140-5p-FBN1軸進而促進癌細胞EMT過程,導致OS預后不良[17]。本研究通過蛋白印跡發現上調LncRNA LCPAT1后,上皮間皮轉化過程中關鍵蛋白E-cadherin表達降低,而N-cadherin﹑Snail﹑Twist1蛋白表達增加,提示EMT過程受到抑制。反之,下調LncRNA LCPAT1后,EMT過程中關鍵蛋白E-cadherin表達增加,而N-cadherin﹑Snail﹑Twist1蛋白表達降低,提示其能促進EMT過程。本研究結果揭示LncRNA LCPAT1表達可能通過調節EMT過程而促進OS發生和進展,加速OS細胞增殖和侵襲,抑制其凋亡,而導致其不良預后。
綜上所述,OS細胞系中LncRNA LCPAT1表達上調,LncRNA LCPAT1可調節OS細胞系增殖、侵襲、凋亡和EMT過程,LncRNA LCPAT1是OS潛在有希望的治療靶點。

