杜鵑花總黃酮對急性腦缺血/再灌注損傷大鼠STIM-Orai調控的G蛋白偶聯SOCE通路的影響
赫玉香,陸嘉珺,王書凡,姜晨晨,施 磊,尹秀云,陳 卓,曹 迪,沈學彬,韓 軍
(國家中醫藥管理局中藥藥理三級實驗室,安徽省皖南地區植物藥活性物質篩選與再評價工程實驗室,安徽省多糖藥物工程技術研究中心,皖南醫學院藥物研發中心,藥學院藥理學教研室,安徽 蕪湖 241002)
缺血性腦卒中是一種常見的腦血管疾病,是世界上第二大死亡原因。由于腦血管突然阻塞,限制了對腦組織相關區域的血液供應,從而對人類健康造成了嚴重的負面影響。快速再灌注可最大程度地減少腦組織的結構和功能損傷,是最有效的缺血治療方法之一。然而,腦血流的恢復也會導致再灌注損傷。因此,深入研究缺血性腦卒中損傷修復機制對腦功能的重建具有十分重要的意義。
研究表明,Ca2+內流可導致神經元內Ca2+濃度升高,破壞離子平衡,而缺血性損傷引起的神經元內鈣超載,可導致不可逆性的細胞損傷[1]。其中G蛋白偶聯鈣庫操作性鈣離子通道(store-operated calcium entry,SOCE)是介導細胞外Ca2+進入細胞內的重要通道之一,其核心蛋白由位于內質網上的基質相互作用分子(stromal interaction molecule,STIM)和鈣釋放激活鈣通道調節分子(calcium release-activated calcium modulator,Orai)構成[2]。在急性缺血損傷中,STIM2基因敲除后,H9c2細胞內質網鈣釋放減少,線粒體鈣超載減輕[3]。在暴露于全腦缺血大鼠的海馬中,STIM1和Orai1表達的增加被認為是導致過度鈣內流的最主要原因,SOCE通路代表了缺血性神經元死亡的一個重要的非興奮性毒性機制[4]。
杜鵑花總黃酮(total flavones ofRhododendronsimsiiPlanch,TFR)是從中藥杜鵑花中提取的黃酮類有效部位,其主要成分為金絲桃苷、蘆丁、映山紅素等黃酮化合物[5]。研究表明[6],TFR可以舒張大鼠的基底動脈和大腦中動脈,改善腦血液循環。我們課題組前期研究已經證實[5],TFR對全腦缺血/再灌注大鼠腦損傷具有明顯的改善作用,其機制可能與TFR作用于腦基底動脈,激活瞬時受體電位香草醛亞家族4通道(transient receptor potential vanilloid channel 4,TRPV4),繼而激活小電導鈣激活鉀通道與中電導鈣激活鉀通道,阻滯Ca2+內流,促使腦基底動脈舒張有關。盡管SOCE與腦缺血性損傷有關,但TFR改善大腦中動脈閉塞(middle cerebral artery occlusion,MCAO)大鼠腦損傷是否與SOCE通路有關,尚未見相關文獻報道。
本實驗通過大腦中動脈閉塞建立局灶性腦缺血/再灌注損傷模型,探究TFR減輕大鼠急性腦缺血/再灌注損傷與STIM-Orai調控的G蛋白偶聯SOCE通路之間的關系,將有助于對缺血性腦卒中機制的進一步認識,為其防治提供新的思路和候選藥物。
1 材料與方法
1.1 試劑TFR購自上海源葉生物科技科技有限公司(批號:A0276);2-氨基乙基聯苯基硼酸酯(2-APB,批號:D9754)購自美國Sigma公司;IL-1檢測試劑盒(批號:E08055r)、IL-6檢測試劑盒(批號:E04640r)及TNF-α檢測試劑盒(批號:E11987r)均購自Cusabio公司;STIM1抗體(批號:ab108994)、STIM2抗體(批號:ab59342)、Orai1抗體(批號:ab175040)、蛋白激酶B(protein kinase B,PKB)抗體(批號:ab179463)均購自美國Abcam公司;GAPDH(批號:AF7021)、半胱氨酸蛋白酶-3(cysteinyl aspartate specific proteinase 3,caspase-3)抗體(批號:AF7022)購自美國Affinity公司;RevertAid First Strand cDNA Synthesis Kit(批號:K1621)、PowerUp SYBR Green Master Mix(批號:A25742)均購自Thermo Fisher公司。
1.2 儀器腦定位儀(美國哈弗公司);ST8R高速冷凍離心機(Thermo Fisher科技公司);Model 550酶標儀(美國BIO-RAD公司);生理檢測儀(美國哈弗公司);Mini PROTEAN電泳系統(美國BIO-RAD公司);逆轉錄PCR儀(美國ABI公司);Mini PROTEAN轉膜系統(美國BIO-RAD公司);實時熒光定量PCR(美國ABI公司)。
1.3 動物成年雄性SD大鼠(280-320)g,由南京青龍山動物繁殖場提供。許可證號為SCXK(蘇)2017-0001。本實驗已通過皖南醫學院實驗動物倫理委員會批準。將大鼠飼養在塑料籠子中,控制環境,溫度:(23±2)℃,濕度:60%±5%,模擬12 h交替光暗周期。所有動物均可獲得標準飲食和自由飲水。
1.4 分組與給藥將40只SD雄性大鼠隨機分為5組,分別是Sham組、MCAO組、TFR(100 mg·kg-1)組、TFR(100 mg·kg-1)+2-APB(2.5 mg·kg-1)組、2-APB(2.5 mg·kg-1)組,每組各8只。Longa評分1-3分納入實驗,除Sham、MCAO組大鼠給予生理鹽水灌胃外,TFR(100 mg·kg-1)采用術后立即尾靜脈注射給藥,2-APB(2.5 mg·kg-1)術前30 min腹腔注射給藥。
1.5 模型建立及改良Longa評分[7]大鼠用3 %戊巴比妥鈉(40 mg·kg-1)麻醉。分離右側頸總動脈、頸外動脈和頸內動脈。在頸總動脈分叉處上方約4 mm處切開頸外動脈。通過殘端將4.0單絲尼龍栓線插入頸內動脈直到產生阻力。2 h后取出,結扎切口,Sham組不阻斷血流。24 h后按改良Longa評分系統進行評分:0,無神經功能缺損;1,提起尾巴,左前爪緊貼胸口處;2,向左轉圈;3,向左倒下;4,意識低迷,不能自主行走;5,死亡。評分1-3分為造模成功。
1.6 ELISA法檢測血清中IL-1、IL-6、TNF-α含量的變化分組同1.4,再灌注24 h后,將大鼠麻醉,腹主動脈取血置于采血管中,37 ℃烘箱中靜置30 min,離心(4 ℃,10 min),吸取上清液置于EP管中,-80 ℃保存。嚴格按照IL-1、IL-6及TNF-α試劑盒說明書測定。
1.7 HE染色檢測大鼠缺血腦組織的病理變化分組同1.4,再灌注24 h后,處死大鼠,取腦組織在4%多聚甲醛中固定、脫水、二甲苯清洗、石蠟包埋、切片(5 μm厚)。脫蠟、染色、0.3%鹽酸分化、氨水稀釋、0.5%曙紅溶液復染。顯微鏡下觀察大鼠腦組織的病理變化。
1.8 TTC染色法檢測大鼠大腦梗死面積分組同1.4,再灌注24 h后,以3%戊巴比妥鈉(40 mg·kg-1)腹腔注射麻醉后處死大鼠,取腦組織在-20 ℃下冷凍20 min后作冠狀切片。之后在1% TTC中,37 ℃避光染色30 min,4%多聚甲醛溶液固定。在光學顯微鏡下拍攝圖像。梗死面積的比例/%=梗死面積(淺色區)/橫切面總面積×100%。
1.9 Western blot法檢測大鼠腦組織中STIM1、STIM2、Orai1、caspase-3及PKB蛋白表達水平用蛋白裂解緩沖液提取約100 mg腦組織梗死側的總蛋白。12 000 r·min-1離心15 min后,用BCA蛋白濃度試劑盒測定上清液中蛋白質濃度。以10 %十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳,轉膜后牛奶封閉2 h,加入STIM1(1 ∶3 000)、STIM2(1 ∶400)、Orai1(1 ∶200)、caspase-3(1 ∶1 000)及PKB(1 ∶10 000)一抗,4 ℃孵育過夜。再用相應的二抗(1 ∶1 000)室溫孵育2 h,用增強化學發光法測量條帶信號的強度,并用軟件Image J 1.43進行密度分析。
1.10 RT-qPCR法檢測大鼠腦組織中STIM1、STIM2、Orai1、caspase-3及PKB mRNA表達水平用TRIzol從大鼠腦組織梗死側提取總RNA,微量紫外可見分光光度計純化和定量RNA,取約2 μg總RNA合成cDNA。每組選取的均是梗死側相同部位的腦組織。然后用PowerUp SYBR Green Master Mix試劑盒進行實時聚合酶鏈反應。RT反應在95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s下進行,共40個循環,GAPDH為內參。相關基因表達數據用2-ΔΔCt法分析。引物為:GAPDH正向:5′-CTGGAGAAACCTGCCAAGTATG-3′ 反向:5′-GGTGGAAGAATGGGAGTTGCT-3′;STIM1正向:5′-CACCAACACCACCATGACAG-3′;反向:5′-TGCTCCTTGGAGTAACGGTT-3′;STIM2正向:5′-CAAGTTGCCCTGCGCTTTAT-3′ 反向:5′-ATTCACTTTTGCACGCACCG-3′;Orai1正向:5′-TGGCCGTGCACCTGTTC-3′ 反向:5′-TTGCTCACAGCCTCGATGTT-3′;caspase-3正向:5′-ATGTCGATGCAGCTAACC-3′ 反向:5′-GTCTCAATACCGCAGTCC-3′ ;PKB正向:5′-CGCCGCCTGATCAAGATGAC-3′ 反向:5′-TCTGGCCTCAAATCGGATGA-3′。
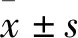
2 結果
2.1 各組大鼠的神經功能評分結果以改良Longa評分為基礎進行神經功能缺損評定,結果如Tab 1所示,與Sham組相比,MCAO組大鼠神經功能評分明顯升高(P<0.01);與MCAO組相比,TFR組大鼠神經功能評分明顯下降(P<0.05);與TFR組或2-APB組相比,TFR+2-APB組大鼠神經功能評分略有降低,但差異無統計學意義(P>0.05)。

Tab 1 Comparison of neurological function scores of rats in each
2.2 TFR及SOCE通道抑制劑對MCAO大鼠血清IL-1、IL-6及TNF-α含量的影響如Fig 1所示,與Sham組相比,MCAO組大鼠血清IL-1、IL-6及TNF-α含量明顯升高(P<0.01)。而TFR組大鼠血清IL-1、IL-6及TNF-α含量明顯低于MCAO組(P<0.01)。與TFR組或2-APB組相比,TFR+2-APB組IL-1、IL-6及TNF-α的含量明顯降低(P<0.05)。

Fig 1 Effects of TFR and SOCE channel inhibitor on contents of IL-1,IL-6 and TNF-α in serum of MCAO **P<0.01 vs Sham;##P<0.01 vs MCAO;&P<0.05,&&P<0.01 vs TFR;$$P<0.01 vs 2-APB
2.3 HE染色觀察MCAO大鼠腦組織的病理變化結果如Fig 2顯示,Sham組大鼠腦組織細胞排列規則,核仁清晰,而MCAO組形態不規則,炎性浸潤,表現為空泡形成、核溶解、細胞壞死。與MCAO組相比,TFR組大鼠腦組織仍有神經元固縮,但梗死側細胞壞死明顯減少;與TFR組或2-APB組相比,TFR+2-APB組大鼠腦組織病理學損傷得到進一步改善。

Fig 2 Effects of TFR and SOCE channel inhibitor on pathological changes of brain tissue in MCAO rats(HE staining,×400)A:Sham;B:MCAO;C:TFR;D:TFR+2-APB;E:2-APB
2.4 TTC染色觀察TFR及SOCE通道抑制劑對大鼠腦組織梗死面積的影響如Fig 3、4顯示,與Sham組比較,MCAO組大鼠腦組織出現大量梗死灶(P<0.01)。與MCAO組相比,TFR組大鼠腦組織梗死灶明顯減少,腦梗死率明顯降低(P<0.01);與TFR組或2-APB組相比,TFR+2-APB組大鼠腦梗死灶進一步減少,腦梗死率進一步降低(P<0.05)。

Fig 3 Photographs of brain sections with TTC stainingA:Sham;B:MCAO;C:TFR;D:TFR+2-APB;E:2-APB

Fig 4 Effects of TFR and SOCE channel inhibitor on cerebral infarction in MCAO **P<0.01 vs Sham;##P<0.01 vs MCAO;&P<0.05 vs TFR;$$P<0.01 vs 2-APB
2.5 TFR及SOCE通道抑制劑對MCAO大鼠腦組織中STIM1、STIM2、Orai1、caspase-3、PKB蛋白表達水平的影響如Fig 5所示,與Sham組相比,MCAO組大鼠腦組織STIM1、STIM2、Orai1、caspase-3蛋白表達明顯上調(P<0.01),PKB蛋白表達明顯下調(P<0.01);TFR組相較于MCAO組STIM1、STIM2、Orai1、caspase-3蛋白表達明顯下調(P<0.05),PKB蛋白明顯上調(P<0.05);與TFR組或2-APB組相比,TFR+2-APB組STIM1、STIM2、Orai1及caspase-3蛋白表達明顯下調(P<0.05),PKB蛋白表達明顯上調(P<0.05)。

Fig 5 Effects of TFR and SOCE channel inhibitor on expression of STIM1,STIM2,Orai1,caspase-3 and PKB protein in brain of MCAO 1:Sham;2:MCAO;3:TFR;4:TFR+2-APB;5:2-APB;**P<0.01 vs Sham;#P<0.05,##P<0.01 vs MCAO;&P<0.05,&&P<0.01 vs TFR;$$P<0.01 vs 2-APB

Fig 6 Effects of TFR and SOCE channel inhibitor on expression of STIM1,STIM2, Orai1,caspase-3 and PKB mRNA in brain of MCAO **P<0.01 vs Sham;#P<0.05,##P<0.01 vs MCAO;&P<0.05 vs TFR;$P<0.05,$$P<0.01 vs 2-APB
2.6 TFR及SOCE通道抑制劑對MCAO大鼠腦組織中STIM1、STIM2、Orai1、caspase-3、PKB mRNA表達水平的影響如Fig 6所示,與Sham組相比,MCAO組腦組織STIM1、STIM2、Orai1、caspase-3 mRNA表達明顯升高(P<0.01),PKB mRNA表達明顯降低(P<0.01);TFR組相較于MCAO組腦組織STIM1、STIM2、Orai1、caspase-3 mRNA表達明顯降低(P<0.05),PKB mRNA明顯升高(P<0.05);與TFR組或2-APB組相比,TFR+2-APB組腦組織STIM1、STIM2、Orai1、caspase-3 mRNA表達明顯降低(P<0.05),PKB mRNA表達明顯升高(P<0.05)。
3 討論
卒中是造成全球成年人永久殘疾的最常見原因之一,可能會導致視覺、感覺和運動行為障礙。盡管組織型纖溶酶原激活劑已被批準用于卒中治療20多年,但很少有卒中患者真正得到根本性治愈[8]。因此,研究腦卒中的病理分子機制與篩選出具有神經保護作用的新型抗腦卒中藥物已成為現代中醫藥的重要課題之一。TFR是一種黃酮類化合物,本課題組前期研究表明,TFR具有減輕腦水腫、舒張血管、增加腦血流量等抗缺血性腦卒中作用[5]。
腦缺血可引發炎癥反應,導致小膠質細胞活化,從而產生更多的細胞毒物質,包括IL-1、IL-6、TNF-α和其他促炎癥介質,進一步導致神經元損傷[9]。研究表明,無論何種原因導致內質網中Ca2+水平下降而引起細胞Ca2+內流的方式被稱為SOCE[10]。SOCE可以利用內質網Ca2+耗竭作為激活信號,促進Ca2+內流,以響應內質網Ca2+的釋放。并且導致缺血/缺氧性神經元死亡的主要機制之一是鈣超載[11]。2-APB是G蛋白偶聯SOCE通路特異性阻斷劑[12]。本課題組研究結果顯示,用藥TFR后,原本升高的MCAO大鼠神經功能評分及血清中IL-1、IL-6及TNF-α含量明顯降低,腦組織病理損傷明顯改善,核溶解減輕,梗死灶明顯減少,腦梗死率明顯降低。而聯用SOCE抑制劑2-APB阻斷SOCE信號通路后,MCAO大鼠神經功能評分及血清中上述生化指標進一步降低,腦組織損傷進一步得到改善。表明,TFR與SOCE通道抑制劑2APB聯用可以有效改善大鼠神經功能損傷,減少炎癥因子的釋放,進而保護受損神經元。
研究發現,SOCE通路由STIM和Orai共同介導[2]。目前已知STIM蛋白存在STIM1和STIM2兩種亞型。Orai有三種異構體,即Orai1、Orai2和Orai3,它們形成介導Ca2+進入細胞的通道[10]。研究表明,與野生型小鼠相比,STIM1-/-和Orai1-/-骨髓嵌合體在MCAO誘導后24 h的梗死體積均明顯減小[13]。而STIM2的上調引發了SOCE的增加,線粒體Ca2+超載[14]。在短暫MCAO模型中,用SOCE特異性阻滯劑2APB預處理可減輕野生型小鼠的腦損傷,與Orai1-/-骨髓嵌合體小鼠相似[12]。STIM1、STIM2、Orai1與缺血性腦損傷密切相關,而Orai2和Orai3尚不清楚[15-16]。PKB能夠影響細胞的存活、增殖和抑制細胞的凋亡,以維持神經系統正常功能。caspase-3作為細胞凋亡的執行者,在細胞凋亡途徑中發揮重要作用,它的激活預示著細胞的死亡。為了進一步研究TFR減輕大鼠腦缺血/再灌注損傷作用與SOCE信號通路之間的關系。我們通過Western blot和RT-qPCR分別觀察了TFR對大鼠腦組織中SOCE信號通路相關信號分子STIM1、STIM2、Orai1的蛋白與mRNA表達及caspase-3、PKB的表達水平。結果顯示,MCAO組相較于Sham組,大鼠腦組織中STIM1、STIM2、Orai1、caspase-3的蛋白及mRNA表達均明顯升高,PKB的蛋白及mRNA表達明顯降低,此結果與Lang等[17]報道基本一致。而用藥TFR后,TFR明顯下調了大鼠腦組織中STIM1、STIM2、Orai1、caspase-3的蛋白及mRNA表達,上調了PKB的蛋白及mRNA表達。而聯用2-APB后,STIM1、STIM2、Orai1、caspase-3的基因表達進一步下調,PKB的基因表達進一步上調。表明,TFR與SOCE通道特異性阻斷劑2-APB聯用可增強抑制SOCE通道基因表達的作用。提示,TFR減輕MCAO大鼠缺血/再灌注腦損傷的作用可能與其抑制腦組織SOCE信號通道,減少細胞凋亡,促進細胞存活有關。
綜上,在急性腦缺血損傷發生時,TFR可能通過抑制腦組織SOCE信號通路,降低鈣超載,減少炎癥介質釋放和細胞凋亡,促進細胞存活,從而發揮腦神經保護作用。鑒于中藥復方制劑的作用機理多為多靶點、多通道、多層次,結合課題組前期研究成果[18],我們推測,TRPV4通道、SOCE信號通路或一些其他信號通路可能均參與了TFR減輕MCAO大鼠腦缺血/再灌注損傷的保護作用,其深入的機制還有待于進一步研究。

