Chidamide誘導(dǎo)的LncRNA ENST00000448869.1靶向作用Nestin抑制乳腺癌MDA-MB-231細(xì)胞的生長(zhǎng)
郭亞瑞,周偉強(qiáng)
(沈陽醫(yī)學(xué)院基礎(chǔ)醫(yī)學(xué)院病原生物學(xué)教研室,遼寧 沈陽 110034)
乳腺癌是女性最常見的惡性腫瘤,也是女性癌癥相關(guān)死亡的重要原因。目前,乳腺癌的發(fā)病率和死亡率仍在逐年上升,其發(fā)生發(fā)展的分子機(jī)制需要深入地探索[1-2]。三陰性乳腺癌(triple negative breast cancer,TNBC),由于其侵襲性和缺乏治療靶點(diǎn),且雌激素受體(estrogen receptor,ER)、孕激素受體(progesterone receptor,PR)和人表皮生長(zhǎng)因子受體2型(human epidermal growth factor receptor-2,HER-2)都是陰性,無特異性治療靶點(diǎn),是乳腺癌中一類高度異質(zhì)性的亞型[3-4]。
近年來,組蛋白去乙酰化酶抑制劑(histone deacetylase inhibitor,HDACi)在體內(nèi)、外對(duì)實(shí)體瘤和血液系統(tǒng)惡性腫瘤顯示出良好的抗腫瘤活性[2]。西達(dá)苯胺(chidamide)是一種新型口服活性苯甲酰胺類HDACi,選擇性抑制組蛋白去乙酰化酶(histone deacetylase,HDAC)1、2、3和10的活性,HDAC 1、2、3和10是參與腫瘤細(xì)胞及其周圍微環(huán)境中腫瘤起始和發(fā)展并在其中發(fā)揮重要作用的酶。作為一種表觀遺傳調(diào)節(jié)劑,Chidamide誘導(dǎo)腫瘤細(xì)胞生長(zhǎng)停滯和凋亡,并增強(qiáng)細(xì)胞抗腫瘤免疫[5]。
越來越多的研究表明,長(zhǎng)非編碼核糖核酸(long non-coding RNA,LncRNA)作為一類新的重要的細(xì)胞生物學(xué)行為調(diào)控因子,在腫瘤的發(fā)生、發(fā)展和轉(zhuǎn)移中起著重要的作用[2]。LncRNA是基因組中非蛋白質(zhì)編碼區(qū)的一大類轉(zhuǎn)錄物,長(zhǎng)度超過200個(gè)核苷酸。最近的研究表明,LncRNA調(diào)節(jié)許多重要的癌癥病理過程,如腫瘤發(fā)生、增殖、轉(zhuǎn)移和耐藥性[6-8]。LncRNA主要通過與關(guān)鍵調(diào)節(jié)蛋白相互作用來調(diào)節(jié)其功能或表達(dá)[8]。本文將Chidamide作用于三陰性乳腺癌MDA-MB-231細(xì)胞,研究相關(guān)LncRNA在Chidamide作用乳腺癌MDA-MB-231細(xì)胞中的表達(dá)情況,探討相關(guān)LncRNA在Chidamide抑制乳腺癌細(xì)胞生長(zhǎng)中的調(diào)控機(jī)制,為進(jìn)一步明確LncRNA與蛋白在乳腺癌細(xì)胞中的分子作用機(jī)制,提供相應(yīng)的理論基礎(chǔ)和實(shí)驗(yàn)數(shù)據(jù)。
1 材料與方法
1.1 材料人乳腺癌細(xì)胞株MDA-MB-231細(xì)胞(ATCC細(xì)胞庫);RPMI 1640培養(yǎng)基(A4192301)、胎牛血清(A3160902)、青鏈霉素(KGY0023,Thermo Scientific);Chidamide(Chipscreen Biosciences Ltd);Muse Count &Viability試劑盒(13-0618,Millipore);RNA提取試劑盒(1182866500,Roche);Power SYBR Green PCR Master mix(4367659,Life Technologies);一抗抗體(Abcam lnc);ECL化學(xué)發(fā)光試劑盒(B2162617,Roche);LncRNA ENST00000448869.1小干擾RNA(small interfering RNA,siRNA)購自廣州銳博生物技術(shù)有限公司;細(xì)胞分析儀(德國Premego),超微量核酸檢測(cè)儀NanoDrop-2000(美國Thermo Fisher),PCR擴(kuò)增儀Mastercyler(美國Eppendorf),實(shí)時(shí)定量PCR儀7500(美國Life Technology),電泳系統(tǒng)及轉(zhuǎn)膜系統(tǒng)(美國BIO-Rad),多通道化學(xué)發(fā)光成像系統(tǒng)MF-Chemi BIS2.0(以色列DNR)。
1.2 方法
1.2.1細(xì)胞培養(yǎng) 人乳腺癌MDA-MB-231細(xì)胞使用含10%胎牛血清的RPMI 1640培養(yǎng)基(100 kU·L-1青霉素和100 mg·L-1鏈霉素),置于37 ℃,5%CO2,95%濕度培養(yǎng)箱中培養(yǎng)。當(dāng)細(xì)胞長(zhǎng)至培養(yǎng)瓶底70%-80%時(shí),將細(xì)胞接種至96孔板(1×107個(gè)·L-1)或6孔板(5×108個(gè)·L-1)各孔中。將已貼壁細(xì)胞更換為無血清培養(yǎng)基進(jìn)行同步化處理后再進(jìn)行下列實(shí)驗(yàn)。
1.2.2高通量測(cè)序篩選陽性LncRNA 將Chidamide與MDA-MB-231細(xì)胞共同培養(yǎng)24 h,抽提樣品的總RNA后,利用去核糖體試劑盒將rRNA去除,并將RNA片段化(平均片段長(zhǎng)度約為200 nt左右),逆轉(zhuǎn)錄合成單鏈cDNA,再合成雙鏈cDNA并純化,接著末端修復(fù)并加接頭引物,PCR擴(kuò)增并純化,然后再對(duì)文庫進(jìn)行質(zhì)檢,最后上機(jī)測(cè)序。之后聯(lián)合生物信息學(xué)軟件分析篩選陽性LncRNA分子。通過蛋白互作生物學(xué)軟件推測(cè)該LncRNA分子的互作蛋白。
1.2.3MTT和細(xì)胞活力實(shí)驗(yàn) 將不同濃度的Chidamide(0、20、100 μmol·L-1)與MDA-MB-231細(xì)胞共同孵育24 h,經(jīng)胰酶消化后收集細(xì)胞。進(jìn)行MTT實(shí)驗(yàn),在490 nm的微孔板讀數(shù)器上測(cè)量吸光度;收集約2×105個(gè)(50 μL細(xì)胞懸液)細(xì)胞,每組細(xì)胞中加入450 μL Count &Viability reagent,混勻室溫靜置后應(yīng)用Muse自動(dòng)細(xì)胞分析儀檢測(cè)細(xì)胞活力。
1.2.4LncRNA ENST00000448869.1 siRNA(1、2、3)轉(zhuǎn)染 根據(jù)Lipofectamine 3000轉(zhuǎn)染試劑使用說明,先將無血清培養(yǎng)基與適量lipofectamine 3000轉(zhuǎn)染試劑混合,室溫放置5 min。再將無血清培養(yǎng)基分別與適量的LncRNA ENST00000448869.1 siRNA1、2、3混合,室溫放置5 min。然后將兩種混合液移到1.5 mL離心管中混勻后靜置5 min,將轉(zhuǎn)染復(fù)合物分別與六孔板中的MDA-MB-231細(xì)胞混合,培養(yǎng)24 h后進(jìn)行后續(xù)實(shí)驗(yàn)。LncRNA ENST00000448869.1 siRNA的靶序列為,siRNA1:5′-GCTCTCCTGATCA ATACAT-3′;siRNA2:5′-CCAAAGTCTCCCAGTCAAT-3′;siRNA3:5′-GGCTGGAACTTAACGCTGT-3′。
1.2.5RNA提取和Real-time PCR 將Chidamide與MDA-MB-231細(xì)胞共同孵育24 h,按照RNA提取試劑盒說明進(jìn)行,合成第一鏈cDNA后應(yīng)用SYBR Green方法進(jìn)行Real-time PCR,以GAPDH為內(nèi)參進(jìn)行反應(yīng),檢測(cè)mRNA水平。LncRNA ENST0000044 8869.1引物序列Forward為5′-AGGCCTCGTTCAC CTTGACG-3′,Reverse為5′-CCCTTGCCACGTCCAC TACC-3′;Nestin引物序列Forward為5′-GCTGA AGCCCTGGGGAAAGT-3′,Reverse為5′-CCAGGGGAGTGGAGTCTGGA-3′。
1.2.6Western blot檢測(cè) 將Chidamide與MDA-MB-231細(xì)胞共同孵育24 h,收集細(xì)胞提取總蛋白,并用BCA法測(cè)定蛋白含量。取等量蛋白樣品煮沸10 min,經(jīng)SDS-聚丙烯酰胺凝膠電泳后,將蛋白轉(zhuǎn)至PVDF膜上,4 ℃封閉過夜,洗膜,然后經(jīng)過一抗孵育、洗膜、二抗孵育、ECL化學(xué)發(fā)光、凝膠成像系統(tǒng)成像。
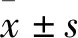
2 結(jié)果
2.1 LncRNA ENST00000448869.1分子的表達(dá)水平在Chidamide處理后增高如Fig 1 LncRNA差異表達(dá)火山圖和熱圖分析結(jié)果顯示,用Chidamide處理乳腺癌MDA-MB-231細(xì)胞后提取RNA,通過18 s/28 s RNA比率質(zhì)控后合成cDNA。應(yīng)用高通量測(cè)序發(fā)現(xiàn)LncRNA ENST00000448869.1豐度比對(duì)照組明顯增高。在Chidamide處理乳腺癌MDA-MB-231細(xì)胞前后LncRNA ENST00000448869.1出現(xiàn)差異表達(dá),Chidamide處理使ENST00000448869.1表達(dá)水平升高。結(jié)果表明,LncRNA ENST00000448869.1可能參與Chidamide作用乳腺癌細(xì)胞后細(xì)胞生長(zhǎng)的調(diào)控。

Fig 1 The volcano map and heat map of LncRNA differential expression (MDA-MB-231Basal—MDA-MB-231CHid)The abscissa represented the change of expression multipleof LncRNA in different samples;the ordinate represented the statistical significance of the difference in gene expression,the red dot indicated that LncRNA was significantly up-regulated and the green dot indicated that LncRNA was significantly down-regulated.

Fig 2 Assay for Chidamide concentration-response effect by MTT and cell viability assay by Muse cell analyzer in MDA-MB-231 cells
2.2 LncRNA ENST00000448869.1分子與Nestin蛋白之間存在互作關(guān)系通過選取LncRNA ENST00000448869.1,可以繪制該LncRNA與其靶基因互相作用的網(wǎng)絡(luò)圖,從而為整體性地分析LncRNA在樣品中發(fā)揮的功能提供參考與幫助。蛋白互作生物學(xué)軟件推測(cè)LncRNA ENST00000448869.1分子與Nestin存在蛋白互作關(guān)系。因此,我們可以認(rèn)為Chidamide作用乳腺癌細(xì)胞后,可能存在LncRNA ENST00000448869.1與Nestin蛋白的相互作用而影響細(xì)胞生長(zhǎng)。
2.3 Chidamide抑制乳腺癌MDA-MB-231細(xì)胞生長(zhǎng)我們將0、20、100 μmol·L-1的Chidamide與乳腺癌MDA-MB-231細(xì)胞共同孵育24 h,進(jìn)行MTT檢測(cè)和細(xì)胞活力實(shí)驗(yàn),F(xiàn)ig 2結(jié)果顯示,20 μmol·L-1的Chidamide作用乳腺癌細(xì)胞,在490 nm處吸光度明顯降低,100 μmol·L-1的吸光度明顯降低,說明Chidamide作用后降低乳腺癌細(xì)胞的細(xì)胞活力;與對(duì)照組相比,低劑量(20 μmol·L-1)的Chidamide對(duì)乳腺癌細(xì)胞有抑制作用;高劑量(100 μmol·L-1)的Chidamide作用MDA-MB-231后,細(xì)胞活率為57.1%,明顯低于對(duì)照組細(xì)胞活率71.0%,抑制效果更明顯。
2.4 Chidamide作用乳腺癌MDA-MB-231細(xì)胞后LncRNA ENST00000448869.1和Nestin表達(dá)都增高為了驗(yàn)證LncRNA的分析結(jié)果,我們應(yīng)用QPCR檢測(cè)了乳腺癌MDA-MB-231細(xì)胞系中ENST00000448869.1片段的表達(dá)情況。同時(shí)為了明確Chidamide誘導(dǎo)乳腺癌MDA-MB-231細(xì)胞增殖中LncRNA ENST00000448869.1以及Nestin的表達(dá)水平,我們測(cè)定了0、20、100 μmol·L-1的Chidamide作用乳腺癌細(xì)胞后其LncRNA ENST00000448869.1和Nestin的mRNA表達(dá)水平,F(xiàn)ig 3結(jié)果顯示,乳腺癌MDA-MB-231細(xì)胞中LncRNA ENST0000044 8869.1含量在低劑量(20 μmol·L-1)和高劑量(100 μmol·L-1)Chidamide處理后都明顯上升,而Nestin的表達(dá)也在低劑量和高劑量Chidamide處理后比對(duì)照組明顯增加。該結(jié)果表明,Chidamide可以促進(jìn)LncRNA ENST00000448869.1和其互作蛋白Nestin的mRNA表達(dá)水平,說明Chidamide處理乳腺癌細(xì)胞后可能存在LncRNA ENST00000448869.1和Nestin之間的調(diào)控機(jī)制。具體的分子機(jī)制有待進(jìn)一步探索。

Fig 3 The mRNA expression of LncRNA ENST00000448869.1 and Nestin induced by Chidamide in breast cancer cells n=3)*P<0.05,**P<0.01 vs Basal.
2.5 LncRNA ENST00000448869.1 siRNA轉(zhuǎn)染降低乳腺癌細(xì)胞中LncRNA ENST00000448869.1和Nestin的mRNA和蛋白水平針對(duì)LncRNA ENST00000448869.1分子序列設(shè)計(jì)3對(duì)特異siRNA片段用以靜默相關(guān)LncRNA的表達(dá),LncRNA ENST00000448869.1 siRNA轉(zhuǎn)染MDA-MB-231細(xì)胞后,與Chidamide共同孵育24 h,進(jìn)行細(xì)胞活力檢測(cè);Real-time PCR測(cè)定LncRNA ENST00000448869.1的mRNA表達(dá)水平;Western blot實(shí)驗(yàn)檢測(cè)Nestin的蛋白表達(dá)水平。Fig 4結(jié)果顯示:siRNA靜默LncRNA ENST00000448869.1后可明顯增強(qiáng)Chidamide對(duì)MDA-MB-231細(xì)胞的藥理殺傷作用,其中siRNA3作用活細(xì)胞比率為19.1%,抑制效果最明顯。Fig 5結(jié)果顯示:siRNA可明顯抑制LncRNA分子ENST00000448869.1 mRNA分子的表達(dá);Western blot結(jié)果顯示:siRNA轉(zhuǎn)染細(xì)胞后,受Chidamide激活的Nestin的表達(dá)被明顯抑制。這些結(jié)果可以說明,siRNA有效靜默LncRNA ENST00000448869.1分子后,乳腺癌細(xì)胞活力比對(duì)照組和Chidamide處理組明顯降低,Nestin的表達(dá)也受到抑制,表明,LncRNA ENST00000448869.1分子可以靶向調(diào)控Nestin的表達(dá),從而增加Chidamide對(duì)乳腺癌MDA-MB-231細(xì)胞的藥理作用,抑制細(xì)胞生長(zhǎng)。

Fig 4 Muse cell analysis for LncRNA-siRNA:siRNA 1,2,3 transfected into breast cancer cells respectively and incubated with Chidamide for 24 hours (n=3)

Fig 5 Assay for LncRNA mRNA expression induced by LncRNA siRNA1,2,3 transfected into breast cancer cells respectively and Nestin expression n=3)*P<0.05 vs Basal,##P<0.01 vs Chidamide.
3 討論
乳腺癌在全球范圍內(nèi)女性癌癥中發(fā)病率和死亡率都很高,乳腺癌的發(fā)生不僅與遺傳和內(nèi)分泌因素有關(guān),還與LncRNA、miRNAs和蛋白質(zhì)表達(dá)不當(dāng)有關(guān)[9-10]。HDACi是一組有前景的抗癌藥物,通過改變?nèi)旧|(zhì)結(jié)構(gòu)和基因表達(dá),在誘導(dǎo)癌細(xì)胞凋亡和細(xì)胞周期停滯中具有潛在作用[11]。Chidamide作為新一代的HDACi,不會(huì)明顯增加化療的副作用[12]。我們將Chidamide與乳腺癌MDA-MB-231細(xì)胞共同孵育,利用Muse自動(dòng)細(xì)胞分析儀發(fā)現(xiàn),Chidamide可以降低MDA-MB-231細(xì)胞活力,抑制細(xì)胞生長(zhǎng)。
LncRNA被認(rèn)為是最敏感和特異的癌癥生物標(biāo)志物之一,在不同水平上參與各種癌癥的發(fā)展和進(jìn)展,包括表觀遺傳、轉(zhuǎn)錄和轉(zhuǎn)錄后調(diào)節(jié)[13]。有研究表明,LncRNA是乳腺癌發(fā)展的關(guān)鍵調(diào)節(jié)因子,與控制自噬有關(guān),因此識(shí)別與自噬相關(guān)的具有乳腺癌預(yù)后價(jià)值的LncRNA是至關(guān)重要的[13]。雖然已經(jīng)報(bào)道了LncRNA通過介導(dǎo)轉(zhuǎn)化生長(zhǎng)因子β(transforming growth factor-β,TGF-β)前轉(zhuǎn)移作用和調(diào)節(jié)上皮間質(zhì)轉(zhuǎn)化(epithelial-mesenchymal transition,EMT)來調(diào)節(jié)腫瘤轉(zhuǎn)移,并且有些LncRNA轉(zhuǎn)錄物參與乳腺癌的發(fā)生,但是LncRNA在乳腺癌治療中的生物學(xué)作用還沒有得到很好的研究[14]。我們通過高通量測(cè)序聯(lián)合生物信息學(xué)軟件分析篩選出LncRNA ENST00000448869.1分子在經(jīng)Chidamide作用后表達(dá)增高,我們進(jìn)一步通過實(shí)時(shí)熒光定量PCR驗(yàn)證了ENST00000448869.1的準(zhǔn)確性。進(jìn)一步的后續(xù)實(shí)驗(yàn)可以檢測(cè)LncRNA ENST00000448869.1是否與細(xì)胞自噬相關(guān)。
Nestin是第VI型中間絲蛋白,實(shí)驗(yàn)?zāi)P秃腿祟悩颖径急砻鱊estin在許多類型的腫瘤和一些其他的組織中的表達(dá)上調(diào)[15]。Nestin與腫瘤發(fā)生相關(guān),因?yàn)樗诎┌Y組織中的表達(dá)高于正常組織,尤其在小腫瘤血管和基質(zhì)癌細(xì)胞中Nestin出現(xiàn)高表達(dá)[16]。因此Nestin可以作為乳腺癌新血管生成的重要標(biāo)志物。我們通過蛋白互作分析軟件的結(jié)果,說明LncRNA ENST00000448869.1分子與Nestin存在蛋白互作關(guān)系。我們通過Real-time PCR驗(yàn)證了在Chidamide作用乳腺癌細(xì)胞后Nestin的mRNA表達(dá)增高。為了進(jìn)一步驗(yàn)證LncRNA ENST00000448869.1和Nestin在乳腺癌MDA-MB-231細(xì)胞中的調(diào)控作用,我們?cè)O(shè)計(jì)了特異siRNA來靜默相關(guān)基因的轉(zhuǎn)錄。我們利用siRNA抑制LncRNA ENST0000044 8869.1分子的轉(zhuǎn)錄后,在Chidamide作用細(xì)胞時(shí),siRNA明顯抑制了LncRNA的表達(dá),同時(shí)在siRNA的作用下Nestin的mRNA和蛋白表達(dá)量也呈下降趨勢(shì),與此同時(shí)細(xì)胞死亡率也隨之下降。這些結(jié)果說明了LncRNA ENST00000448869.1分子靶向調(diào)控Nestin的表達(dá)降低,可以抑制乳腺癌MDA-MB-231的細(xì)胞生長(zhǎng)。
總之,我們的實(shí)驗(yàn)只是初步證實(shí)了在Chidamide作用乳腺癌MDA-MB-231細(xì)胞后,可能存在LncRNA ENST00000448869.1和Nestin之間的調(diào)控機(jī)制抑制乳腺癌細(xì)胞生長(zhǎng)。LncRNA ENST0000044 8869.1和Nestin之間具體的作用機(jī)制需要進(jìn)一步的實(shí)驗(yàn)驗(yàn)證。本研究為進(jìn)一步的探索LncRNA ENST00000448869.1在乳腺癌細(xì)胞生長(zhǎng)作用中的機(jī)制提供了實(shí)驗(yàn)基礎(chǔ)。
(致謝:衷心感謝沈陽醫(yī)學(xué)院遼寧省環(huán)境污染與微生態(tài)重點(diǎn)實(shí)驗(yàn)室為本實(shí)驗(yàn)提供的實(shí)驗(yàn)設(shè)備,感謝實(shí)驗(yàn)室全體工作人員對(duì)本實(shí)驗(yàn)的大力協(xié)助。)

